発表のポイント
- 不安障害やうつ病、疼痛障害に関連する行動抑制系に関する脳の働きの理解は、それに基づく治療戦略を立てる上で有用な知見になることが期待できる。
- 不安や抑うつ症状が強いと、上手くいくかわからないことや、予期しない新しい状況などに対して行動が消極的になり、罰を回避する傾向が強くなる。
- 罰を回避する傾向の強い人は、不安や抑うつなどの負の感情制御に関わる前頭葉脳機能ネットワークの働きが弱く、セロトニン2A受容体1)密度が低いということがわかった。
国立研究開発法人量子科学技術研究開発機構(理事長 平野 俊夫。以下「量研」という。)量子生命・医学部門量子医科学研究所脳機能イメージング研究部(主は量子生命科学研究所量子認知脳科学グループ)の山田 真希子グループリーダー、および千葉大学大学院医学研究院脳神経内科学の小島一歩医師、平野成樹診療准教授、桑原聡教授らの共同研究グループは、罰を回避する行動にセロトニン神経伝達機能が関わっていることを発見しました。
人間を含む動物の行動は、目標達成や報酬獲得のために行動を賦活する系と罰や損害を回避するために行動を抑制する系の大きく二つの動機づけシステムによって制御されていると考えられています。行動を抑制する系(行動抑制系)は、人間においては不安や抑うつなどの負の感情と関連していますが、行動抑制系に関して脳で何が起きているかは明らかにされていません。
これまでの研究で、脳内に広く分布しているセロトニン2A受容体は、不安、抑うつ、痛みなどの負の感情の調節に関与していることが報告されています。そこで本研究では、質問紙検査による罰回避や不安傾向の程度の測定と、PET2)検査による脳内のセロトニン2A受容体密度の測定および安静時fMRI3)による脳活動の測定を行いました。
その結果、罰回避傾向が強い人は、負の感情を制御する前頭葉の脳機能ネットワークが弱く、前頭葉のセロトニン2A受容体密度が低いことがわかりました。これは、人間の行動抑制系に関して脳で何が起きているか分子レベルで初めて明らかにした結果であり、不安障害やうつ病、疼痛障害(心因性疼痛)といった精神・神経疾患に関わる動機づけシステムを客観的に評価し、それに基づく治療戦略を立てる上で有用な知見になることが期待できます。
本研究は、JSPS科研費(JP20H05711)、日本医療研究開発機構(AMED)「脳科学研究推進プログラム」、文部科学省 光・量子飛躍フラッグシッププログラム(Q-LEAP、JPMXS0120330644)の支援を受けて行われたものです。この成果は、2022年1月10日に「Brain Imaging Behavior」(インパクトファクター 3.97)のオンライン版に掲載されました。
研究開発の背景と目的
人間を含む動物の行動の基本的な特徴は、報酬への接近と罰の回避の二つに大きく分類されると古くから議論されてきました。人間においては、この二つの動機づけシステムによって、その人の気質・性格が特徴づけられると考えられています。行動賦活系は、ポジティブな結果(報酬)につながる行動を促進し、希望・高揚・幸福などのポジティブな感情に関与しています。一方、行動抑制系はネガティブな結果(罰)につながる行動を抑制し、恐怖・不安・欲求不満・悲しみなどのネガティブな感情に関与しています。
ネガティブな感情を持ち続けると、やがて不安障害やうつ病、疼痛障害といった精神疾患を発症してしまう場合があります。新型コロナウイルス感染症の発生などを背景に、うつ病患者数や自殺者数の増加が社会問題となる中、政府の研究開発推進事業の中には、精神的に豊かで躍動的な社会を実現するため、こころの安らぎや活力の増大をかなえる科学技術の確立が掲げられています。
これまで、報酬を動機として様々なことに躍動的にチャレンジする行動賦活系は、ドーパミン4)の働きと関係していることが知られていますが、行動抑制系に関しては、脳内分子・神経メカニズムは明らかにされていません。行動抑制系の脳内メカニズムが明らかになれば、不安障害やうつ病、疼痛障害など行動抑制系の働き過ぎによる精神症状のメカニズムについて理解が進み、脳内分子・神経メカニズムに基づく治療戦略を創出することができます。また、二つの動機づけシステムからなる人間の気質を、脳科学的な特徴に基づき評価することができるようになります。
これまでの研究で、脳内に広く分布しているセロトニン2A受容体は、不安、抑うつ、痛みなどの負の感情の調節に関与していることが報告されています。そこで本研究では、行動抑制系の脳内メカニズムを明らかにするために、負の感情に関わる脳部位のセロトニン2A受容体密度と罰回避傾向の個人差との関連性を調べました。
研究の手法と成果
健常成人16名に、脳内のセロトニン2A受容体に結合する[18F]アルタンセリンという放射性薬剤を用いたPET検査、安静時fMRI検査、罰の回避と報酬への接近の感受性尺度5)、ベック絶望感尺度6)、状態不安尺度7)を用いた質問紙検査を行いました。
質問紙検査の結果、罰への感受性が高い人ほど、絶望感と不安が高いことが判明しました(図1)。
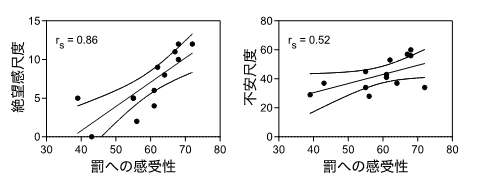
図1罰回避傾向と絶望感および不安との相関
罰への感受性の程度と絶望感および不安は正の相関を持つ。罰への感受性が高い人ほど絶望感と不安は高く、罰への感受性が低い人ほど絶望感と不安は低い。
次に、図2(白矢印)に示すように、PET解析結果から、罰への感受性と中帯状皮質前方部8)のセロトニン2A受容体密度は負の相関を持ち、罰への感受性が高い人はセロトニン2A受容体密度が低いことがわかりました。さらに、中帯状皮質前方部のセロトニン2A受容体密度は中帯状皮質前方部と中前頭回9)の機能的結合の強さと正の相関を示すことから、中帯状皮質前方部のセロトニン2A受容体密度が低いと、中帯状皮質前方部と中前頭回の機能的結合が弱いということが判明しました。中帯状皮質前方部と中前頭回の機能的結合は、負の感情の制御に関わっていることが知られています。
また、中帯状皮質前方部と中前頭回の機能的結合は罰への感受性と負の相関を示すことから、中帯状皮質前方部と中前頭回の機能的結合が弱いと、罰への感受性が高いということが明らかになりました。
さらに、これら三者(罰への感受性、セロトニン受容体、機能的結合)の因果関係を明らかにするために媒介解析10)を行った結果、罰への感受性とセロトニン2A受容体密度の関係に、中帯状皮質前方部と中前頭回の機能的結合が影響していることが明らかになりました(図2青色太矢印)。
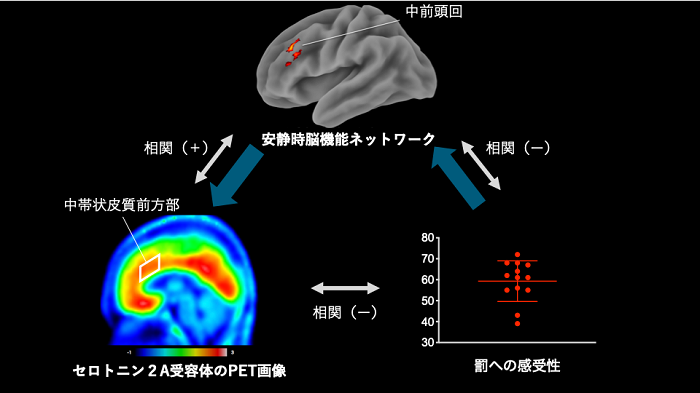
図2 罰回避傾向とセロトニン2A受容体および安静時脳機能ネットワークの関係
罰への感受性が高い人は、前頭葉脳機能ネットワークが弱く、前頭葉のセロトニン2A受容体密度が低い。セロトニン2A受容体のPET画像では、赤いほどセロトニン2A受容体密度が高いことを示す。青色太矢印は媒介解析結果の因果関係を示す。
今後の展開
本研究では、罰感受性が高く行動抑制系が働きやすい気質の人は、負の感情を制御することで知られる中帯状皮質前方部と中前頭回の脳ネットワークの働きが弱く、中帯状皮質前方部セロトニン2A受容体密度が低いということを明らかにしました。今回の結果から、不安障害、うつ病、疼痛障害など、行動抑制に関連する症状には、セロトニン神経伝達の機能を調節する薬剤が有効である可能性が示唆されます。今後、セロトニン神経伝達の機能を調節する薬剤を用いた介入研究を行い、今回の研究で得られた動機づけ特性と分子機能および脳機能との関係を解明することは、様々なことにチャレンジする活力を増大する科学技術の創出につながると期待されます。
用語解説
1)セロトニン2A受容体
セロトニンは中枢神経系に存在する神経伝達物質で、ドーパミン・ノルアドレナリンを制御し精神を安定させる働きがある。セロトニンが低下すると、不安やうつなどの精神症状を惹起すると考えられている。セロトニン2A受容体は中枢神経系に広く分布している。
2)PET
ポジトロン断層撮像法(positron emission tomography:PET)のこと。専用の装置で陽電子を検出することによって計測されたデータをコンピューター処理して、さまざま病態や生体内物質の挙動を画像化する技術である。生体において、脳神経受容体などの脳神経伝達機能の分子指標を定量的に画像化することで、脳の機能を調べることができる。
3)安静時fMRI
fMRIとは機能的核磁気共鳴画像法(functional magnetic resonance imaging: fMRI)のこと。これは神経細胞の活動に伴う血流動態反応を視覚化する技法であるが,特別な課題をせず,安静にしている状態での血流動態反応の測定のことを安静時fMRIという。
4)ドーパミン
脳内で分泌される神経伝達物質で、快感情・意欲・学習・運動調節・認知機能・ホルモン調節などに関わる。
5)罰の回避と報酬への接近の感受性尺度
グレイの強化感受性理論に基づき、行動抑制系と行動賦活系の個人差を測定するために作成された尺度(Torrubia et al., 2001参考文献1)。行動抑制系を測定するための罰への感受性の質問項目は、以下がある(一部抜粋)。
- 何かが手に入るかどうか不確かなとき,それについて欲しがらないほうがよいと思いますか?
- 新しい状況や予期しない状況をよく不安に思いますか?
- 十分に準備していなかった仕事や課題があるとき、それがうまくいかないかもしれないことがとても気になりますか?
- 困難な状況下では、あなたはたいてい弱気になりますか?
- あなたは、自分がやったこと、やらねばならないことについて考えていると、眠りにつけないことがよくありますか?
- 自分が言ったことや行ったことによってよく心配になりますか?
- 一般的に、楽しい出来事よりも、良くないことが起きるおそれに、より注意を払いますか?
- 気恥ずかしい思いをしないように、ものごとを行うことを差し控えることがありますか?
6) ベック絶望感尺度
アメリカの精神科医で、うつ病の認知治療の創設者である、ベック博士が提案したうつ度チェック法(Beck et al.,1974参考文献2)。
7) 状態不安尺度
アメリカの心理学者である、スピルバーガー博士が不安の特性・状態モデルに基づいて作成した尺度(Spielberger et al., 1983参考文献3)。
8) 中帯状皮質前方部
大脳半球内側面の帯状回領域に含まれる。主に、認知・行動のモニタリングと調整に関わる。
9) 中前頭回
中前頭回は中心前溝の前方の上前頭溝と下前頭溝の間に位置し、背外側前頭前野に含まれる。背外側前頭前野は、注意制御、認知抑制、抑制制御、作業記憶、認知の柔軟性などの、実行機能に関わる。
10) 媒介解析
2つの変数(XとY)の関係が、介在する媒介変数(M)により間接的に説明されること(X→M→Y)を調べる分析。変数間の因果関係を明らかにし、疑似相関(見せかけの相関)の解釈を回避できるなどの利点がある。媒介解析の中でも、シミュレーションを用いた推定値のバイアスを補正したブートストラップ法(さまざまな目的に用いられる統計的推論の手法)は、精度が高いことが示されている。
参考文献
1: Torrubia, R., Ávila b, C., Moltó, J., & Caseras, X. (2001). The Sensitivity to Punishment and Sensitivity to Reward Questionnaire (SPSRQ) as a measure of Gray's anxiety and impulsivity dimensions. Personality and Individual Differences, 31(6), 837-862. doi:10.1016/S0191-8869(00)00183-5.
2: Beck, A. T., Weissman, A., Lester, D., & Trexler, L. (1974). The measurement of pessimism: the hopelessness scale. J Consult Clin Psychol, 42(6), 861-865. doi:10.1037/h0037562.
3: Spielberger, C. D., Gorsuch, R. L., Lushene, R. E., Vagg, P. R., & Jacob, G. A. (1983). Manual for the State-trait Anxiety Inventory. California: Consulting Psychologist Press.
論文について
タイトル:Brain 5-HT2A receptor binding and its neural network related to behavioral inhibition system
著者:Kazuho Kojima1,2, Shigeki Hirano1,2, Yasuyuki Kimura3, Chie Seki2, Yoko Ikoma4, Keisuke Takahata2, Takehito Ito2, Keita Yokokawa2, Hiroki Hashimoto5, Kazunori Kawamura5, Ming-Rong Zhang5, Hiroshi Ito6, Makoto Higuchi2, Satoshi Kuwabara1, Tetsuya Suhara7 & Makiko Yamada2,7
所属:
- Department of Neurology, Graduate School of Medicine, Chiba University, Chiba, 260-8670, Japan
- Department of Functional Brain Imaging, Institute for Quantum Medical Science, National Institutes for Quantum Science and Technology, Chiba, 263-8555, Japan
- Department of Clinical and Experimental Neuroimaging, Center for Development of Advanced Medicine for Dementia, National Center for Geriatrics and Gerontology, Obu, 474-8511, Japan
- Department of Molecular Imaging and Theranostics, Institute for Quantum Medical Science, National Institutes for Quantum Science and Technology, Chiba, 263-8555, Japan
- Department of Advanced Nuclear Medicine Sciences, Institute for Quantum Medical Science, National Institutes for Quantum Science and Technology, Chiba, 263-8555, Japan
- Department of Radiology and Nuclear Medicine, Fukushima Medical University, Fukushima, 960-1295, Japan
- Institute for Quantum Life Science, National Institutes for Quantum Science and Technology, 4-9-1 Anagawa, Inage-ku, Chiba, Chiba, 263-8555, Japan


