1.発表者
合田 圭介 (東京大学大学院理学系研究科化学専攻・教授/
カリフォルニア大学ロサンゼルス校工学部生体工学科・非常勤教授/
武漢大学工業科学研究院・非常勤教授/
国立研究開発法人量子科学技術研究開発機構・協力研究員)
Limei Liu (東京大学大学院理学系研究科化学専攻・客員研究員/
深圳大学物理与光电工程学院・博士研究員)
Pablo Martinez Pancorbo(日本学術振興会・特別研究員)
Tinghui Xiao(東京大学大学院理学系研究科化学専攻・助教/
国立研究開発法人量子科学技術研究開発機構・協力研究員)
平松 光太郎 (東京大学大学院理学系研究科附属スペクトル化学研究センター・助教/
国立研究開発法人科学技術振興機構・さきがけ研究員)
2.発表のポイント
- 本研究では、容易かつ安価に作製できる金ナノメッシュを用いた、複数の化学物質の多重高感度計測が可能な表面増強ラマン分光法(SERS)による高感度・多目的のウェアラブル化学センサーを開発した。
- 本センサーは、柔軟かつ伸縮性がある上に、さまざまなサイズに家庭用ハサミで簡単に加工して貼付できるため、さまざまな部位からの各種化学物質のラベルフリーその場微量分析が可能である。
- 本センサーにより、食品科学、薬学、病理学、スポーツ科学などの多岐に渡る学術分野に加え、健康管理、感染症検査、糖尿病検査、がん検査、環境安全、犯罪捜査にも広く応用できる。
3.発表概要
柔軟で伸縮性があり、肌に張り付けることが可能なウェアラブルセンサーは、着用者の健康状態や周囲の環境に関する豊富な情報を提供する技術である。現在のウェアラブルセンサーは、一般に日常的な状況下で着用者の動作や歩数、血圧、呼吸数、心拍数、体温など(主に物理的計測)のバイタルサインを計測するが、最近では着用者の生体流体(汗、唾液、涙、尿など)を非侵襲的にその場で化学センシングするよう改良されてきている。生体流体中の多数のバイオマーカーの化学分析は、着用者の複雑な生理的・病理的状態を正確かつ包括的に理解するために不可欠であるが、従来のウェアラブルセンサー(主に電子センサー)は、センシング原理の限界により、一度に分析対象物の1種類の化学物質にしか反応せず、分析対象物に合わせて調整する必要がある。このため、1回の測定で異なる化学物質を同時に識別することはできない。また、複数の化学物質を測定できるように設計することもできるが、その場合、サイズが大きくなり、製造コストが高くなり、合成ステップが増え、標的分析物に関する予備知識が必要になる。
東京大学大学院理学系研究科の合田圭介教授が率いる研究グループは、容易かつ安価に作製できる金ナノメッシュを用いた、複数の化学物質の多重高感度計測が可能な表面増強ラマン分光法(SERS)(注1)による高感度・多目的なウェアラブル化学センサー(図1A,B)を開発した。本センサーは、柔軟かつ伸縮性がある上に、さまざまなサイズに家庭用ハサミで簡単に加工して貼付できる。また、本センサーを用いることで、さまざまな部位からの各種化学物質のラベルフリーその場微量分析、すなわち「多目的ウェアラブル分析化学」が可能である。本センサーにより、食品科学、薬学、病理学などの多岐に渡る学術分野に加え、健康管理、感染症検査、糖尿病検査、がん検査、環境安全、犯罪捜査、スポーツ科学にも広く応用できる。
本研究は、文部科学省の光・量子飛躍フラッグシッププログラム(JPMXS0120330644)、JSPS研究拠点形成事業、JSPS科研費助成事業(JP18K13798、 JP20K14785)、JSPS特別研究員奨励費(P20789、19F19805)、神奈川県立産業技術総合研究所、村田科学技術振興財団、ホワイトロック財団、東京大学GAPファンドプログラム、東京大学協創プラットフォーム開発株式会社の支援を受けて実施された。
本研究成果は、2022年6月22日にAdvanced Optical Materialsのオンライン版で公開された。
4.発表内容
1)研究の背景と経緯
過去 20 年間、ウェアラブルセンサー技術は劇的な成長を遂げてきた。柔軟で伸縮性があり、肌に張り付けることができるウェアラブルセンサーは、着用者の健康状態や周囲の環境に関する豊富な情報を提供する。現在のウェアラブルセンサーは、一般に日常的な状況下で着用者の動作や歩数、血圧、血中酸素飽和度、呼吸数、心拍数などのバイタルサインを計測するが、最近では着用者の生体流体(汗、唾液、涙、尿など)を非侵襲的にその場で化学センシングするよう改良されてきている。生体流体中の多数のバイオマーカーの化学分析は、着用者の複雑な生理的・病理的状態を正確かつ包括的に理解するために不可欠である。
しかしながら、従来のウェアラブルセンサーは、センシング原理(主にセンサーの電子的性質に由来する)の限界により、一度に分析対象物の1種類の化学物質にしか反応せず、分析対象物に合わせて調整する必要がある。このため、1回の測定で異なる化学物質を同時に識別することはできない。また、複数の化学物質を測定できるように設計することもできるが、その場合、サイズが大きくなり、製造コストが高くなり、合成ステップが増え、標的分析物に関する予備知識が必要になる。
表面増強ラマン分光法(SERS)は、複雑な分析対象物の高感度・多重化学センシングを、分析対象物の予備知識を必要とせずに非侵襲的・ラベルフリーで実現できることから、近年、次世代ウェアラブルセンサーへの魅力的なアプローチとして浮上している。最近、複数のグループがウェアラブル SERS センサーを開発したが、それらのセンサーが優れた分子特異性と高い検出感度を示す一方で、その複雑な製造プロセスや限られた多機能センシング能力のために、そのスケーラビリティは依然として困難であった。そのため、大規模なセンサー(例えば、10cm×10cm以上のセンサー)を低コストで作製し、多様な用途に応用することは困難であった。
2)研究の内容
本研究では、作製が容易、低コストで、柔軟性、伸縮性、接着性、生体適合性のある極薄の金ナノメッシュに基づく、拡張性の高いウェアラブルSERSセンサーの開発に成功した(図1A,B)。このセンサーは、最近報告された、人間の皮膚や平らでない非剛体表面に長時間付着可能な、金をコーティングした生体適合性ポリビニルアルコール(PVA)ナノファイバー製の、炎症を起こさない、ガス透過性、軽量、伸縮性の電子センサーから着想を得た。本研究では、その未発見の光学特性を利用し、SERS機能を得るために構造の最適化を行った。同時に、製造の容易さ、コスト効率及びセンサーの薄さ、高い柔軟性、高い伸縮性、高い接着性、高い生体適合性などの優れた特徴を保持した。本センサーは、家庭用ハサミで任意の形状に加工し、事実上あらゆる表面に装着することができる。本センサーを用いることで、低濃度から高濃度(10 – 106 nM)までの多様な分析対象物のラベルフリー大規模その場センシング、すなわち「多目的ウェアラブル分析化学」を実現することが可能である。本センサーの実用性を示すために、汗、規制薬物、マイクロプラスチックの分析を行った。
ウェアラブルSERSセンサーの高感度な分子検出能力の原理検証として、センサー上のローダミン6G(R6G)溶液のSERSを行った。積分時間20秒、励起光強度2mW、励起波長785nmで、まずシリコン基板上の濃度0.1MのR6G溶液のラマンスペクトル(注2)をグランドトゥルースとして測定した。図2Aに示すように、R6Gの特徴的なラマンピークが確認された。次に、レーザー励起出力を0.2mWに、R6G濃度を100nMに減少させると、シリコン基板、150nmの厚さの金ナノメッシュ基板のいずれでも、予想通りラマンスペクトルの消失が確認された。一方、本センサーでは、同条件下でラマン信号の増強が見られ、ラマンスペクトルが確認された。SERS増強係数は、R6Gの場合、(2 mW / 0.2 mW) × (1 M / 100 nM) × (0.8 a.u. / 0.45 a.u.) = ~108であることが判明した。本センサーで測定された増強ラマンスペクトルがグランドトゥルースと一致していることは重要な点である。図2B,Cは、R6Gの検出可能な最低濃度が約10 nMであることを示している。さらに、本センサーの柔軟性を示すために、手袋に貼り付け、手の開閉を何度も繰り返す柔軟性テストを行った。図2D,Eに示すように、R6Gのラマンスペクトルは、1000回の開閉を行っても大きく変化しなかった。同様に、50%伸張したポリジメチルシロキサン(PDMS)基板に本センサーを貼り付け、何度も伸張を行うことで伸縮性テストも実施した。図2F,Gに示すように、R6Gのラマンスペクトルは、1000回の伸張後でも大きく変化しなかった。これらの結果から、本センサーの使い勝手の良さと実用性の高さが実証された。
ウェアラブルSERSセンサーのSERS応用における多様な有用性を示すために、金属、プラスチック、布、有機物などさまざまな素材の表面に配置し、接着剤を使用せずに高い固有粘着性を実証した。まず、汗のバイオマーカーを検出するために、人間の手首に本センサーを付着させた(図3A-C)。柔軟性、伸縮性、接着性、生体への密着性が高く、通常の屈曲・伸展状態でも皮膚にしっかりと接着していることが写真から確認できる。金ナノメッシュが炎症を起こさず、ガス透過性であることから、ヒトの皮膚に明らかな副作用は見られなかった。また、涙に含まれるバイオマーカーを検出するために、本センサーを人の頬やコンタクトレンズに付着させた(図3D,E)。同様に、図3Fは、COVID-19や他の呼吸器疾患や口腔疾患に関連する呼気や唾液のバイオマーカーを検出するために、フェイスマスクの表面に付着した本センサーを示す。図3G-Jは、エレベーターの制御盤、ドアハンドル、ドアノブ、パソコンのキーボードなど、金属やプラスチック表面に付着した本センサーで、スマートシティにおける環境モニタリングや感染監視ツールとしての可能性を示している。なお、本センサーは、水の量や噴霧範囲をうまく制御すれば、パソコンのキーボードのような非耐水性の物体の表面に組み込むことが可能である。さらに、組み込み後の表面を乾燥させるために、空気乾燥機を使用することができる。最後に、図3K,L は、食品安全において残存農薬を検出するために、リンゴと葉に付着させた本センサーを示している。
ウェアラブルSERSセンサーの応用展開として健康モニタリングの機能を実証するために、ヒトの汗を測定した。ヒトの汗のサンプルには、塩化ナトリウム、アスコルビン酸、尿素など、さまざまな物質が含まれている。図4Aは、参加者から得られたヒトの汗(2µL)のラマンスペクトルを本センサーに表示したものである。1,016cm-1, 1,603cm-1, 1,637cm-1のラマンピークは、アスコルビン酸と尿素の特徴的なラマンピークに対応し、水以外の人間の汗の主成分は、ラマン活性な分子振動を持たない塩化ナトリウムである。一方、予想通り、シリコンウェハー上では、同じヒトの汗の試料から観測可能なラマンピークは得られず、本センサーの有効性が実証された。
次に、ウェアラブルSERSセンサーの環境モニタリングへの能力を示すために、濃度の異なる水中のマイクロプラスチックを識別した。マイクロプラスチック汚染は、地球上の海洋に広範囲に広がっており、多くの生態系に影響を与えていることが知られている。海洋に浮遊しているマイクロプラスチックの中で最も多いのはポリエチレンであり、浮遊するマイクロプラスチック汚染全体の約54.5%を占めている。図4Bは、シリコン基板上の蒸留水中のポリエチレンマイクロビーズと本センサーのラマンスペクトルを示している。ここでは、ポリエチレンマイクロビーズはその高い疎水性により液面上に凝集しているが、一部は低濃度で液中に分散したままになっている。CC ストレッチのピークは1,063cm-1と1,129cm-1に、CH2 ツイストは1,296cm-1に、CH2ベンドのピークは1,416cm-1、1,440cm-1、1,463cm-1に相当する。1,296cm-1に現れた最も高いラマンピークをラマンマッピングに使用した。図4Cは、密度950g/L3のポリエチレンマイクロビーズを0.1%の濃度でシリコンウェハーに貼り付けた本センサーの光学画像とラマンマップを示している。ラマンマップから、本センサーがマイクロプラスチックの検出に対して有効であることがわかる。
最後に、このウェアラブル SERS センサーの犯罪捜査への応用可能性を示すために、メタンフェタミン(MA)、メチレンジオキシメタンフェタミン(MDMA)、コカイン、AM2233、モルヒネ、JWH-018、トリアゾラム、ゾピクロンなど、世界中で広く乱用されている規制薬物のラマンスペクトルを計測した。具体的には、メタンフェタミン(0.67mM)、コカイン(0.33mM)、MDMA(0.52mM)、AM-2233(0.22mM)、モルヒネ(0.35mM)、JWH-018(0.29mM)、トリアゾラム(0.29mM)、ゾピクロン(0.26mM)の濃度をメタノールに溶解して測定し、これらの薬物について本センサーを用いた実証実験を実施した。ベースライン減算後に得られた特徴的なピークを持つそれらのラマンスペクトルを図4Dに示す。シリコン基板上では、これらの濃度ではラマン信号が得られず、乱用薬物の検出におけるSERSの有効性が実証された。さらに、図4Eに示すように、応用例としては、薬物乱用者が頻繁に触れるものを想定し、プラスチックライター、シリコン製携帯ケース、PETペットボトル、金属缶(アルミ)、ABS樹脂製コンピューターキーボードなど、さまざまな生活用品の表面に装着した本センサーでは、水に溶けたMDMAが520nMと5.2μMという低濃度で検出され、本センサーの表面識別能力を確認することが出来た。ここで、MDMAの主なラマンピークは525cm-1, 632cm-1, 714cm-1, 811cm-1, 1,245cm-1, 1,366cm-1, 1,435cm-1, 1,492cm-1で、その他のラマンピークは主にセンサーを取り付けた各種日用品表面からのものであることがわかる。
3)今後の展開
金ナノメッシュを用いたウェアラブルSERSセンサーの柔軟性、伸縮性、接着性、生体適合性に加え、8桁程度のラマン信号増強度を示したこれらの特徴は、市販の金属SERS基板の感度に匹敵するか、それ以上であるため、低濃度での生体分子のラマン分光法への応用には十分であると考えられる。今後の展開として、波長チューニングが可能なレーザーを介して、金ナノメッシュの構造(ナノファイバーの太さ・密度、金の厚み・表面粗さなど)を変化させることで局在表面プラズモン共鳴(注3)に最適な波長と構造の関係を明らかにし、それぞれ市販のポータブルラマン分光器の励起光波長などに最適化した製品を開発したりすることが考えられる。このような改良を経て金ナノメッシュSERS基板の実用性及び信頼性を向上させることで、分析化学、食品科学、薬学、病理学、環境安全、犯罪捜査などの多岐に渡る分野における微量分析への拡張が期待される。例えば、血中グルコースの無標識検出による糖尿病検査、感染症(インフルエンザ、新型コロナウイルス感染症など)の抗原抗体反応測定、がん代謝プロファイリング解析、細菌(大腸菌、ピロリ菌など)の表面タンパク質を検出することによるリアルタイム細菌検出などが期待される。これらの展開は、新しい生活様式やバイオDXの方向性とも合致する。
ウェアラブルSERSセンサーの社会実装を行うために、本研究のメンバー数名により東大発ベンチャー企業LucasLand(http://www.lucasland.jp)が創業され、東京大学協創プラットフォーム開発株式会社1st Round(起業支援プログラム)に採択された。LucasLandによる本センサーの多分野への展開及び産業化が期待される。
4)本研究チーム構成員
Limei Liu(東京大学大学院理学系研究科化学専攻・客員研究員/深圳大学物理与光电工程学院・博士研究員)、Pablo Martinez Pancorbo(東京大学大学院理学系研究科化学専攻・JSPS特別研究員)、Tinghui Xiao(東京大学大学院理学系研究科化学専攻・助教/国立研究開発法人量子科学技術研究開発機構・協力研究員)、野口沙耶(東京大学大学院理学系研究科化学専攻・修士課程学生)、丸見真智子(東京大学大学院理学系研究科化学専攻・修士課程学生)、瀬川尋貴(科学警察研究所法科学第三部・研究員)、Siddhant Karhadkar(東京大学大学院理学系研究科化学専攻・修士課程学生)、Julia Gala de Pablo(東京大学大学院理学系研究科化学専攻・JSPS特別研究員)、平松光太郎(東京大学大学院理学系研究科附属スペクトル化学研究センター・助教/国立研究開発法人科学技術振興機構・さきがけ研究員)、北濱康孝(東京大学大学院理学系研究科化学専攻・特任研究員)、伊藤民武(国立研究開発法人産業技術総合研究所健康医工学研究部門・上級主任研究員)、Junle Qu(深圳大学物理与光电工程学院・教授)、竹井邦晴(大阪公立大学工学研究科電子物理系専攻・教授)、合田圭介(東京大学大学院理学系研究科化学専攻・教授/カリフォルニア大学ロサンゼルス校工学部バイオエンジニアリング学科・非常勤教授/武漢大学工業科学研究院・非常勤教授/国立研究開発法人量子科学技術研究開発機構・協力研究員)
5.発表雑誌
雑誌名:Advanced Optical Materials
論文タイトル:Highly scalable, wearable surface-enhanced Raman spectroscopy
著者:Limei Liu, Pablo Martinez Pancorbo, Ting-Hui Xiao, Saya Noguchi, Machiko Marumi, Hiroki Segawa, Siddhant Karhadkar, Julia Gala de Pablo, Kotaro Hiramatsu, Yasutaka Kitahama, Tamitake Itoh, Junle Qu, Kuniharu Takei, Keisuke Goda
DOI番号:10.1002/adom.202200054
アブストラクトURL:https://onlinelibrary.wiley.com/doi/full/10.1002/adom.202200054
6.用語解説
(注1)表面増強ラマン分光法(SERS)
貴金属などの粗い表面に分子が吸着した際に、バルク分子と比較してラマン散乱の強度が大きく増幅される現象を利用した分子分光法(ラマン分光法)。
(注2)ラマンスペクトル
物質に光を照射すると、物質と光の相互作用により、物質内の分子の固有の分子振動によって入射光と異なる波長で散乱される現象をラマン散乱と呼ぶ。その散乱光の分光スペクトルをラマンスペクトルと呼ぶ。
(注3)局在表面プラズモン共鳴
金属に入射した光によって集団振動を誘導される現象であり、光の周波数が表面電子の自然周波数と一致する際に共鳴が達成される。
7.添付資料
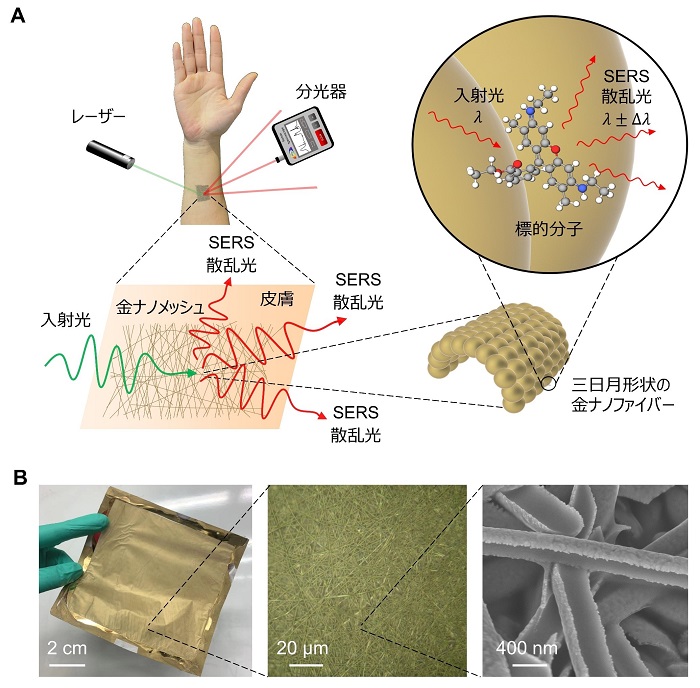
図1:多目的ウェアラブル分析化学を実現するウェアラブルSERSセンサー。A. センサーの概念図。B. センサーの写真、光学顕微鏡画像、電子顕微鏡画像。
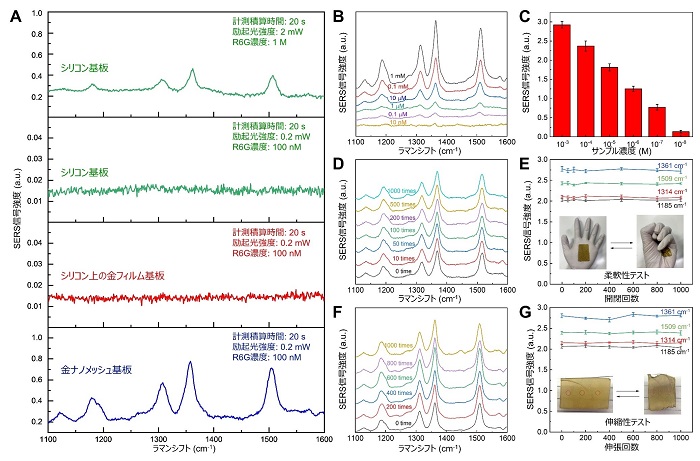
図2:金ナノメッシュの基本的なSERS性能。A. シリコン、金フィルム、金ナノメッシュ基板上でのR6Gのラマンスペクトル。B. 各濃度での金ナノメッシュ基板上でのR6GのSERSスペクトル。C. 各濃度での金ナノメッシュ基板上でのR6GのSERSスペクトルピーク強度。D,E. 柔軟性テストで複数回開閉した後のラマンスペクトルの変化。F,G. 伸縮テストで複数回伸張した後のラマンスペクトルの変化。各SERSピークの強度変化。
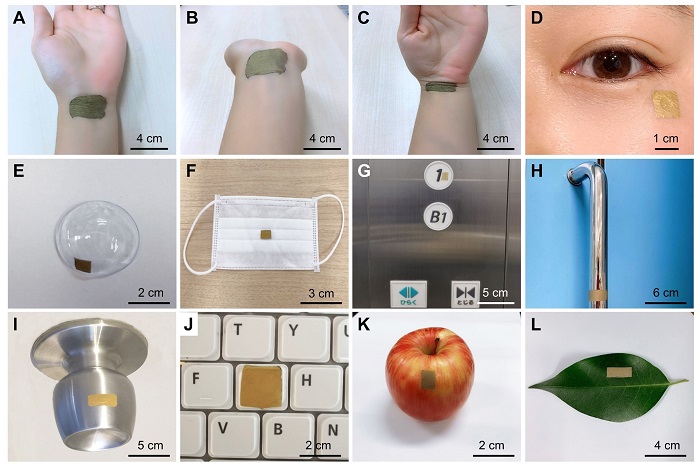
図3:さまざまな場所に貼付したウェアラブルSERSセンサー。A-C. 人の手首にセンサーを装着した後、手首の屈曲・伸展の実施。D-E. 頬やコンタクトレンズに貼り付けるセンサーで涙に含まれるバイオマーカーを検出。F-J. マスク、エレベーターの制御盤、手すり、ドアノブ、キーボードに貼り付けたセンサーによる環境モニタリングと感染症検出。K,L. 残存農薬検出のためのリンゴと葉に付着させたセンサー。
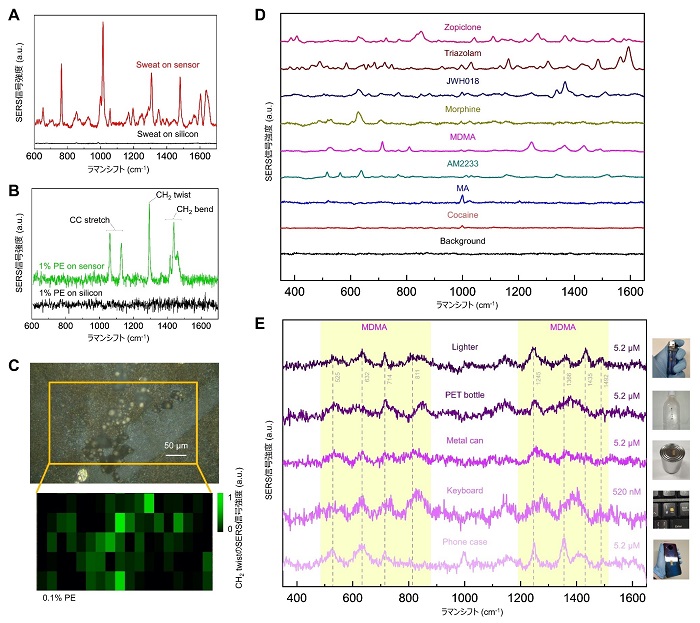
図4:ウェアラブルSERSセンサーの応用実証。A. センサー上で測定した汗のラマンスペクトル。B. センサー上で測定したマイクロプラスチックのラマンスペクトル。C. センサー上で測定したマイクロプラスチックのラマンマッピング。D. センサー上で測定したさまざまな規制薬物のラマンスペクトル。E. 各場所に貼付したセンサー上のMDMAのラマンスペクトル。


