DNA損傷化学研究グループ
リーダー 赤松 憲
突然変異生成機構研究グループ
リーダー 鹿園 直哉
研究の概要
DNA損傷化学研究グループでは、量子科学技術研究機構が保有する先進的量子ビーム施設の利用や新しいDNA損傷検出技術の開発を通じて、DNA損傷解析に関する研究を進めています。
突然変異生成機構研究グループでは、量子ビームによって局所的に付与されるエネルギーに焦点をあて、突然変異生成に至る過程を調べる研究を進めています。
- 研究のねらい
放射線リスク評価の高精度化や放射線癌治療の高度化に資するため、DNA損傷に関する研究を進める。また、量子ビームによる局所的なエネルギー付与によりどのような物理的変化が生じるかを調べるため、シミュレーションを中心に調べる。 - 研究内容
- クラスターDNA損傷の解析技術の開発
電離放射線によって生じるDNA損傷を解析するために、新しいDNA損傷検出方法や修復過程測定方法の開発を行っています。 - 突然変異生成機構の解析
放射線照射誘発クラスターDNA損傷の変異生成機構を調べるために、合成DNA損傷を用いた手法によって突然変異頻度や関与する生物学的過程を調べています。 - 局所的エネルギー付与による物理的変化の解析
量子ビームによって局所的に付与されるエネルギーにより、どのような物理的変化が生じるのかを主にシミュレーションによって調べています。
- クラスターDNA損傷の解析技術の開発
メンバー
| DNA損傷化学研究グループ | |
| 赤松 憲 | リーダー |
| 森林 健悟 | 上席研究員 |
| 中野 敏彰 | 主幹研究員 |
| 石井 千津 | 業務補助員 |
| 突然変異生成機構研究グループ | |
| 鹿園 直哉 | リーダー |
| 栢村 里美 | 業務補助員 |
主な研究成果
DNA損傷の可視化に関する研究
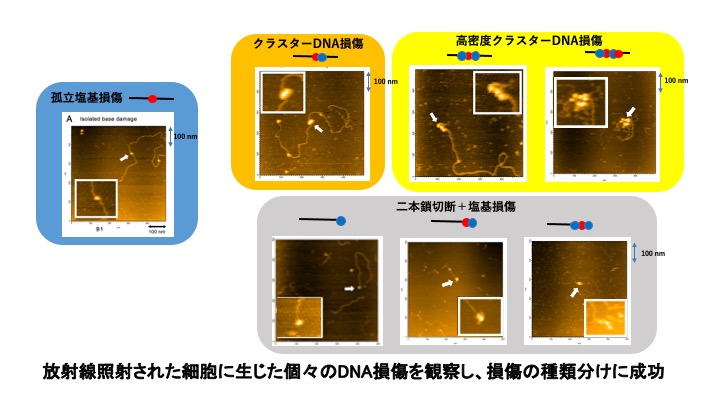
老化や発がんのメカニズムの解明や、効果的ながんの治療法の開発にとって、細胞内のDNA損傷とその修復は本質的なテーマである。細胞内のDNAは環境中のさまざまな要因により日々傷ついており、そのほとんどは細胞の働きによって修復されるが、ごく一部の傷は元通りにならないことが知られている。これが細胞死、老化やがんの原因と考えられている。また、重粒子線治療などの放射線がん治療においては、がん細胞を効果的に死滅させるべく、修復されにくいDNA損傷をがん細胞内に起こすことが望まれる。こうした研究を進めるためには、DNAに生じた損傷を一つずつ観察して、それぞれの構造的な特徴を明らかにし、その各々が細胞内でどのくらい修復されやすいのか、あるいは修復されにくいのかを調べる必要がある。しかし、従来用いられてきたマイクロメートルレベルの解像度しかない蛍光顕微鏡による可視化技術では、原理的に不可能だった。
そこで、ナノメートルレベルの解像度を持つ原子間力顕微鏡(AFM)で直接DNAの損傷個所を観察するべく、新たな手法の開発を試みた。生きた細胞中にあるDNA鎖上にごくわずかに生じた損傷部位を見つけ出すため、取り出した長いDNAをAFMで観察可能なサイズまで細分し、得られた膨大な量のDNA断片から損傷を含んだDNA断片のみを集める手法を開発した。これにより、損傷部分のみを探し当てAFMで直接観察することを可能とした。
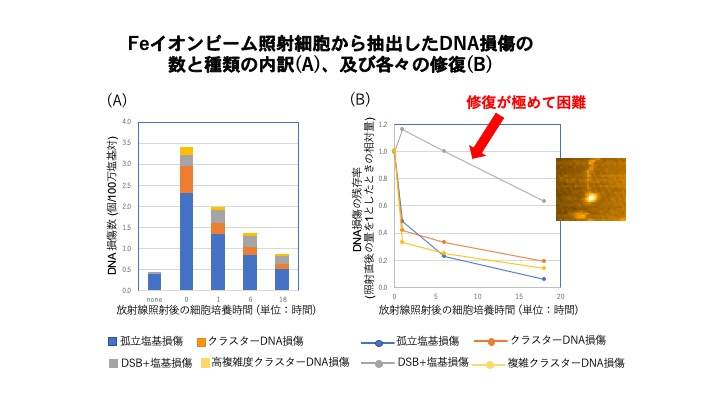
DNAに生じた個々の損傷をAFMで可視化できたことで、これまで不可能だったDNA損傷の種類分け、例えば、孤立塩基損傷(周辺に別の損傷のない塩基損傷)、クラスターDNA損傷(複数の集中した損傷)などを区別できるようになった。また、細胞中に生じた多様なDNA損傷がそれぞれどのくらいの速さで修復されていくのかを解析することも可能になった。実際に重粒子線によって生じたDNA損傷の修復性を調べた結果、DNAの二本鎖が切断された末端付近にさらに別の塩基損傷が存在するタイプでは極めて修復が困難であり、細胞にとって致命的な損傷となることが示唆された。
DNA損傷の局在性を調べる研究
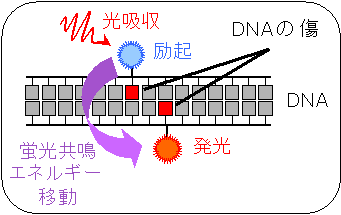
炭素イオンビーム等の重粒子線の高い生物効果は、重粒子線照射により細胞のDNAに生じる致命的な傷が原因とされ、この傷はDNAの二重らせんの1~2回転分ほどの狭い範囲に複数のDNAの傷が近接、密集して生じたものではないかと推察されていた。しかしながら、放射線照射により生じたDNAの傷の微視的な空間分布をこれまで観測されてこなかった。
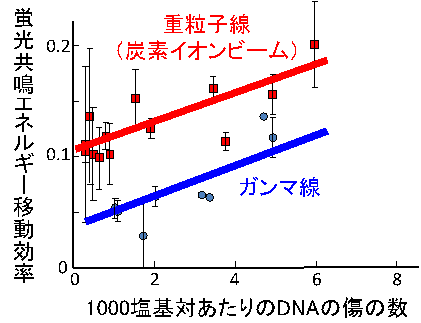
そこで、DNAの傷に蛍光分子を標識し、ナノメートルオーダーの距離に近接した蛍光分子の間で生じる蛍光共鳴エネルギー移動という現象を利用して、DNAの傷のミクロな分布を観察できる新しい手法を開発した。この手法を用いて炭素イオンビームをDNAに照射したところ、X線やガンマ線に比べて、DNAの傷がナノメートルオーダーで局在することが明らかとなった。得られた結果は、重粒子線の高いがん生物効果の原因が、DNAの複数の傷が互いに近接、密集して生じるためであることを示唆する。
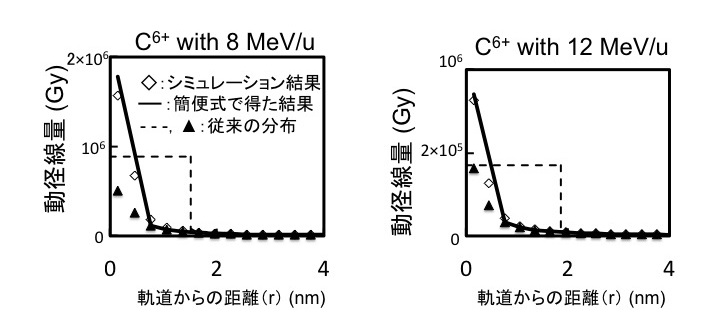
重粒子線の動径線量シミュレーションモデルの開発
上記の局在するDNA損傷がいつ、どのような過程で作られるかは分かっていない。そこで、局在するDNA損傷の生成機構解明に役立つ動径線量[重粒子線の軌道から距離(r)の関数として表される線量]のシミュレーションモデルの開発を行っている。その一環として(i)従来の動径線量分布モデルの欠点を克服したシミュレーションモデルを開発し、(ii)この開発したモデルによる結果を再現する簡便式の導出に成功した。この式は、重粒子線がん治療の治療計画の高度化、半導体の損傷の研究などにも利用できる可能性がある。
主な業績(論文、受賞、プレス発表等)
- A model for analysis of the yield and the level of clustering of radiation-induced DNA-strand breaks in hydrated plasmids, N. Shikazono, A. Yokoya, A. Urushibara, M. Noguchi and K. Fujii, Radiat. Prot. Dosimetry, 143, 181-185 (2011).
- Incorporation of the effect of the composite electric fields of molecular ions as a simulation tool for biological damage due to heavy-ion irradiation, K. Moribayashi, Phys. Rev. A, 84, 012702-1 – 012702-7 (2011).
- Photo-electron spectra produced from the irradiation of X-ray free electron laser light pulses onto non-spherically symmetric targets. K. Moribayashi, Phys. Scr., T144, 014049-1 – 014049-3 (2011).
- Radiation damage of C1H1, N1H1 and O1H1 clusters induced by irradiation with X-ray free electron lasers, T.Kai, Phys. Scr., T144, 014050-1 – 014050-3 (2011).
- Determination of Structural Parameters of Protein-Containing Reverse Micellar Solution Based on Near-Infrared Absorption Spectroscopy, H. Murakami, T. Nishi and Y. Toyota, J. Phys. Chem. B, 115, 5877-5885 (2011).
- A novel technique using DNA denaturation to detect multiply induced single-strand breaks in a hydrated plasmid DNA molecule by X-ray and 4He2+ ion irradiation. A. Yokoya, N. Shikazono, K. Fujii, M. Noguchi and A. Urushibara, Radiat. Prot. Dosimetry, 143, 219-225 (2011).
- Monte Carlo code for the damage of bio-molecules irradiated by X-Ray free electron lasers: Incorporation of electron impact ionization processes, K. Moribayashi, Progress in Nuclear Science and Technology (PNST), 2, 893 - 897 (2011).
- Observation of organelles in Leydig cells by contact soft X-ray microscopy with a laser plasma X-ray source, M. Kado, M. Ishino, S. Tamotsu, K. Yasuda, M. Kishimoto, M. Nishikino, Y. Kinjo and K. Shinohara, AIP conference proceedings, 1365, 391-394 (2011).
- Determination of structural parameters of protein-containing reverse micellar solution by near-infrared absorption spectroscopy, H. Murakami, T. Nishi and Y. Toyota, J. Phys. Chem. B, 115, 5877-5885 (2011).
- Series: Physics of atomic, molecular and optics due to short wavelength FEL – the role of atomic and molecular physics for the analysis for the structure of bio-molecules, K. Moribayashi, Syototsu, The Atomic Collision Society of Japan, 9, 8-13 (2012) (in Japanese) (Review).
- Observation of organelle by a laser plasma X-ray microscope, M. Kado, M. Kishimoto, M. Ishino, S. Tamotsu, K. Yasuda and K. Shinohara, AIP conference proceedings, 1465, 246-250 (2012).
- Development of single shot soft X-ray contact microscopy system for nano-scale dynamics measurement of living biological specimen, M. Kishimoto, M. Kado, M. Ishino, S. Tamotsu, K. Yasuda and K. Shinohara, AIP conference proceedings, 1465, 45-47 (2012).
- Incorporation of the effect of the composite electric fields of molecular ions as a simulation tool for biological damage due to heavy ion irradiation II, K. Moribayashi, AIP conference proceedings, 1465, 241-245 (2012).
- Terahertz absorption spectroscopy of protein-containing reverse micellar solution, H. Murakami, Y. Toyota, T. Nishi and S. Nashima, Chem. Phys. Lett., 519-520, 105-109 (2012).
- The mutagenic potential of 8-oxoG/single strand break-containing clusters depends on their relative positions. M. Noguchi, A. Urushibara, A. Yokoya, P. O’Neill and N. Shikazono, Mutat. Res., 732, 34-42 (2012).
- Yield of single- and double-strand breaks and nucleobase lesions in fully hydrated plasmid DNA films irradiated with high-LET charged particles. T. Ushigome, N. Shikazono, K. Fujii, R. Watanabe, M. Suzuki, C. Tsuruoka, H. Tauchi and A. Yokoya, Radiat. Res., 177, 614-627 (2012).
- Generation of strongly coupled Xe cluster nanoplasmas by low intensive soft X-ray laser irradiation, S. Namba, N. Hasegawa, M. Kishimoto, M. Nishikino and T. Kawachi, AIP conference proceedings, 1465, 69-73 (2012).
- Electron spectra of xenon clusters irradiated with a laser-driven plasma soft x-ray laser pulse, S. Namba, N. Hasegawa, M. Kishimoto, M. Nishikino, K. Takiyama and T. Kawachi, Physical Rev. A, 84, 53202 (2012).
- Movement of secondary electrons due to the irradiation of heavy ions: Role of the composite electric field formed from the polarization of molecules and molecular ions, K. Moribayashi, Rad. Phys. Chem., 85, 36 - 41 (2013).
- Demonstrations for the effect of composite electric fields of molecular ions on the motion of secondary electrons due to ion irradiation, K. Moribayashi, Nucl. Instr. Methods Phys. Res. B, 314, 30 - 33 (2013).
- In situ observation of cellular organelles with a contact x-ray microscope, M. Kado, M. Kishimoto, S. Tamotsu, K. Yasuda, and K. Shinohara, J. Physics: Conf. Ser. 463, 012056-1-4 (2013).
- Significance of DNA polymerase I in in vivo processing of clustered DNA damage, N. Shikazono, K. Akamatsu, M. Takahashi, M. Noguchi, A. Urishibara, P. O’Neill, A. Yokoya, Mutat. Res., 749,9-15 (2013)
- Development of ‘leaky’ liposome triggered by radiation applicable to a drug reservoir and a simple radiation dosimeter, K. Akamatsu, Appl. Radiat. Isotop., 74, 144-151 (2013).
- A mehodology for estimating localization of apurinic/apyrimidinic sites in DNA using fluorescence resonance energy transfer, K. Akamatsu and N. Shikazono, Anal. Biochem., 433, 171-180 (2013).
- Nanometer-scale water droplet free from the constraint of reverse micelles at low temperatures, H. Murakami, T. Sada, M. Yamada and M. Harada, Physical. Rev. E, 88, 052304 (2013).
- 平成26年度文部科学大臣表彰 生きた細胞の内部構造をその場観察できる軟X線顕微鏡の開発 加道雅孝、岸本牧、篠原邦夫
- Relaxation of plasma created from irradiation of a heavy Ion, K. Moribayashi, JPS Conference Proceedings, 1, 013089 (2014).
- Radial dose calculation due to the irradiation of a heavy ion: Role of composite electric field formed from the polarization of molecules and molecular ions, K. Moribayashi, Rad. Phys. Chem., 96, 211 - 216 (2014).
- Radial dose for heavy particle beam, K. Moribayashi, The Atomic Collision Society of Japan, 11, 73 - 91 (2014) (in Japanese) (Review).
- Towards Laser Driven Hadron Cancer Radiotherapy: A Review of Progress, K.W.D. Ledingham, P.R. Bolton, N. Shikazono and C.-M. Charlie Ma, Appl. Sci., 4, 402-433 (2014)(Review).
- Localization estimation of ionizing radiation-induced abasic sites in DNA in the solid state using fluorescence resonance energy transfer, K. Akamatsu, N. Shikazono, and T. Saito, Radiat. Res., 183, 105-113 (2015).
- Chemical repair activity of free radical scavenger, edaravone: Reduction reactions with dGMP hydroxyl radical adducts and suppression of base lesions and AP sites on irradiated plasmid DNA, K.Hata, A. Urushibara, S. Yamashita, M. Lin, Y. Muroya, N. Shikazono, A. Yokoya, H. Fu and Y. Katsumura, J. Radiat. Res., 56, 59-66 (2015).
- プレス発表:重粒子による高いがん治療効果をもたらす「DNAの傷の塊(かたまり)」を発見 赤松憲、鹿園直哉 2015年1月13日.大阪科学・大学記者クラブ
- Simulation study of radial dose due to the irradiation of a swift heavy ion aiming to advance the treatment planning system for heavy particle cancer therapy: the effect of emission angles of secondary electrons, K. Moribayashi, Nucl. Instru. Methods Phys. Res. B, 365 592 – 595 (2015).
- Development of the radial dose distribution function relevant to the treatment planning system for heavy particle cancer therapy, K. Moribayashi, Phys. Scr. 90 054013 (2015).
- Effect of recombination between a molecular ion and an electron on radial dose in the irradiation of a heavy ion, K. Moribayashi, Applied Physics Research, 8, 138 – 148 (2016).
- Efficiency of radiation-induced base lesion excision and the order of enzymatic treatment. Shiraishi I, Shikazono N, Suzuki M, Fujii K, Yokoya A. Int J Radiat Biol. 93:295-302 (2017).
- Radiation-induced clustered DNA lesions: repair and mutagenesis. Sage, E. and Shikazono, N. Free Rad. Med. Biol. 107:125-135 (2017)
- Effect of track potentials on the movement of secondary electrons due to irradiation of heavy ions, Moribayashi, K., J. Phys. Soc. Jpn., 86:024301-1 - 024301-5 (2017)
- Simple formulas for heavy-ion-irradiation-induced electric field, Moribayashi, K., Nucl. Instr. Methods Phys. Res. B. 408: 241-243 (2017)
- New method for estimating clustering of DNA lesions induced by physical/chemical mutagens using fluorescence anisotropy. Akamatsu K, Shikazono N, Saito T. Anal Biochem. 536:78-89 (2017).
- Proposal for Experiment Systems Using Laser-Driven Heavy Ions and XFELs to Understand Physical Phenomena Occurring near the Incident Ion Path. Moribayashi, K., Proc. 15th Int. Conf. X-ray, 202:121-123 (2018).
- Effect of the track potential on the motion and energy flow of secondary electrons created from heavy-ion irradiation, Moribayashi, K., Radiat. Phys. Chem. 146: 68-72 (2018).
- Mutagenic potential of 8-oxo-7,8-dihydroguanine (8-oxoG) is influenced by nearby clustered lesions. Shikazono, N.* and Akamatsu, K. Mutation Research - Fundamental and Molecular Mechanisms of Mutagenesis, 810: 6-12 (2018).
- Application of simple formulas to track potential in heavy-ion-beam simulation, Moribayashi, K., Trans. Material Res. Soc. Japan, 43: 267-270 (2018).
- Heat diffusion in heavy-ion beam irradiation, Moribayashi, K., Xray Spectrometry, 48:708-711 (2019).
- Tyrosyl-DNA phosphodiesterase 2 (TDP2) repairs topoisomerase 1 DNA-protein crosslinks and 3ʹ-blocking lesions in the absence of tyrosyl-DNA phosphodiesterase 1 (TDP1). Tsuda, M., Kitamatsu, K., Kumagai, C., Sugiyama, K., Nakano, T. Ide, H. DNA repair 91-92: 102849 (202).
- A Simplified Cluster Analysis of Electron Track Structure for Estimating Complex DNA Damage Yields. Matsuya, Y,. Nakano, T., Kai, T., Shikazono, N., Akamatsu, K., Yoshii, Y., Sato, T. Int J Mol Sci. 21: pii: E1701 (2020).
- TDP1-dependent repair of formaldehyde-induced DNA-protein cross-links in chicken DT40 cells. Nakano, T., Soulkamy, M.I., Tuda, M., Sasanuma, H., Takata, M., Masunaga, S., Takeda, S., Ide, H., Bessho, T., PLoS One, 15: e0234859
- Strand with mutagenic lesion is preferentially used as a template in the region of a bi-stranded clustered DNA damage site in Escherichia coli. Shikazono, N.* and Akamatsu, K., Sci. Rep., 10, 9737 (2020).
- Observation of water-window soft x-ray emission from laser-produced Au plasma under optically thin condition. John, C., Kishimoto, M., Matsumoto, Y., Morishita, T., Higashiguchi, T., Endo, T., Sunahara, A., Johzaki, T., Namba, S., High Energy Density Phys. 37: 100845 (2020)
- Characterization of gamma irradiation-induced mutations in Arabidopsis mutants deficient in non-homologous end joining. Du, Y., Yoshihiro Hase, Y., Satoh, K., Shikazono, N., J. Radiat. Res., 61(5):639-647 (2020).
- Application of atomic and molecular data for plasma production and cancer therapy by heavy particle irradiation。Moribayashi, K. Japan. J. Appl. Phys. 59, SH0801 (2020).
- Fluorescence anisotropy study of radiation-induced DNA damage clustering based on FRET. Akamatsu, K., Shikazono, N., Saito, T. Anal. Bioanal. Chem., 413:1185-1192 (2021).
- Debye shield formed by track potential and transport of secondary electrons in heavy ion irradiation. Moribayashi, K., Radiat. Phys. Chem. 184: 109436 (2021).
- Proton-Cluster-Beam Lethality and Mutagenicity in Bacillus subtilis Spores. Hase, Y., Sato, K., Chiba, A., Hirano, Y., Moribayashi, K., Narumi, K., Quantum Beam Sci. 5: 25 (2021).
- Formation of clustered DNA damage in vivo upon irradiation with ionizing radiation: visualization and analysis with atomic force microscopy. Nakano, T., Akamatsu, K., Tsuda, M., Tujimoto, A., Hirayama, R., Hiromoto, T., Tamada, T., Ide, H., Shikazono, N. Proceedings of the National Academy of Sciences, USA. 119(13):e2119132119 (2022).
- 世界初!放射線によって生じたDNA損傷の直接観察に成功 〜老化・がん研究にブレイクスルー〜 中野敏彰、赤松憲、鹿園直哉 2022年3月15日.
