発表のポイント
- 多機能のナノ薬剤送達治療システムを開発し、腫瘍部分に薬剤が集まり放出される様子を、MRIによって高精度に可視化できた。
- さらに、重粒子線とナノ薬剤送達治療の併用治療を世界で初めて実施し、大腸がん移植モデルマウスで高い治療効果を確認した。
- 患者さんの負担をより軽減させる、効果的ながん治療の実現を目指す重要な一歩になる。
国立研究開発法人量子科学技術研究開発機構(理事長 平野俊夫。以下「量研」という。)放射線医学総合研究所(放医研)の青木伊知男チームリーダー、國領大介研究員(現・神戸大学)らと、大阪府立大学の河野健司教授、弓場英司助教らは共同で、41℃以上になると封入した抗がん剤と造影剤を放出するリポソームの粒子を腫瘍に集め、患部を加温することにより腫瘍部分に薬剤を作用させるナノ薬剤送達治療システムを開発し、薬剤の放出をMRIで高精度に観察すると共に、重粒子線治療1)との併用により治療効果が向上することをモデルマウスで確認しました。
抗がん剤治療の副作用を軽減し、治療効果を向上させる目的で、高分子の生体適合性材料であるポリマーやリポソームなどで作ったナノサイズの粒子に薬剤を封入し、患部に集中させる「ナノ薬剤送達治療2)」が盛んに研究されています。しかし、がんの種類や状態によって治療効果に大きな差があることがわかりました。その原因の一つとして、ナノ粒子ががん全体に行き渡っていない可能性が示唆されたことから、薬剤の他にMRI造影剤などをナノ粒子に封入して「見る」機能を追加し、がんを診ながら治療を行う「セラノスティクス(theranostics)3)」と呼ばれる次世代の高精度医療の重要性が増しています。
そこで、(1)がんに集まり、(2)がんを診ることができ、(3)がんを治療することができる、多機能のがん造影・治療リポソームを用いたナノ薬剤送達治療システムを開発しました。システムの要となるリポソームの内部には抗がん剤と造影剤を封入し、表面にはがんに集積する能力を高めるポリエチレングリコールと、41℃以上になると性質が変化する温度応答性ポリマーの2種類のポリマーを付加しました。このリポソームを血中に投与すると腫瘍に集まる様子がMRIで観察されました。その後、患部を加温することで薬剤が腫瘍部分で放出される様子がMRIによってリアルタイムに観察され、ナノ薬剤送達治療システムが投与後に生体内で動作する様子を可視化することに成功しました。
一方、重粒子線がん治療は、治療期間の短縮や副作用の軽減などで患者さんの負担が少なく、良好な治療成績が得られる治療法として研究が行われています。しかし、重粒子線がん治療は転移したがんは適用外となることや、転移リスクを下げるための抗がん剤併用治療も多いことから、副作用が少ない抗がん剤治療が実現できれば、より一層患者さんの負担を軽減して効果的な治療を行うことができると期待できます。
今回開発したナノ薬剤送達治療システムを、重粒子線治療を行った大腸がん移植モデルマウスに適用した結果、重粒子線単独の治療よりも、重粒子線治療とナノ薬剤送達治療システムを併用した場合の方が高い治療効果が得られることが確認できました。これは、転移したがんも含めて、より患者さんの負担が少ないがん治療の実現を目指す重要な一歩です。
本研究は、放射線医学総合研究所・重粒子線がん治療装置共同研究利用、文部科学省・科学研究費補助金・学術研究助成基金助成金(#23700589 and #24300167)、文科省・革新的イノベーション創出プログラム(COI Stream)による補助を受け実施されました。
この成果は、前臨床研究から臨床研究までの多岐にわたる医学分野の優れた研究成果を100年以上にわたり数多く発表している「Translational Research」誌に2017年5月上旬にオンライン掲載される予定です。
研究開発の背景と目的
国民の3.5人に1人ががんで死亡し、生涯において男性の54%、女性の40%が、がんに罹患するとされる中、早期に社会復帰することができるよう、最小限の負担で、短期間で実施できるがん治療が注目されています。治療期間の短縮や副作用の軽減などで患者さんの負担が少なく、良好な治療成績が得られる治療法として重粒子線がん治療が期待されていますが、転移したがんは適用外となることや、転移リスクを下げるための抗がん剤併用治療となる場合も多くあります。
重粒子線治療と組み合わせて用いることができ、副作用が少ない抗がん剤治療を実現する手法として、生体適合性材料からなるナノサイズの粒子に薬剤を搭載して「必要な薬剤を必要な時間に必要な部位で作用させるためのシステム(薬剤送達システム)」を使った「ナノ薬剤伝達治療」に着目しました。これまで、「ナノ薬剤伝達治療」により副作用を軽減させる効果があることは多くの報告で共通していますが、がんの種類やがん内部の状態によって治療効果の差が大きいことが示されています。この差が生じる原因の一つとして、ナノ粒子ががんの全ての領域に行き渡らず、血管から離れたがん組織に十分に届いていない可能性があることが示唆されています。特に、がん組織の内部に間質細胞が多い膵がんやスキルス胃がんなどでは、がん組織にナノ粒子が十分に送達されないという報告があります。
そのため、抗がん剤の他にMRI造影剤などをナノ粒子に封入し、粒子ががんに十分届いているかを生体イメージングで診ながら治療を行う「セラノスティクス(theranostics)」と呼ばれる次世代の高精度医療の重要性が増しています。
そこで、(1)がんに集まり、(2)がんを診ることができ、(3)がんを治療することができる、多機能かつ高機能のナノ粒子を開発し、その粒子を用いた「ナノ薬剤送達治療システム」と重粒子線の併用治療の効果を確認することを目的としました。
研究の手法と成果
(1)多機能かつ高機能のナノ粒子の開発
大阪府立大学の河野らは、脂質二重膜からなるリポソームの内部に、がん治療効果を持つ抗がん剤(ドキソルビシン)と蛍光色素(ローダミン)を封入し、粒子の表面には、がんに集積する能力(EPR効果4))を高めるポリエチレングリコール(PEG)と、加温により性質が変化する温度応答性ポリマー(大阪大学・青島らの成果)の2種類のポリマーを付加したがん造影・治療リポソームを開発してきました。本研究では、大阪府立大学と量研・放医研の研究チームが共同で、体の深部のがんでの薬剤放出を見えるようにするため、このリポソームにMRI造影剤(マンガン造影剤)を封入し、さらに多機能化しました。温度応答性ポリマーは、温度が41℃以上になると親水性から疎水性に性質が変化し、リポソームを構成する脂質膜を不安定化させることで、中に封入した抗がん剤とMRI造影剤を外部に放出します(図1)。
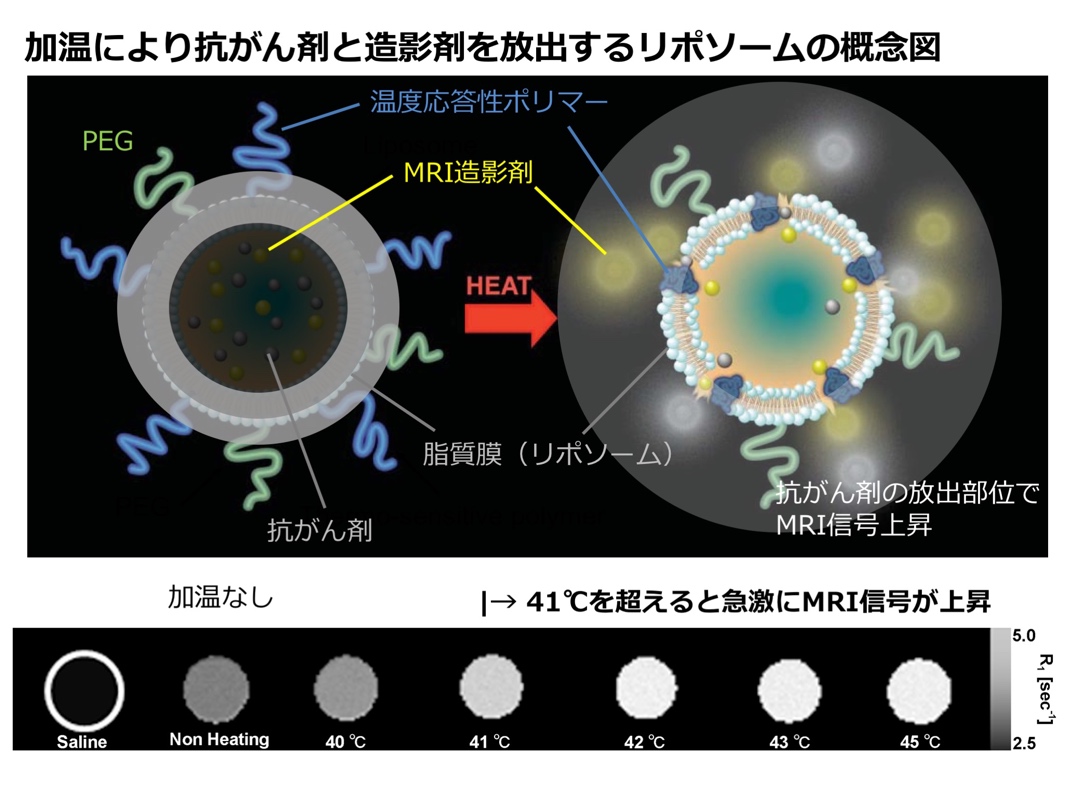
図1 加温により抗がん剤と造影剤を放出するがん造影・治療リポソームの概念図
41℃以上に加温すると、温度応答性ポリマーが変形し、リポソーム内部からMRI造影剤と抗がん剤が放出されます。放出されたMRI造影剤は、最も信号が高くなる濃度に希釈され、高信号を呈します。
このがん造影・治療リポソームを大腸がん移植モデルマウスに投与したところ、封入した蛍光色素の信号をとらえて腫瘍をイメージングできること(図2左)、腫瘍部分の皮膚表面を温水還流装置で41℃以上に加温するとMRIの信号が上昇することから粒子内の薬剤が放出されること(図2右)を確認しました。
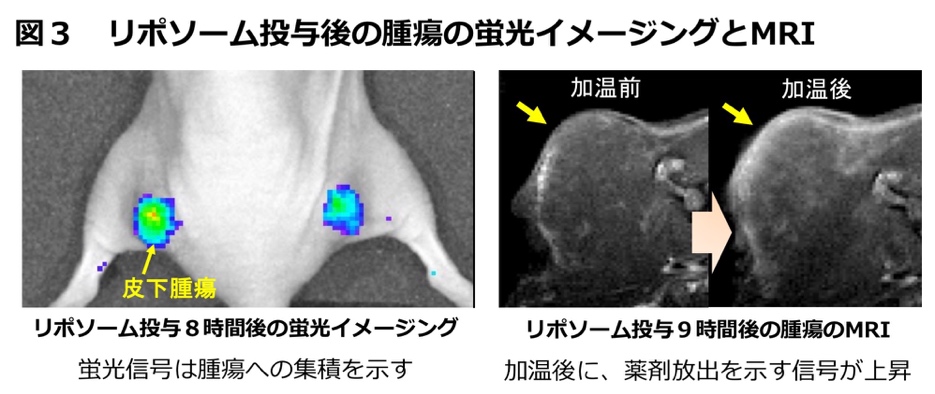
図2 がん造影・治療リポソームを投与した後の腫瘍の蛍光イメージングとMRI
蛍光でも腫瘍への集積が観察できます(左)。MRIではわずか5 mmの腫瘍内部の状態が観察できます(右)。加温によって、放出されたMRI造影剤は、腫瘍組織と結合することで、さらに信号が高くなる「増感効果」が生じます。この高信号は、リポソームから抗がん剤と造影剤が高濃度で放出された領域を示します。
(2)がん造影・治療リポソームによるナノ薬剤送達治療システムと重粒子線治療との併用効果の確認
量研・放医研では、大腸がん移植モデルマウスを用いて、がん造影・治療リポソームによるナノ薬剤送達治療システムと重粒子線治療を併用した場合と、重粒子線治療単独の場合とで治療効果を比較検討しました。それぞれの治療法は、単独でも投与量や照射量を増やすことで移植したがんを完治させることは可能ですが、併用による効果の有無を確認するため、重粒子線は5Gyを1回照射、ナノ粒子は200µl投与と、それぞれ量を下げました。併用治療では、重粒子線1回照射後、ナノ粒子を投与して患部の皮膚表面を加温しました。
その結果、腫瘍部分では、正常組織と比較して抗がん剤の集積と放出を示すMRIの高信号が観察されました(図3上)。また、8日間腫瘍の体積を計測し、単独治療と比較して、併用療法が腫瘍を縮小する効果が高いことが確認できました(図3グラフ)。
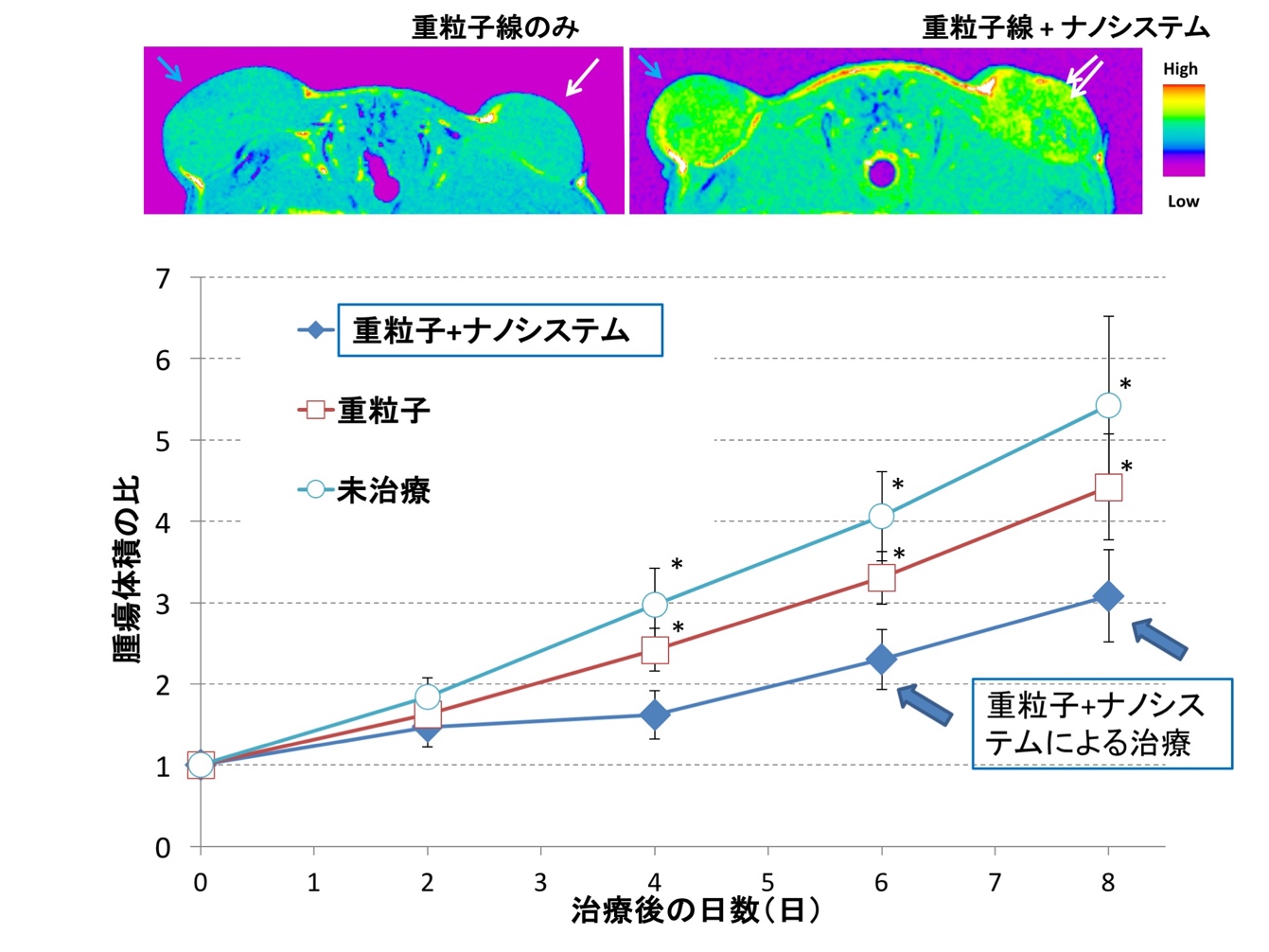
図3 重粒子線治療単独の場合と、がん造影・治療リポソームによるナノ薬剤送達システム併用治療との効果の比較
腫瘍部分により多くのリポソームが集まっていることがMRIにより観察できました(上図)。重粒子線治療とナノ薬剤送達治療システムを併用した場合では、重粒子線治療単独に比べて、腫瘍体積がより縮小しました(下グラフ)。
今後の展開
重粒子線治療とがん造影・治療リポソームによるナノ薬剤送達システムの併用により治療効果が高まることが確認できました。
本研究は、ナノ粒子による薬剤放出をMRIなどにより可視化しながら高精度に治療する「セラノスティクス」であり、大きな腫瘍を治療する重粒子線治療などと組みあわせることで転移がんを含めて、より確実で患者さんの負担が少ない治療の実現に向けた重要な一歩です。
今後、さらに効果的なナノ粒子の開発・改良に加えて、重粒子線照射と併用する際の最適なナノ粒子の投与条件の設定や、がん種やがん病巣の異なるモデルへの適用などを確認し、臨床研究へと進めたいと考えています。
用語解説
- 重粒子線治療
ヘリウム以上の原子番号を持つ原子をイオン化し、それを加速器で高速に加速し作られた放射線を、病巣に照射することにより治療する方法です。量研・放医研では主に炭素イオンを加速した炭素線が用いられています。従来のエックス線やガンマ線を用いた放射線治療は組織を透過して正常な組織にも強い影響を及ぼしますが、重粒子線は病巣の付近で停止し、局所で高いエネルギーを放出するため、病巣細胞に対する殺細胞効果が高いことが利点として挙げられます。 - ナノ薬剤送達治療
高分子化学やナノ技術等を用いて、治療薬や診断薬を含む10~100 nmサイズの微粒子を作製し、必要な時間に十分な量の粒子を患部に送り、放出させる(薬剤送達システム:Drug Delivery System (DDS))といった方法により治療する方法です。
従来の低分子化合物を中心とした化学治療では、全身に薬剤が分布するため、腫瘍細胞だけでなく正常細胞へも影響を及ぼし、吐き気、貧血、出血などが生じる場合があり、治療の継続が困難になる副作用とそれに伴う苦痛が問題となっています。薬剤送達システムは、抗がん剤治療においては、副作用の影響を軽減し、より高い治療効果を得られる方法として期待されています。
薬剤送達システムに用いられる高分子素材として、今回使用したリポソームの他、ポリエチレングリコール(PEG)を初めとした親水性ポリマーとポリアミノ酸を始めとした疎水性ポリマーを分子レベルで結合し作成した共重合体ポリマーから構成された高分子ミセル、中心から放射状に枝分かれした構造を有するデンドリマーなどがあり、それぞれ特徴を持っています。また、ナノ粒子を構成する素材に、温度や光などさまざまな外部刺激に反応しその形態が変化する素材を用いることにより、薬剤を患部においてより効果的に放出させる機能性ナノ粒子の開発も盛んに実施されています。 - セラノスティクス(theranostics)
診断技術(diagnostics)と治療技術(therapeutics)を組み合わせた造語で、個々の患者における診断情報を治療に直結させようとする試みで、診断と治療の融合的な概念です。例えば、ある患者に対して、治療を行った結果が迅速に診断(観察)できれば、その結果を元に、すぐさま次の治療を選択できます。我々はこれまでに、抗がん剤ナノミセルとMRI造影剤を組み合わせて、抗がん剤の分布をイメージングで追跡しながら治療を行うセラノスティクス(Cancer Res. 2010 Sep 15;70(18):7031-41)、リポソームに造影剤を内包し、その体内動態や薬剤放出を可視化する手法(Nanomedicine. 2015 Jan;11(1):229-38., Transl Res. 2015 Dec;166(6):660-673.e1)、放射線治療後に短期間で細胞活動の変化を検出し、その後の治療に反映させる手法(Saito Sら、Cancer Res. 2013 Jun 1;73(11):3216-24)など、診断と治療の融合に繋がる研究開発を、所内外の共同研究を通じ積極的に進めています。 - EPR(Enhanced permeation and retention effect)効果
腫瘍の周囲に存在する新生血管には、血管を構成する内皮細胞の間に隙間があります。この隙間を数10〜100nmの高分子の薬剤が透過して、腫瘍組織に集まり、さらにリンパ系の不全により腫瘍組織周辺に滞留する特性をEPR効果と呼びます。粒子の直径、がんの種類や内部構造等によって、EPR効果によるがんへの集積に差があることが報告されています。
掲載論文
Evaluation of a combination tumor treatment using thermo-triggered liposomal drug delivery and carbon-ion irradiation
Daisuke Kokuryo, PhD1, 4, Ichio Aoki, PhD1, *, Eiji Yuba, PhD2, Kenji Kono, PhD2, Sadahito Aoshima, PhD3, Jeff Kershaw, PhD1, Tsuneo Saga, MD, PhD1
- Molecular Imaging Center, National Institute of Radiological Sciences, Chiba, Japan
- Graduate School of Engineering, Osaka Prefecture University, Sakai, Osaka, Japan
- Graduate School of Science, Osaka University, Osaka, Japan
- Graduate School of System Informatics, Kobe University, Kobe, Hyogo, Japan
本研究成果を、「温度応答性リポソーム」の開発に大いなる情熱を傾け、2016年12月に急逝されました
河野健司教授ならびにご家族に捧げます。
