発表のポイント
- ヒト胃がん培養細胞を用いて、アスタチン-211(211At)1)を付加した薬剤(標的アイソトープ治療2)薬)から放出されるα線3)の画像化に成功
- 画像から、標的アイソトープ治療薬が、がん細胞一個あたりに与える線量を精密に評価する手法を開発
- 科学的な指標に基づく、標的アイソトープ治療薬の品質評価や、治療に適した投与量の決定などに役立つことが期待される
国立研究開発法人量子科学技術研究開発機構(理事長 平野俊夫。以下「量研」という。)放射線医学総合研究所計測・線量評価部放射線計測技術開発チームの小平聡主任研究員、放射線障害治療研究部放射線がん生物学研究チームの長谷川純崇チームリーダー・李惠子学振特別研究員、放射線障害治療研究部組織再生治療研究チームの小西輝昭主任研究員らは共同で、アスタチン-211(211At)を付加した薬剤が、がん細胞に結合し放出されるα線を、単一細胞毎にイメージングし、細胞に吸収される線量を評価する新しい手法を開発しました。
α線は放射線の飛ぶ距離が細胞数個分で、当たった細胞を殺傷する能力が高い、という特長があります。この特長から、治療法が限られる転移がん等に対する効果的な治療法として、α線放出核種を付加した薬剤を用いた標的アイソトープ治療が期待されており、量研では、α線放出核種の211Atを付加した標的アイソトープ治療薬の開発を進めています。しかしながら、211Atを付加した薬剤を投与した後、実際にどれくらいの薬剤ががん細胞に届き、細胞にどれくらいの線量のα線が吸収されるのか、明らかになっていませんでした。
本研究では、CR-39固体飛跡検出器4)(CR-39プレート)を用いて、がん細胞から放出されるα線の飛跡を、顕微鏡下で可視化することで、細胞一個当たりに吸収されるα線のエネルギーを評価する手法を開発しました。HER2というタンパク質が細胞の表面に存在しているがん細胞にだけ結合する抗体であるトラスツズマブ(商品名ハーセプチン)に、211Atを付加した標的アイソトープ治療薬211At-トラスツズマブ5)とヒト胃がん細胞(NCI-N87)を混合した溶液を、CR-39プレート上へ分散させ、顕微鏡下で可視化した細胞像と細胞から放出されるα線の飛跡像を重ね合わせました。これにより、がん細胞一個から放出されるα線の数と、がん細胞の局所的に与えられるα線のエネルギー量を計測し、α線の数とそのエネルギー量の平均値の積を求めることで、細胞一個当たりに吸収される平均的な線量を評価できました。また、211At-トラスツズマブが、どれくらいの効率でがん細胞に結合しているかを調べたところ、約80%の細胞からα線が放出されていることがわかりました。
今回は細胞でしたが、211Atを付加した薬剤を投与した動物の組織切片から放出されるα線の分布をイメージングすることによって、がん組織への薬剤集中性や正常組織への影響の定量評価に応用できると考えられます。また、細胞あたりのα線の放出の有無から、211Atを付加した薬剤のがん細胞への結合効率を求めることによって、放射性薬剤の品質評価にも応用できる可能性が示唆されました。今後、細胞死に必要な細胞一個あたりの線量評価を進めることによって、結合効率を指標に、治療に必要な標的アイソトープ治療薬の投与量を、科学的に決定付けることに役立つと期待されます。
この成果は、医科学分野でインパクトの大きい論文が数多く発表されているオープンアクセス誌「PLOS ONE」に、2017年6月29日(木曜日)(日本時間 3時00分)に掲載予定です。
研究開発の背景と目的
α線は放射線の飛ぶ距離が細胞数個分で、当たった細胞を殺傷する能力が高い、という特長があります。この特長から、治療法が限られる転移がん等に対する効果的な治療法として、α線放出核種を付加した薬剤を用いた標的アイソトープ治療が期待されています。量研では、α線放出核種である211At(アスタチン)を加速器で効率よく製造することに成功し、211Atを付加した標的アイソトープ治療薬を開発しています。これまでに、褐色細胞腫および腹膜播種した胃がんを対象にした標的アイソトープ治療薬を開発し、動物実験でその効果を確認してきました。しかしながら、これらの211Atを付加した薬剤を投与した後、実際にどれくらいの薬剤ががん細胞に届き、細胞にどれくらいのα線のエネルギーが吸収されるのか、わかっていませんでした。そこで、211Atを付加した薬剤が結合したがん細胞から放出されるα線を、CR-39固体飛跡検出器(CR-39プレート)を用いてα線の飛跡として単一細胞毎に可視化し、α線飛跡数と局所的に与えられるエネルギー量から線量評価する手法を検討しました。
研究の手法と成果
胃がん腹膜播種を対象とした標的アイソトープ治療薬の211At-トラスツズマブ(3.6 kBq, 42.2 ng/ml)と、ヒト胃がん細胞(NCI-N87)を混合した試料をメタノール溶媒と共に、5cm角のCR-39プレート上の中央に分散させました。がん細胞は、CR-39プレート上の任意の位置に固定化され、がん細胞に結合した211Atからα線が次々と放出されます。まず、CR-39プレート上に分散した細胞像を光学顕微鏡により撮像し、その位置座標と大きさを数値化しておきます。がん細胞をCR-39プレートに固定した状態で、14時間(211Atの半減期は7時間なので2半減期分に相当)おいた後、CR-39プレート上から細胞試料を除去・洗浄し、化学処理を行うことによって、CR-39に入ったα線の飛跡を現出させます。このα線の飛跡を細胞の時と同様に顕微鏡で撮像し、α線飛跡の座標位置と大きさを数値化します(図1)。
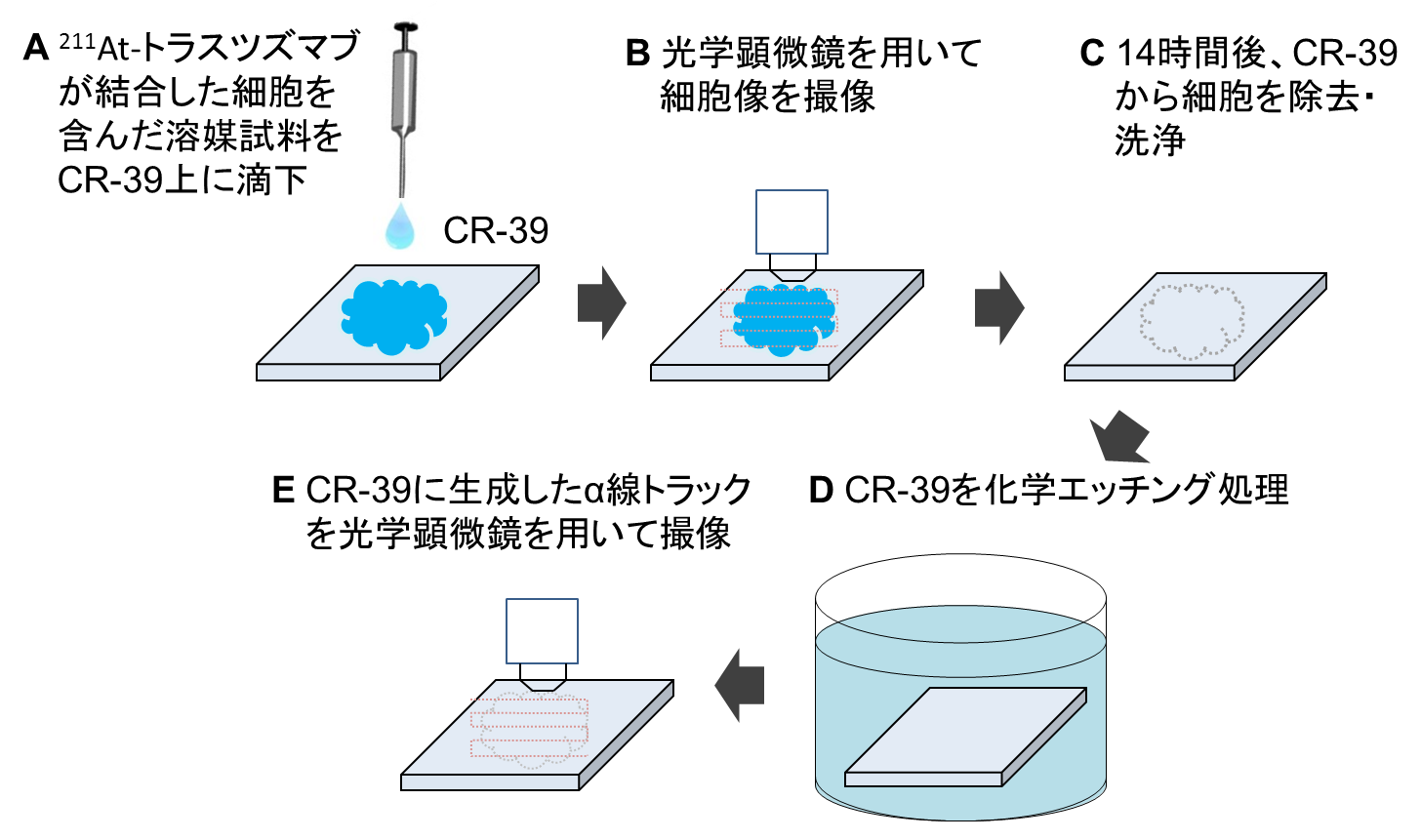
図1. 実験の手順
1.細胞とα線の飛跡の対応付け
座標位置の情報から、細胞像とα線の飛跡像を重ね合わせることによって、細胞とそこから放出されたα線飛跡の対応付けを行いました。対応付けの例(図2)では、細胞像(A)中の矢印で示した3つの細胞の位置でのα線飛跡像を見ると、左側の細胞からは2本、中央の細胞からは7本のα線の飛跡が計測されましたが、右側の細胞からは飛跡は計測されていないことがわかります。このように、それぞれの細胞から何本のα線が放出されたかを評価することができます。
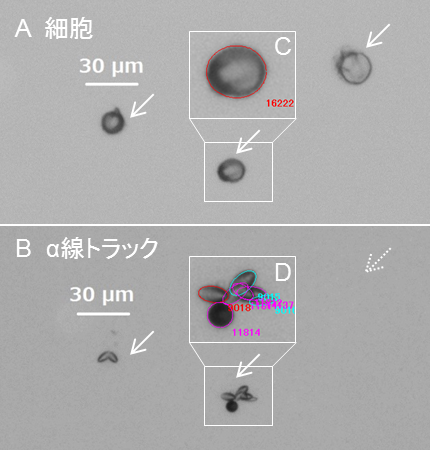
図2. 細胞とそこから放出されるα線飛跡の対応付けの例。CとDの四角で囲っている部分は、真ん中の細胞とそこから放出されるα線飛跡の拡大図で、位置座標や大きさを抽出するための楕円フィッティング結果が併せて示されています。
2.細胞一個当たりの線量評価
細胞に吸収される放射線のエネルギーは単位面積当たりのエネルギー付与の総和で定義されるので、細胞一個あたりの吸収線量はα線の数と付与されるエネルギー量の積で求めることができます。細胞一個あたりに放出されたα線の本数の分布を調べたところ、最大で32本のα線が一個の細胞から放出されたことが分かりました(図3)。またα線の飛跡のサイズから、局所のエネルギー量を求めたところ、平均で131 keV/µmとなりました。
131 keV/µmを吸収線量の単位(Gy)に変換した値と、平均の大きさを直径10µmとしたときの細胞面積などを、吸収線量を算出する式に当てはめたところ、細胞一個当たりの平均的な吸収線量はα線の数に0.3を乗じて求められることがわかりました。つまり、細胞から放出されるα線が10本であれば、吸収線量は3 Gyと評価されます。今回の見積りは平均値ですが、個々の細胞の大きさや、そこから放出されるα線の数、およびα線が局所に付与するエネルギー量を個々に測定することができるので、線量評価後も細胞の経過観察をすることで、細胞死に必要な吸収線量を評価することも可能です。
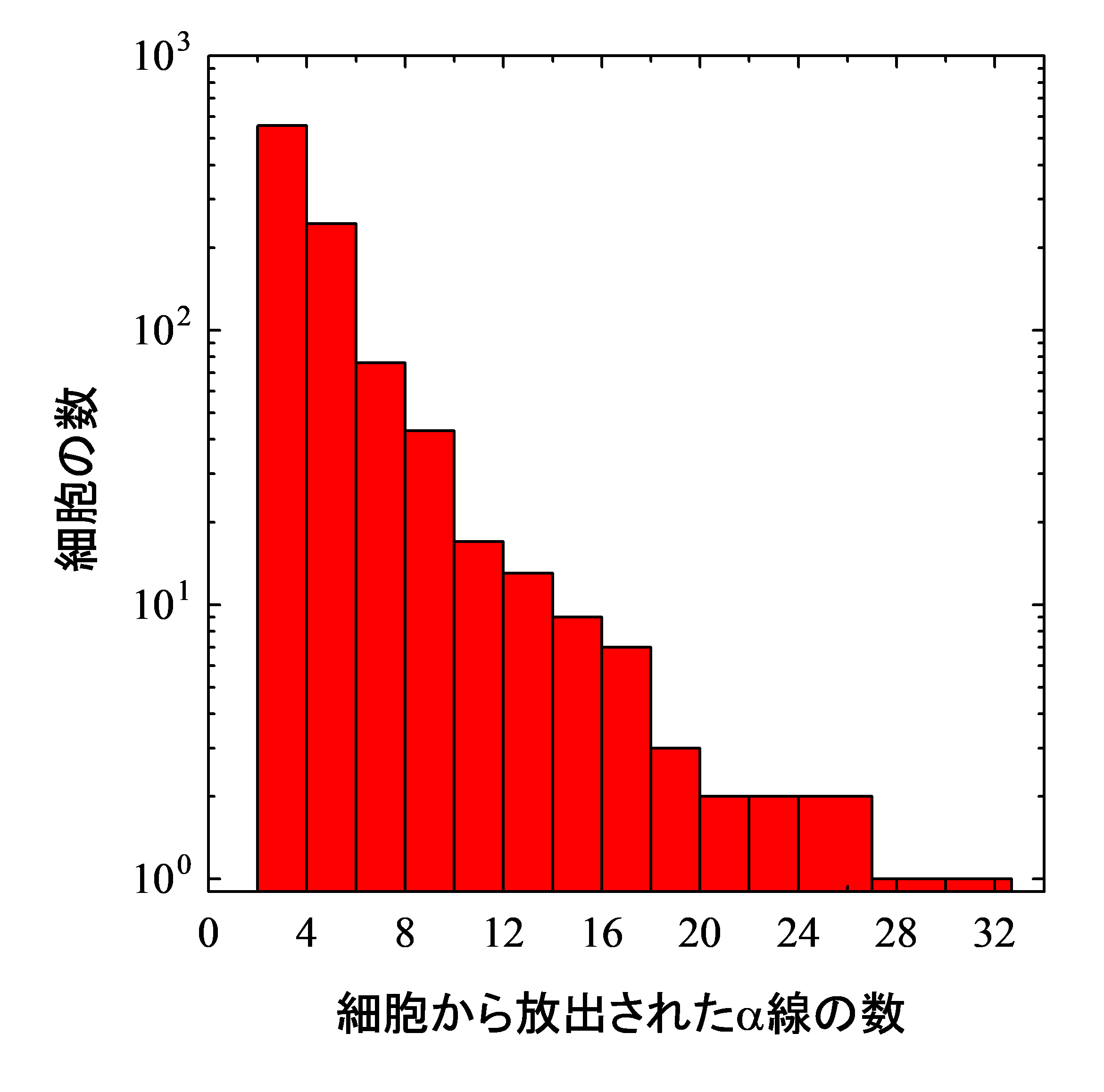
図3. 細胞一個あたりに放出されたα線の数分布
3.放射性薬剤のがん細胞への結合効率の評価
標的アイソトープ治療薬がどれくらいの割合でがん細胞に結合しているかを表す結合効率は、薬剤の品質を評価する上で有用であると考えられますが、これまで評価する手法がありませんでした。そこで、211At-トラスツズマブと混ぜた2023個の単一細胞について、α線が放出されていたかどうかを調べた結果、80%の細胞からα線が放出していたことが分かりました。
結合効率が80%の場合に、細胞一個あたり、平均でどのくらいの数のα線が当たるかを、α線の飛程(約50µm)の半径を持つ球体の中に細胞が敷き詰められており、211At-トラスツズマブが結合した細胞からα線が2本ずつ放出される、という単純なモデルで見積りました(図4)。
その結果、α線は細胞数個分の飛程があることを考慮すると、211At-トラスツズマブの結合の有無に関わらず、一細胞当たり平均で12回α線に当たると見積もられました。
これまでの知見では、細胞の種類にもよりますが数本のα線が当たると死に至ることが報告されていることから、80%の結合効率で十分な細胞致死効果を与えられると考えることができます。設定するモデルの検討などは必要ですが、このことは、その薬剤が細胞死に必要なα線の数を与えるか、という点での品質を結合効率で評価できる可能性を示すものと考えられます。
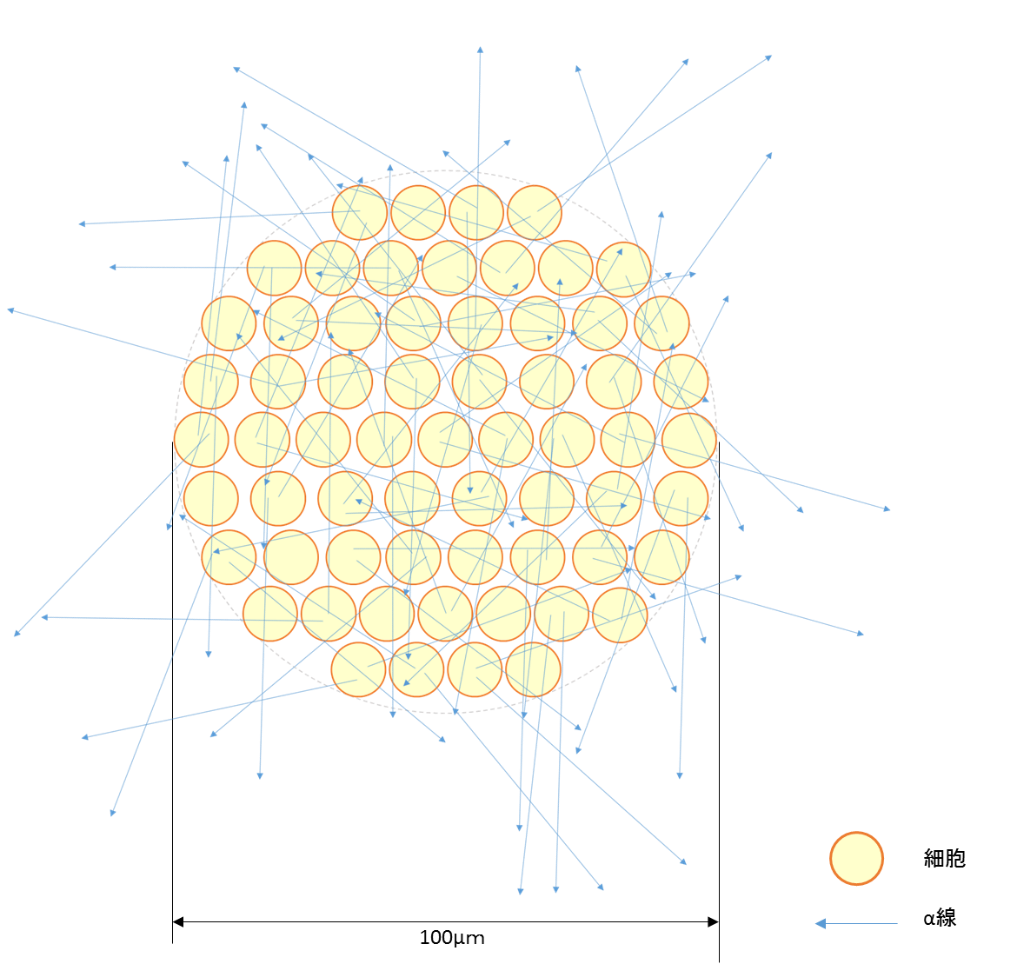
図4.α線の飛程の2倍に相当する直径100µmの球内に、直径10µmの細胞が敷き詰められている場合を仮定したモデルのイメージ図(球の断面)です。80%の細胞それぞれから2本のα線を放出する場合を仮定しています。細胞から放出されたα線は複数の細胞にヒットしながら飛程50µmまで進みます。
今後の展開
本手法では、高倍率の対物レンズを高速でCR-39プレート上を移動させながら、全ての細胞とアルファ線飛跡について、図2のようなミクロ像を撮影し、それらのミクロ像を座標位置の数値を合わせてつなげることで、ミクロの精度を保ちつつ、それぞれの分布を数cm2程度の大面積にわたって可視化することもできます(図5)。
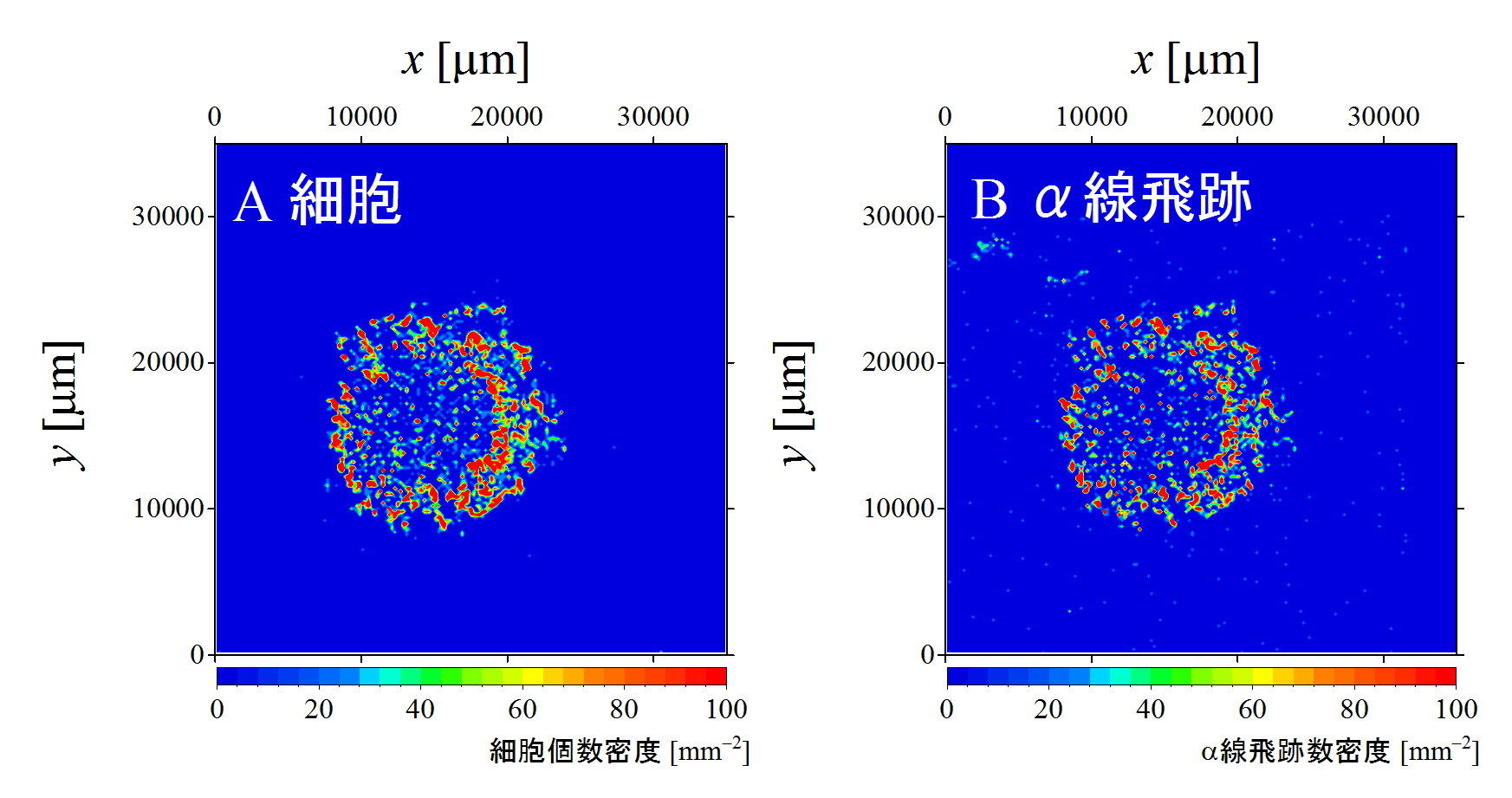
図5. 細胞とα線飛跡位置のマクロイメージング画像(CR-39中央の3.5cm角)です。通常の顕微鏡観察では、より広い領域を観察するために対物レンズの倍率を下げると細部が見えづらくなりますが、本研究では高倍率のままで高速にCR-39プレート上の細胞とα線飛跡を撮像することによって、精度を保ったまま広い視野の分布を見ることができます。
このような顕微鏡画像の大面積解析技術により、211Atを付加した薬剤を投与した動物の組織切片から放出されるα線の分布をイメージングすることによって、がん組織への薬剤集中性や正常組織への影響の定量評価に応用できると考えられます。また、細胞あたりのα線の放出の有無から、211Atを付加した薬剤のがん細胞への結合効率を求めることによって、放射性薬剤の品質評価にも応用できる可能性が示唆されました。今後、細胞致死に必要な細胞一個あたりの線量評価を進めることによって、結合効率を指標に、治療に必要な標的アイソトープ治療薬の投与量を、科学的に決定付けることに役立つと期待されます。
用語解説
1)アスタチン-211(211At)
アスタチンはハロゲン族に属する元素で、ギリシャ語の「不安定」を意味する「astatos(アスタトス)」が名前の由来であり、その名の通りアスタチンは放射線を出して別の元素に変わってしまう性質があります。そのうち211Atはがん治療に有用なα線という放射線を放出する核種で、安定な鉛-207(207Pb)に変わります。211Atの半減期(物質量の半分が別の元素に変わってしまうまでの時間)は7.2時間です。
2)標的アイソトープ治療
細胞障害能力を有する粒子放射線(α線やβ線)を放出する放射性同位体を用いた治療法。RI内用療法、核医学治療とも呼ばれます。放射性同位体を体内に注射し、がん細胞だけを標的として、がん細胞に粒子放射線を体内から照射し殺傷します。
3)α線
α線はHe原子核が非常に速いスピードで飛んでいるものです。物質中を通過する際、物質と相互作用し、例えば物質中の分子が持っている電子を弾き飛ばしたり(電離といいます)することで、物質に対してエネルギーを付与します。α線(He原子核)は質量が大きく、物質中の分子などと衝突しやすいため、透過性が非常に低く、紙一枚で遮断することができる代わりに、物質中では短い通過距離で高いエネルギーを付与することから、分子などを密に電離することができます。α線を細胞に照射した場合、DNAに修復することが難しいキズ(DNA二重鎖切断)ができます。この現象はα線が、がん細胞を効果的に殺滅できる理由のひとつです。
4)CR-39固体飛跡検出器
メガネのレンズとして開発されたプラスチックで、α線や炭素線等の粒子線の飛跡を可視化して記録できる放射線検出器です。粒子線がCR-39に入射すると、その通過経路に沿って分子結合が損傷をうけます。後からアルカリ溶液等で化学エッチング処理すると、その損傷部分がエッチピットと呼ばれる円すい状の穴が形成され、光学顕微鏡で観察が可能になります。211Atからのα線一つに対して一つのエッチピットが形成します。エッチピットの大きさは、入射した粒子によって局所的に与えられるエネルギー量に比例します。またその数も調べることができます。このように、エッチピットの大きさと数の情報から、単位面積当たりのエネルギー付与の総和を求めれば、吸収線量を評価することができます。一般的な放射線検出器は、動作に必要な電源や電気回路が必要になり、センサー自身も半導体等の無機物質であることが多いです。このため細胞や組織切片等の生体物質と組み合わせた実験は難しいのが現状です。これに対してCR-39はプラスチックの板であり、電源や回路は必要ないので、生体物質を直接密着させた実験ができます。光学顕微鏡でエッチピットを測定するので、位置の測定精度は一般的な放射線検出器よりも格段に優れているという特徴があります。
5)211At-トラスツズマブ
α線を放出する核種である211Atを抗体(トラスツズマブ)に結合させた放射性薬剤です。トラスツズマブは、胃がんや乳がん等の一部のがんで高発現しているHER2タンパク質に結合する抗体で、上記のがんに対して抗体治療薬として使われています。HER2タンパク質は、細胞の表面に存在するタンパク質で治療のよい標的とされています。
論文について
論文タイトル
Validating α-particle emission from 211At-labeled antibodies in single cells for cancer radioimmunotherapy using CR-39 plastic nuclear track detectors
DOI: 10.1371/journal.pone.0178472
執筆者名
Satoshi Kodaira1, Huizi Keiko Li1,2, Teruaki Konishi1, Hisashi Kitamura1, Mieko Kurano1, Sumitaka Hasegawa1
執筆者所属
1国立研究開発法人量子科学技術研究開発機構 放射線医学総合研究所
2千葉大学大学院 医学薬学府
