発表のポイント
- 30年以上にわたりがん診断・治療用薬剤への応用が期待されてきたにもかかわらず製造が困難であった放射性銅67(Cu-67)について、加速器で作るエネルギーの高い中性子を利用した実用的製造法を世界で初めて開発した。
- さらに、Cu-67そのものが大腸がんに顕著に集積する性質も持つことをマウス実験により発見した。
- 開発した製造法はCu-67以外の放射性核種の製造にも応用が可能であり、がん診断・治療の将来を支える基盤技術として大いに期待される。
国立研究開発法人量子科学技術研究開発機構(理事長 平野俊夫、以下「量研」という。)量子ビーム科学研究部門高崎量子応用研究所東海量子ビーム応用研究センター プロジェクト「加速器中性子利用RI生成研究」の須郷由美上席研究員、橋本和幸上席研究員、永井泰樹研究員(大阪大学名誉教授・東京工業大学名誉教授)、および、株式会社千代田テクノル(代表取締役社長:山口和彦)の川端方子研究員、佐伯秀也技術員、佐藤俊一技術員らは共同で、がんの診断と治療の両方に役立つことが長年期待されてきた放射性銅67(Cu-67)を、加速器で作る中性子を利用することにより大量かつ高品質で製造する技術を世界に先駆け開発しました。
一般に、薬剤の患部への集積性には個人差があるため、特にがん治療においては、治療効果と信頼性・安全性を高めるために、薬剤のがんへの集積量を患者個々人について確認する技術が望まれていました。これに対し、がんへの薬剤集積の度合いを身体の外から画像化することが可能な放射線を出し、同時にがん細胞を直接攻撃するための放射線も出すCu-67を含む化合物を薬剤として用いることが、30年以上前から期待されてきました。しかし、これまで加速器で得られる陽子や原子炉で得られる低エネルギーの中性子を原料に照射する方法が試みられてきましたが、医療用に適した高品質のCu-67を大量に製造することができず、Cu-67の利用は実現しませんでした。そこで、本研究グループは、まず加速器を利用して原子炉よりも格段に高いエネルギーの中性子を生成させた上で、それを放射性核種の製造に利用するという着想の下で開発を進め、今回、大量かつ高品質のCu-67製造技術を初めて確立しました。さらに本法で得られたCu-67塩化物を、大腸がんを移植したマウスに注射したところ、Cu-67そのものが大腸がんに顕著に集積する性質も持っていることを発見しました。
この加速器を利用した製造法はCu-67以外の放射性核種の製造にも応用が可能であるため、将来のより正確ながん診断や外科的手術に依らないがん治療を支える基盤技術として大いに期待されます。本研究成果は、日本物理学会欧文誌において、2016年12月28日にオンライン公開されます。
背景と目的
Cu-67(放射能が半分になる時間(半減期)が62時間)は、がん治療に適したベータ線と画像診断に適したガンマ線を同時に放出するため、がんへの薬剤の集積をその場で診断しながら治療もできる1)画期的な放射性核種(RI)として期待されてきました。一般にRIの製造には、加速器で加速した陽子や原子炉で得られる中性子を原料物質に照射して、原子核中の陽子や中性子をはじき出す方法が利用されています。そのためこれまで30年余にわたり、加速器や原子炉を利用して臨床応用に適したCu-67を製造する方法が模索されてきましたが、Cu-67の生成に対しては、陽子による反応や原子炉から発生するエネルギーの低い中性子による反応の効率が低いため、がん治療に必要とされる品質と製造量を確保することが到底困難であり、Cu-67診断・治療薬の研究開発は世界中で停滞していました。そこで我々は、サイクロトロン加速器を用いて加速した重陽子をベリリウムに衝突させ、原子炉の中性子よりも10億倍以上エネルギーの高い中性子(加速器中性子)2)を利用するという着想のもと、この中性子を亜鉛ターゲットに照射することで大量かつ高品質なCu-67を製造する研究に取り組みました。
手法と成果
我々は、量研 高崎量子応用研究所のサイクロトロン加速器を用いて、亜鉛68(Zn-68)に適切なエネルギーの加速器中性子を照射する方法を開発し、原子核から中性子と陽子を一つずつはじき出し、Cu-67を効率よく生成させました(図1)。しかし、生成したCu-67の量は原料である亜鉛の100万分の1以下であるので、これを医薬品として利用するためには、亜鉛とそこに含まれる不純物元素、並びに上記照射で同時に生成される副生成RIから、Cu-67をきれいに分離精製することが重要となります。その手法として、我々は3段階の化学分離法(カラムクロマトグラフ法3))を開発し(図2)、効率よく(回収率95%以上)、かつ不純物RI・元素の少ない高品質のCu-67を得ることに成功しました。
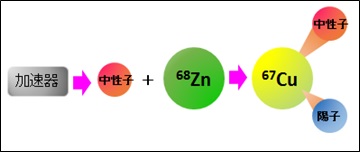
図1:加速器で作る中性子によるCu-67の製造
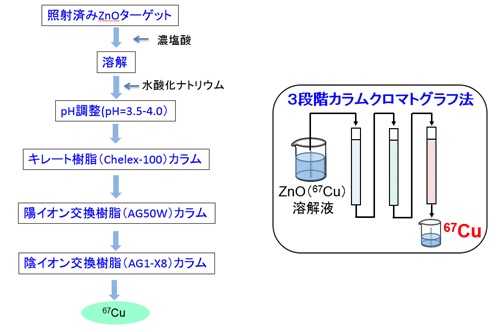
図2:Cu-67の分離・精製手順
この新たな製造法により、今後、Cu-67を分子内に含むがん診断・治療薬の開発が大いに加速されることが期待できます。それに先立ち、我々は薬剤と結合していないCu-67そのものの体内での移行性を確認しておく必要があると考えました。得られたCu-67塩化物を、大腸がん細胞を皮下移植したマウスの尾静脈から投与し、一定時間(0.5~48時間)経過した後にマウスを解剖し、血液、がん、肝臓、腎臓等の各臓器へのCu-67の集積率を放射能測定により分析しました。その結果、Cu-67は大腸がん(腫瘍)に顕著に集積する性質を持つことを発見しました。この予想外の結果は、Cu-67それ自体が大腸がんの診断・治療に役立つ可能性を示唆するものです。今後は薬剤などに標識して腫瘍への集積性をさらに高めるための研究開発を進めていきます。
なお、Cu-67の製造・分離は、量研と千代田テクノルが担当し、マウス実験は、量研が担当しました。
今後の展開
今回の開発は加速器で作る中性子を用いて、医療応用が可能なCu-67の製造法を開発したもので、Cu-67による新たながん診断・治療薬開発に道を拓くものです。
また、本成果は加速器中性子を利用した他の様々な有用RIの製造法の開発にも役立つものです。たとえば我々は、現在核医学診断に最も利用されているRIであるTc-99m4)(我が国は全量を海外の原子炉を利用した製造に依存しています)の大量製造にも加速器中性子を用いる方法が有効であることをこれまでに見出しており、本法は将来のがん診断・治療を支える医療用RI製造基盤技術となることが大いに期待されます。
今後は、高純度Cu-67の実用製造プロセスの確立を図り、医療用RIの製造並びにがん治療用放射性医薬品開発の活性化に貢献することを目指します。
用語解説
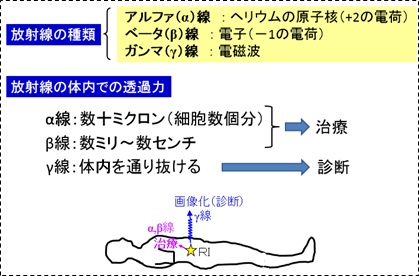
1)RIを用いた診断と治療
RIから放出される放射線の種類の違いにより、物質(体内)との相互作用が異なるため、医学応用が異なります。α[アルファ]線(ヘリウム原子核)やβ[ベータ] 線(電子)は、がん細胞を殺傷する能力を持っているため、治療に利用されます。一方、γ[ガンマ]線は、透過力が強いため、体外で測定をすることが可能であり、画像診断を行うことができます。
2)エネルギーの高い中性子
加速器中性子とは、加速器により作り出したエネルギーの高い粒子(重陽子)を中性子発生用標的物質(ベリリウム、炭素など)にぶつけることにより、標的物質から効率よくはじき出される高エネルギーの中性子です。本研究で使用した中性子のエネルギーは、最大5千万エレクトロンボルト(エレクトロンボルト:粒子のエネルギーを表す単位)で、通常RI製造に利用される原子炉からの中性子のエネルギー 約0.025エレクトロンボルトよりも10億倍以上高いものです。そのため、原子炉では製造しにくいRI等、様々なRIを効率よく製造できます。
3)カラムクロマトグラフ法
金属イオン等の化学物質と相互作用をする樹脂と呼ばれる物質を、筒状の容器(カラム)に詰め、そこへ、金属イオンが溶解した溶液を通過させることにより、化学物質を分離し、目的の化学物質を得る分析手法です。
4)Tc-99m
Tc-99m(テクネチウム-99m)は、画像診断に適したガンマ線を放出するため、現在、核医学の分野で最も使用されているRIであり、我が国では、年間70~90万件の診断に利用されています。Tc-99mは親核種であるMo-99(モリブデン-99)から得られますが、現在、Mo-99は世界の数基の研究用原子炉を利用して製造されており、我が国は全量を輸入に依存しています。さらに近年、原子炉を用いないMo-99の生成法の確立が世界的に重要な課題となっているため、今回の研究成果で加速器中性子を利用した大量・高品質RI製造を実現したことは、この問題の解決にも大きく貢献することが期待できます。
