発表のポイント
- 特定のタンパク質が表面に存在するがん細胞にだけ結合してα線1)を放出する標的アイソトープ治療2)薬(211At-トラスツズマブ3))を作製した
- 胃がん腹膜播種4)モデルマウスに211At-トラスツズマブを投与し、治療効果を確認した
- 効果的な治療法が無く、予後が非常に悪い胃がん腹膜播種に対する新たな治療法となることが期待される
国立研究開発法人量子科学技術研究開発機構(理事長 平野俊夫。以下「量研」という。)放射線医学総合研究所 放射線障害治療研究部放射線がん生物学研究チームの長谷川純崇チームリーダー・李惠子日本学術振興会特別研究員は、同研究所 標識薬剤開発部の永津弘太郎主幹研究員と共同で、腹膜播種した転移性胃がんに対するα線放出核種を用いた治療薬を作製し、動物実験によりその治療効果を世界で初めて明らかにしました。
胃がんは、日本のみならず、世界的に見ても発生数が多く、肺がん、肝臓がんに次いで死亡数が多いがんです。日本では胃内視鏡等を用いた早期診断法が確立しており、早期胃がんの場合は治癒が見込まれます。しかし、転移した場合は治療法が限られ、予後が悪いことが知られています。特に、胃がんが腹膜に散らばるように転移した胃がん腹膜播種では、腹水貯留やがん性腹膜炎を発症し、平均の生存期間が数ヶ月と非常に予後が悪くなりますが、効果的な治療がなく、新たな治療法が望まれていました。
量研では、放射線の飛ぶ距離が細胞数個分で、当たった細胞を殺傷する能力が高いα線を放出する核種アスタチン-211(211At)を加速器で効率よく製造することに成功しています(2016年6月13日プレスリリース)。この211Atを胃がん細胞だけに届けることが出来れば、周囲の正常細胞を傷つけることなく、がん細胞を殺傷することが可能です。そこで、本研究チームは、HER2というタンパク質5)が細胞の表面に存在しているがん細胞にだけ結合する抗体であるトラスツズマブ(商品名ハーセプチン)に211Atを付加した標的アイソトープ治療薬211At-トラスツズマブを開発しました。211At-トラスツズマブを、胃がん腹膜播種を模したモデルマウスに1回投与したところ、薬剤が腹膜に散らばった胃がんに集まり、投与したマウスのほとんどでがんが縮小し、一部のマウスではがんが消失することが確認されました。一方で、副作用の指標となる体重や白血球数の減少、腎臓や肝臓の機能に異常は認められませんでした。これらの研究成果から、211At-トラスツズマブによる標的アイソトープ治療がHER2陽性の胃がん腹膜播種に対して、副作用の少ない効果的な治療法となることが期待されます。
この成果は、がん研究の分野でインパクトの大きい論文が数多く発表されている日本癌学会誌「Cancer Science」2017年6月29日号にオンライン掲載予定です。
研究開発の背景と目的
胃がんは日本のみならず世界的に見ても罹患数や死亡数が上位のがんです。早期で発見される胃がんについては、予後が良好で治癒も期待できます。しかし、転移した胃がん、特に、腹膜に散らばるように転移した“胃がん腹膜播種”は、手術や重粒子線がん治療を含めた外照射放射線治療等の適応もありません。また、現在のところ、抗がん剤や分子標的薬による薬物療法も限界があります。このため、腹膜播種胃がんの患者の平均生存期間は数ヶ月と非常に予後が悪いことが知られています。効果的な薬剤や治療法の開発が強く望まれている状況です。
量研は、放射線の飛ぶ距離が細胞数個分で、当たった細胞を殺傷する能力が高いα線を出す核種211Atを加速器で製造することに成功しています。この211Atを腹膜播種した胃がん細胞に効率よく届けることが出来れば、周囲の正常組織に障害を与えることなく腹膜播種胃がんを治療することが可能ではないかと研究チームは考えました。
211Atを胃がん細胞に届ける手法として、正常細胞と比べてがん細胞の表面に非常に高密度に存在し、胃がんの20%で過剰に存在していると言われるHER2タンパク質に着目しました。そこで、HER2タンパク質に強く結合する抗体(トラスツズマブ、商品名ハーセプチン)に211Atを結合した211At-トラスツズマブを作製し、胃がん腹膜播種に対するその治療効果をモデル動物において実証することを目的としました。
研究の手法と成果
211Atをトラスツズマブ抗体に結合させた標的アイソトープ治療薬、211At-トラスツズマブを作製し、その治療効果を確認するため、HER2陽性胃がん細胞を腹膜に移植した腹膜播種胃がんモデルマウスの腹腔にトラスツズマブ単体、211At単体、および211At-トラスツズマブをそれぞれ1回投与して、60日間観察しました。トラスツズマブおよび211Atは、それぞれ単体の治療でも、投与量を増やすことでがんを治療することは可能ですが、標識抗体(211At-トラスツズマブ)の治療効果と、それぞれ単体での効果を比較するために、トラスツズマブの量や放射能は標識抗体と同じにしており、それぞれの投与量は抑えています。
その結果、トラスツズマブまたは1MBqの211Atをそれぞれ単体で投与した群(6匹)では観察期間中に、すべてのマウスでがんが増殖し死に至りました。一方、1MBqの211At-トラスツズマブを投与した一群(6匹)では、5匹が生存し、そのうち2匹ではがん消失(がん細胞が確認できない状態)し、残りの3匹では50-90%のがん退縮が認められました(図1、図2)。211At-トラスツズマブ投与群では、副作用として懸念された体重や白血球数の減少は観察されず、肝臓や腎臓の機能異常も認められませんでした。
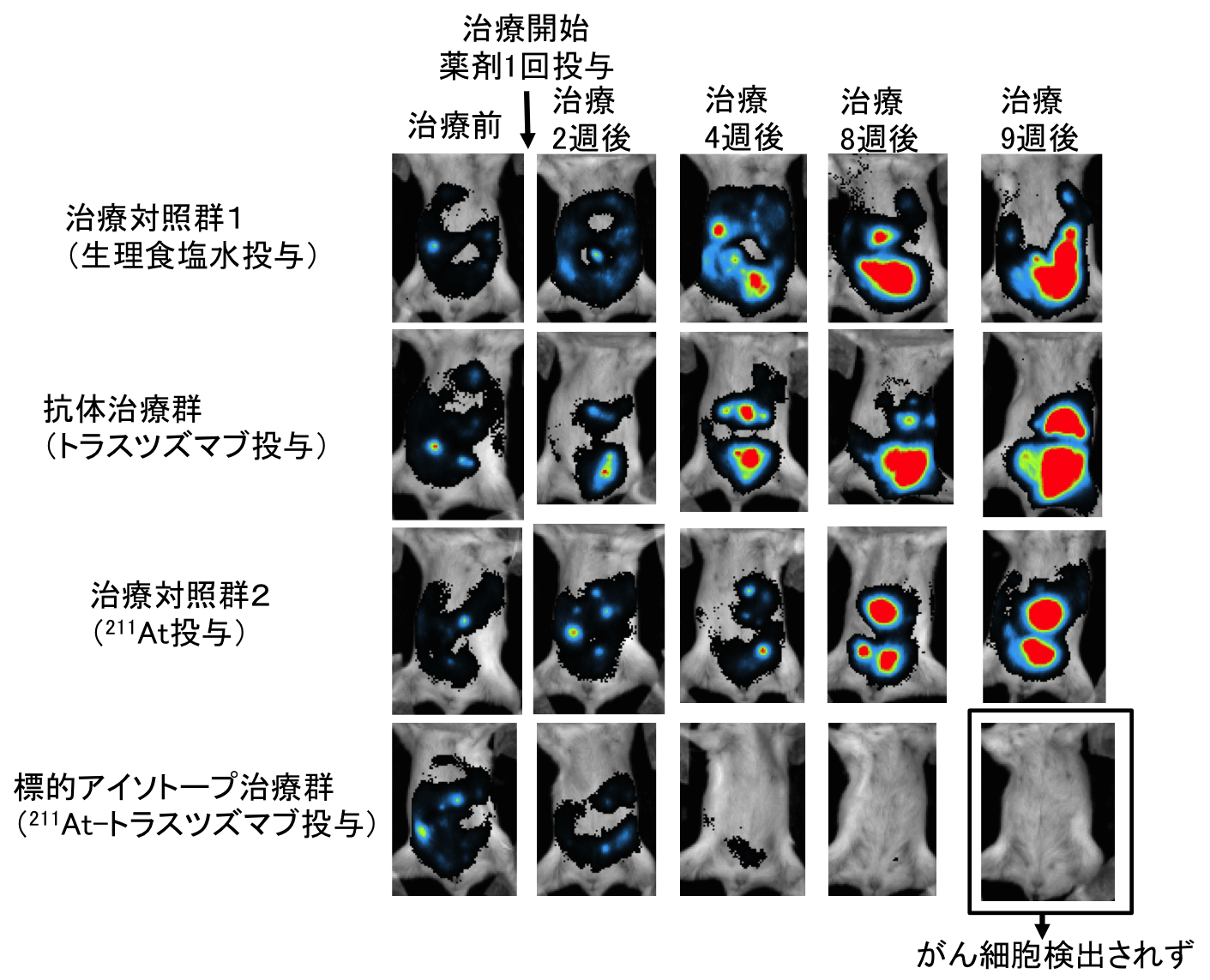
図1 腹膜播種胃がんのイメージング画像
移植した胃がん細胞には、発光酵素(ルシフェラーゼ)遺伝子が組み込まれており、がん細胞の発光輝度を計測することで、がん細胞の増殖の有無を生きたままの動物で調べることが可能です。図のように、治療対照群(生理食塩水投与)や、抗体治療群(トラスツズマブ投与)、および治療対照群(211At投与)では、腹膜でのがん細胞が増殖しています。一方、α線を放出する標的アイソトープ治療群(211At-トラスツズマブ投与)では、治療してから4週以降でがん細胞の退縮が顕著に認められ、9週ではがん細胞が検出されませんでした。
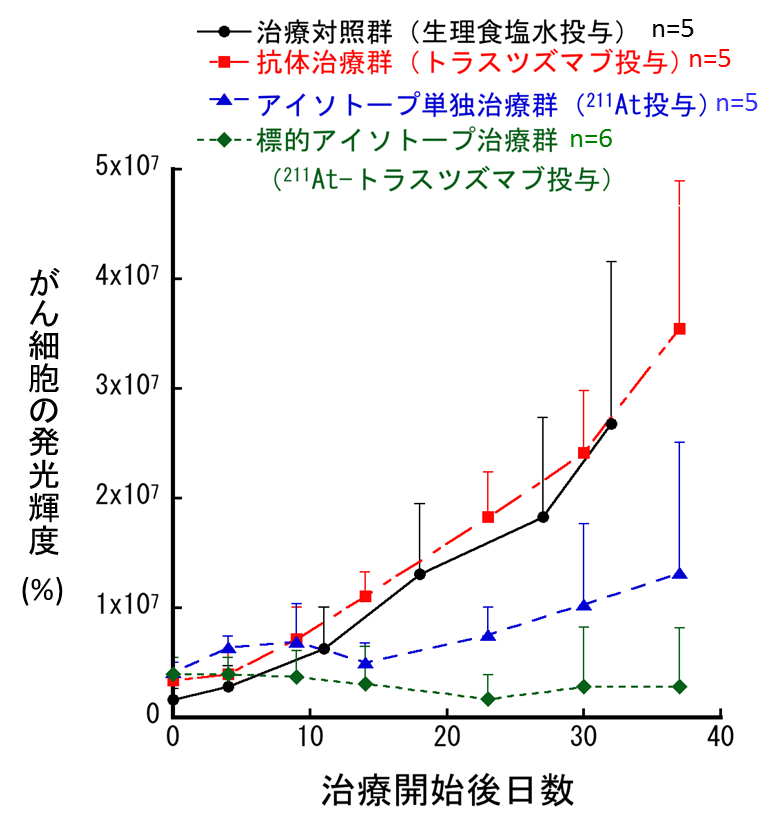
図2 治療効果の解析結果
図1で観察されたがん細胞の増殖をグラフにした結果です。マウスの腹部が収まるよう測定範囲を設定して、個体ごとに全がん細胞の発光輝度を測定しました。治療対照群(生理食塩水投与)、抗体治療群(トラスツズマブ投与)、およびアイソトープ単独治療群(211At 投与)では、がん細胞の発光輝度が増加、つまり、がん細胞が増えているのがわかります。一方、標的アイソトープ治療群(211At-トラスツズマブ投与)では、発光輝度値が変わらず、がんの増殖が抑えられているのがわかります。
今後の展開
本成果により、211At-トラスツヅマブによる標的アイソトープ治療は、HER2陽性の胃がん腹膜播種に対する副作用の少ない、効果的な治療法となることが期待されます。今後はヒトへの応用に向けて、ヒトへの投与に適した薬剤合成、安全性の検討や治療最適化のための検討などに取り組み、臨床研究に進めていきたいと考えています。
用語解説
1)α線
α線はHe原子核が非常に速いスピードで飛んでいるものです。物質中を通過する際、物質と相互作用し、例えば物質中の分子が持っている電子を弾き飛ばしたり(電離といいます)することで、物質に対してエネルギーを付与します。α線(He原子核)は質量が大きく、物質中の分子などと衝突しやすいため、透過性が非常に低く、紙一枚で遮断することができる代わりに、物質中では短い通過距離で高いエネルギーを付与することから、分子などを密に電離することができます。α線を細胞に照射した場合、DNAに修復することが難しいキズ(DNA二重鎖切断)ができます。この現象はα線が、がん細胞を効果的に殺滅できる理由のひとつです。
2)標的アイソトープ治療
細胞障害能力を有する粒子放射線(α線やβ線)を放出する放射性同位体を用いた治療法。RI内用療法、核医学治療とも呼ばれます。放射性同位体を体内に注射し、がん細胞だけを標的として、がん細胞に粒子放射線を体内から照射し殺傷します。
3)211At-トラスツズマブ
α線を放出する核種であるアスタチン-211(211At)を抗体(トラスツズマブ)に結合させた放射性薬剤です。トラスツズマブは、胃がんや乳がん等の一部のがんで高発現しているHER2タンパク質に結合する抗体で、上記のがんに対して抗体治療薬として使われています。HER2タンパク質は、細胞の表面に存在するタンパク質で治療のよい標的とされています。
4)胃がん腹膜播種
胃がんが胃壁を破って、腹膜内を覆う膜の表面にがん細胞が散らばるように転移・生着した状態です。
5)HER2タンパク質
ERBB2、NEUとも呼ばれるタンパク質で、細胞表面に存在しています。細胞の増殖や分化などに関与しているタンパク質であり、受容体型チロシンキナーゼとして細胞外部からの信号を細胞内部に伝える役割を持つ、がん遺伝子の一種です。乳がんや胃がんの一部で高い発現をしており、このタンパク質に対する抗体であるトラスツズマブ(商品名ハーセプチン)は、上記のがん治療に抗がん剤と組み合わせて用いると効果が上がることがわかっています。
論文について
Locoregional therapy with α-emitting trastuzumab against peritoneal metastasis of human epidermal growth factor receptor 2-positive gastric cancer in mice
Huizi Keiko Li1,2,3, Yukie Morokoshi1, Kotaro Nagatsu1, Tadashi Kamada1,2, and Sumitaka Hasegawa1
- 国立研究開発法人量子科学技術研究開発機構
- 千葉大学大学院 医学薬学府
- 日本学術振興会
