プレスリリース
放医研プレス 2016年12月06日
脳内に「やる気」のスイッチ、目で見て操作
―霊長類の生体脳で人工受容体を画像化する技術を確立、高次脳機能研究の飛躍的な進展に期待―
発表のポイント
- PET1)による画像化により、生きたサルの脳内で人工受容体2)が発現する位置や範囲を経時的に観察する世界初の技術の確立に成功
- 人工受容体が標的部位に発現していることを確認したサルに、特定の薬剤の全身投与することで価値判断行動を変化させることに成功
- ヒトを含む霊長類の高次脳機能研究の加速化や、精神・神経疾患に対する新たな遺伝子治療法の開発に寄与
国立研究開発法人量子科学技術研究開発機構(理事長平野俊夫)放射線医学総合研究所脳機能イメージング研究部、国立大学法人京都大学霊長類研究所(所長湯本貴和)、および米国国立精神衛生研究所(NIMH, Director Thomas Insel)の研究グループは、サルの脳内に発現させた人工受容体を生体で画像化する技術を世界で初めて確立するとともに、標的脳部位に人工受容体が発現していることを確認したサルに、人工受容体に作用する薬剤を全身投与し、価値判断行動を変化させることに成功しました。
脳には特定の機能を担当する神経細胞集団からなる「神経核」とよばれる多数の部位があり、それらの部位が協調して働くことで判断や意思決定など様々な高次脳機能を生み出しています。この仕組みが破綻して精神・神経疾患等の病態を示すことから、特定の脳部位の神経活動を操作することによって変化する機能を同定することが重要です。
この目的のため、実験動物の特定の脳部位の神経細胞集団に「スイッチ」の役割をする人工受容体タンパク質を遺伝子導入技術により発現させ、その受容体にだけ作用する薬で神経活動を局所的に操作する手法が様々な研究に用いられてきました。しかし、従来、標的となる神経細胞集団に狙い通り受容体が発現しているかを確認するためには、すべての実験終了後に脳組織標本を作製して確認するしか手段がありませんでした。特にヒトに近いサルを対象とした実験では、利用できる個体数が限られることもあり、人工受容体を発現させるような遺伝子導入技術を利用して脳機能操作に成功した研究例はごく少数でした。
今回、研究グループは人工受容体遺伝子を組み込んだウイルスベクター3)をサルの特定の脳部位の神経細胞集団に感染させ、発現した人工受容体をPETにより画像化し、発現のタイミングや位置、範囲、強さを生きたまま評価することに成功しました。さらに、線条体4)という構造の一部の神経細胞群に人工受容体を発現させ、受容体に作用する薬剤を全身投与し神経活動を「スイッチ・オフ」にしたところ、それまでサルが問題なくこなしていた報酬量に基づく「価値判断」に関わる行動が障害されたことから、この線条体領域が価値判断を担っていることが確認できました。
本研究成果により、霊長類の脳において遺伝子導入によって発現させた人工受容体を画像化する技術が確立されました。サルではこれまで難しかった、特定の脳部位を非侵襲的に、一定時間、繰り返し操作するという神経活動制御を効率的かつ高精度に実施できるようになることから、サルを用いた高次脳機能研究の飛躍的な進展が期待されます。また、人工受容体遺伝子を精神・神経疾患の原因となる神経細胞群に導入して、症状が出た時にだけ薬で抑えるような、画期的治療法の開発が期待でき、臨床応用の観点からも本研究成果の意義は極めて大きいと考えられます。
本研究は、日本医療研究開発機構(AMED)「革新的技術による脳機能ネットワークの全容解明プロジェクト(平成27年度に文部科学省により移管)」「臨床と基礎研究の連携強化による精神・神経疾患の克服(融合脳)」、科学研究費助成事業「新学術領域研究」、科学技術振興機構(JST)戦略的創造研究推進事業(さきがけ)における成果を一部活用したもので、「Nature Communications」に掲載予定です。
研究開発の背景と目的
ヒトやサルの脳は、特定の機能を担当する多数の神経細胞集団からなる領域が複数繋がってできています。そして複数の領域が協調して働くことで判断や意思決定など様々な高次脳機能を生み出しています。この仕組みを理解し、その破綻としての精神・神経疾患の病態を解明するためには、特定の脳領域の神経活動を操作することで、どのような機能が障害されるかを明らかにすることが重要です。
遺伝子導入技術の進歩により、遺伝子の運び屋であるウイルスベクターを脳の局所に注入して神経細胞集団に感染させ、その活動を操作する「スイッチ」の役割をする人工受容体タンパク質を発現させることが可能です。中でも特定の薬が結合してスイッチがオン/オフされる人工受容体を目的の神経細胞に発現させることで、神経活動を操作する手法は、多くのラットやマウスを用いた研究に用いられています。しかし、従来、標的となる神経細胞集団に狙い通り受容体が発現しているかを確認するためには、すべての実験終了後に、脳組織標本を作製して確認するしか手段がありませんでした。特に研究に利用できる個体数が限られるサルでは、人工受容体を用いるような遺伝子導入技術を応用した脳機能の操作に成功した研究例はごく少数でした。
本研究に先立って、量子科学技術研究開発機構のグループは、PETにより人工受容体を画像化する手法を開発し、マウスで実証しています。今回研究グループは、この手法をサルに適用し、生きたままのサルの脳内で人工受容体を画像化することにより、サル脳機能の操作法を最適化することを目的としました(図1)。
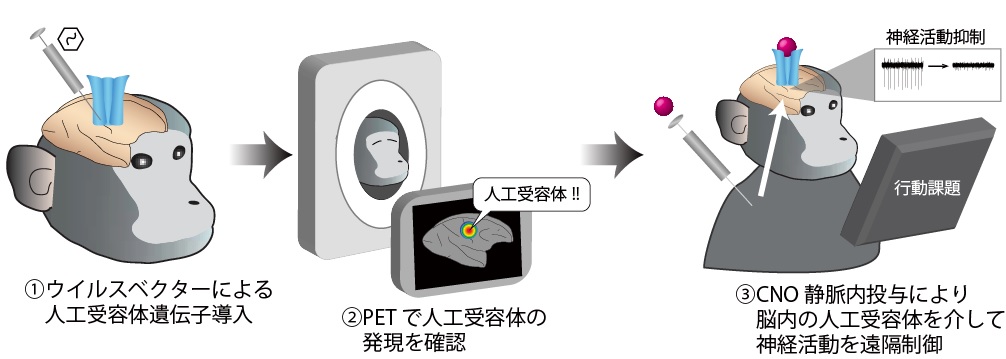
図1:本研究により確立したPETモニタリングによるサル脳神経活動操作法
サルが生きた状態で人工受容体の発現を確認した後、神経活動操作等の実験を行うことが可能になりました。
研究の手法と成果
2頭のマカクザル(サル1、サル2)の線条体という領域に対して、右側には人工受容体が発現するウイルスベクターを、左側にはコントロールとして蛍光タンパク質を発現するウイルスベクターを局所注入しました(図2-A)。一定期間の後、人工受容体に結合する薬剤クロザピン(CLZ)をポジトロン核種の11Cで標識したPET薬剤11C-CLZを投与し、経時的にPET撮影して、サル生体脳での人工受容体発現の画像化を試みました(図2-B)。その結果、サル1では約1.5ヶ月で人工受容体発現量はピークに達すること、サル2では、その発現量が約1.5年後まで維持されていたことを確認しました(図2-C)。また死後脳の免疫染色によって確認された人工受容体発現範囲がPET画像とほぼ一致していました(図2-B)。このように11C-CLZを用いてウイルスベクターをサル脳局所に注入した後、人工受容体が発現するタイミングや発現の場所・レベルを生きたまま評価できることが確かめられました。
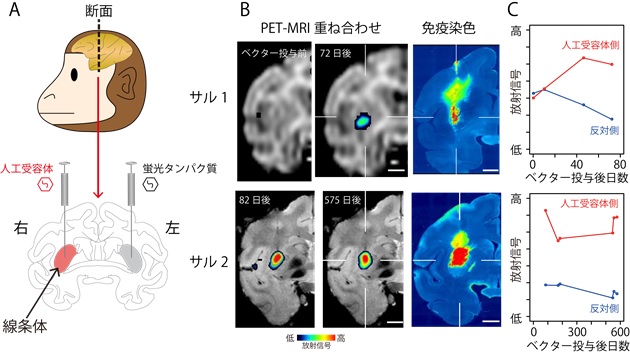
図2.サルの脳内に発現した人工受容体のPETによるイメージング
A: 人工受容体遺伝子を発現するウイルスベクターを投与した部位。B:ウイルスベクター投与後、経時的な人工受容体発現をPETで画像化したもの(右脳のみ表示)。免疫染色標本と比較したところ、実際の発現位置および範囲がほぼ一致することがわかりました。C:人工受容体発現レベルの経時的変化。約1.5ヶ月でピークに達し、約1.5年後まで維持されていました。
次にPETで発現を確認した人工受容体により神経活動を制御して、サルの行動を変えることができるかを検証しました。今回標的とした吻内側尾状核5)と呼ばれる脳部位は、期待する報酬の大きさに応じて神経活動が変化することが報告されています。そこでこの領域の神経活動を抑えた時に、サルの報酬の価値判断が影響されるかを調べました。
まず、3頭のマカクザル(サル3、サル4、サル5)の左右の吻内側尾状核に抑制型の人工受容体を発現するウイルスベクターを注入し、PETで狙い通り人工受容体が発現することを確認しました(図3-A)。
これらのサルに、縞模様の絵の上に現れる信号の色が変わったら握っているバーを離すという簡単な課題を訓練し、報酬としてジュースを与えました。ジュースの量は4段階あり、縞模様の数と対応しています(図3-B)。学習済みのサルはジュースが8滴貰えるとわかると熱心にバー離す行動をしますが、1滴しか貰えないときは、拒否する試行が増えます。拒否する割合は、サルが1滴から8滴に増えるにつれ減っていきました(図3-C,ベクター投与後)。
次に人工受容体に作用するCNOという薬物を全身投与して、吻内側尾状核の活動を抑制すると、サルはいつもより拒否を示すことが多くなるのに加え、1滴と2滴の違いが見られなくなりました(図3-C、CNO投与日)。このことから、吻内側尾状核が価値判断に必須な領域であることが確かめられました。また、この価値判断の障害はCNO投与後約2時間持続する一方、投与した翌日には全く見られないことも確認できました(図3-C、CNO投与翌日)。
以上の結果から、人工受容体により神経活動を制御し、サルの行動を一時的にかつ繰り返し操作できることがわかりました。
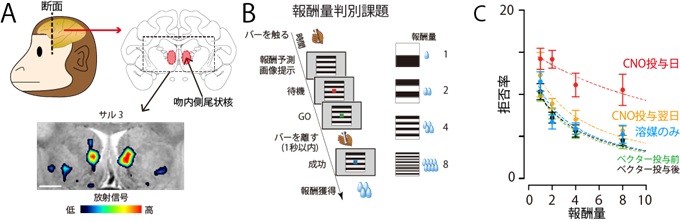
図3:人工受容体を介した吻内側尾状核の抑制によるサルの価値判断行動の変化
A:左右両側の吻内側尾状核に人工受容体を発現するウイルスベクターを投与後45日目の11C-CLZを用いたPET測定による人工受容体の画像化。
B:報酬量を判別する行動課題の模式図。
C:全体の試行回数のうち、バー離し行動を拒否した試行の割合。報酬量と反比例の関係を示すことが知られています。
今後の展開
本成果により、サル脳内に導入した人工受容体をPETで生きたまま画像化できることが実証され、サルではこれまで難しかった任意の脳領域を非侵襲に、一定時間、繰り返し操作するという神経活動制御が効率的かつ高精度に行える可能性が示されました。これにより、今後サルを用いた高次脳機能研究が飛躍的に進展することが期待できます。
今回用いた人工受容体は神経細胞の活動を抑制させる作用を持ちますが、興奮させる作用を持つ人工受容体も存在します。このような人工受容体遺伝子を精神・神経疾患の症状の原因となる神経活動異常に合わせ、目的の脳領域の神経細胞群に導入して、症状が出た時にだけ薬で抑えるような革新的な治療法の開発への応用が期待できます。例えば、特定の脳領域の活動異常が原因となる脳疾患の一つであるてんかんについては、モデルラットにおいて異常活動する神経細胞集団に抑制性の人工受容体を発現させ、薬剤を作用させることで治療できることが報告されています。このような脳疾患の治療法の開発や、将来的なヒトへの応用において、霊長類の脳に導入した人工受容体を経過観察する技術は必要不可欠であることから、医学応用の観点でも本成果の意味は極めて大きいと考えられます。
用語解説
- PET
陽電子断層撮影法(Positron Emission Tomography)の略称。ポジトロン核種(11C、13N、15O、18F等)で標識したPET薬剤を体内に投与し、特定の体の部位に集積したり体内物質に結合したりするPET薬剤から放射される陽電子に起因するガンマ線を検出することによって、体深部に存在する生体内物質の局在や量を測定して画像化する方法。 - 人工受容体
本来生体内に存在する受容体(内因性受容体)に遺伝子変異を入れることにより作られた、人工の受容体。神経のシグナル伝達は、神経伝達物質(リガンド)とそれが結合する受容体により機能する。一方、人工受容体は、生体内に存在するリガンドが結合することはなく、特定の人工リガンドのみが結合して、その活性が制御される。今回研究に用いたのはヒトムスカリン4型受容体の変異(hM4Di)で、人工薬物である酸化クロザピン(CNO)により、発現している神経細胞の活動を抑制する。 - ウイルスベクター
細胞への遺伝子導入を目的に、ウイルスが持つ細胞への感染性を利用し、病原性に関する遺伝子に代わり外来の目的遺伝子を組み込んだもの。遺伝子治療にも応用されている。 - 線条体
脳深部にある領域で、運動機能や意思決定などに関与することが知られている。 - 吻内側尾状核
線条体の一部の領域。期待する報酬の大きさに応じて活動を変化させる神経細胞が存在することが知られている。
論文について
タイトル:
PET imaging-guided chemogenetic silencing reveals a critical role of primate rostromedial caudate in reward evaluation
著者:
Yuji Nagai1, Erika Kikuchi1, Walter Lerchner2, Ken-ichi Inoue3, Bin Ji1, Mark Eldridge2, Hiroyuki Kaneko1, Yasuyuki Kimura1, Arata Oh-Nishi1, Yukiko Hori1, Yoko Kato1, Toshiyuki Hirabayashi1, Atsushi Fujimoto1, Katsushi Kumata1, Ming-Rong Zhang1, Ichio Aoki1, Tetsuya Suhara1, Makoto Higuchi1, Masahiko Takada3, Barry Richmond2, and Takafumi Minamimoto1*
所属:
- 国立研究開発法人 量子科学技術研究開発機構 放射線医学総合研究所
- 米国国立精神衛生研究所
- 国立大学法人 京都大学 霊長類研究所
雑誌名:
Nature Communications
