発表のポイント
- 大腸がんのモデルマウスでカロリー制限が被ばくによる消化管腫瘍を予防する効果があることを明らかにした。
- 成人期からのカロリー制限開始でも小児期被ばくによる腫瘍の悪性化を効果的に抑制することを実証した。
- ヒトのがん予防と密接に関係している食習慣の改善は、被ばくによる発がんリスクを抑制する可能性が示唆された。
国立研究開発法人量子科学技術研究開発機構(理事長 平野俊夫。以下「量研」という。)量子医学・医療部門放射線医学総合研究所放射線影響研究部の森岡孝満研究統括と柿沼志津子部長らは、ヒト家族性大腸腺腫症のモデルマウスで、カロリー制限が小児期被ばく後の消化管腫瘍が大きくなることを抑え、悪性化を予防する可能性を明らかにしました。
有事の際の避難生活では、生活習慣病の増加が問題となっています。量研は、東日本大震災直後より福島の復興を目指した取り組みを開始しています。その1つとして、放射線による健康影響への不安に応える研究も進めています。これまでにカロリー制限が被ばくしたマウスの寿命を延長したり、肝がんや肺がんを予防したりする効果を明らかにし報告してきました。
大腸がんは、生活習慣病と密に関係していることが言われています。そこで、今回は、大腸がんのモデルマウスを用いて、カロリー制限が被ばく後の消化管腫瘍を予防する効果があるかを調べました。
生後2週齢(小児期)の大腸がんのモデルマウスに放射線を照射した後、4週齢(小児期)、10週齢(若成人期)及び20週齢(成人期)からカロリー制限を開始した群に発生した腫瘍の数、大きさ及び悪性度を調査しました。本研究では、カロリー制限による腫瘍抑制効果に関する先行研究と同様に、発達期の成長阻害などの影響が無い32%の制限としました。
その結果、カロリー制限の開始時期が早いほど5mm以上の大きな腫瘍の数が有意に抑制され、悪性腫瘍の割合が減少することを明らかにしました。また、成人期からのカロリー制限でも有効であることも明らかにしました。さらに、カロリー制限は、血液中の中性脂肪の増加も抑えていたことより、腫瘍の悪性化の予防効果との関連性が考えられました。
本研究で明らかになったカロリー制限したマウスでの放射線誘発腫瘍に対する予防効果は、人が食習慣を改善することで被ばく後の発がんリスクを抑制することが期待できます。今後、遺伝子解析を行い、カロリー制限による大腸がんの予防効果と血液中の中性脂肪との関連性を明らかにし、予防効果の仕組みを明確にしていく予定です。
本研究は、がん予防・治療の研究分野の論文が数多く発表されているInternational Institute of Anticancer Researchの機関誌である「Anticancer Research」にオンライン掲載(2021年3月4日(木)付)されました。また、文部科学省科学研究費補助金JP26350955の援助を一部受けています。
研究開発の背景と目的
福島県では、震災後に「第二次健康ふくしま21計画」を掲げ、生活習慣病の改善によるがん予防に加え、東日本大震災及び原子力災害の影響に配慮した健康づくりを推進しています。この計画策定から5年後(2018年度)に行われた中間評価では、「脂質異常」、「メタボリックシンドローム該当者及び予備軍」、「適正体重を維持している者の割合」等に関連する指標が悪化傾向にある結果となっています(第二次健康ふくしま21計画<改訂版>2019年5月より)。脂質異常やメタボリックシンドロームは肥満と関係すると言われるだけでなく、大腸がんのリスクを上昇させると言われています。量研は、福島県民の健康への不安解消の対策の一環として、実験動物を用いて放射線による健康影響の研究や生活習慣改善による健康影響の予防研究を進めています。
研究チームはこれまでに、実験動物であるマウスを用いて、被ばくに起因する寿命短縮、肝がんや肺がんの発生をカロリー制限が予防することを明らかにし報告してきました。しかしながら、生活習慣病と密接に関係する大腸がんに対する予防効果は、わかっていませんでした。
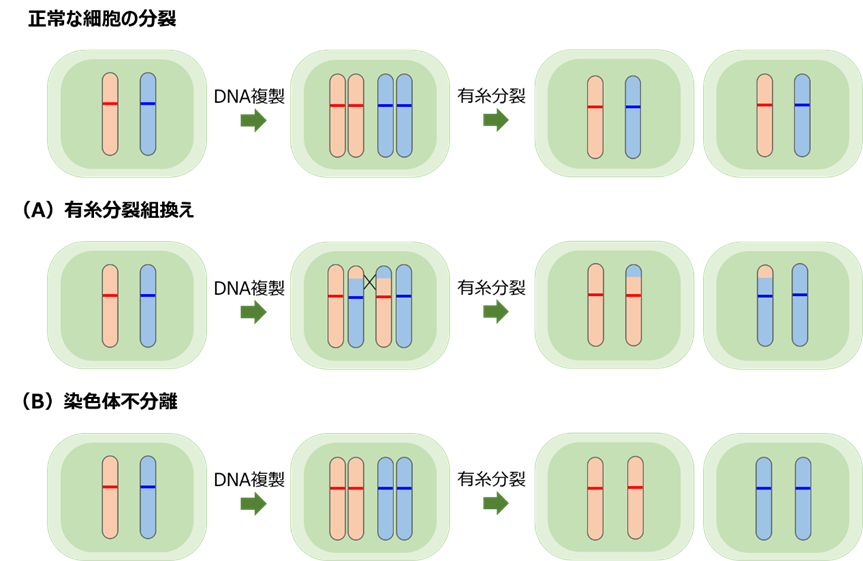
大腸がんのモデルマウスとして知られるMinマウス1)は、もともとがんの抑制遺伝子であるApc2)と呼ばれる遺伝子の一対の遺伝子のうち一方に変異3)が生じており、さらに残り(正常側)の遺伝子が有糸分裂組換えや染色体不分離4)を始めとする変異により機能を失うことによって消化管腫瘍を自然発症します(図1)。今回、研究チームは、このMinマウスを用いて生後2週齢(小児期)に放射線を被ばくした場合の消化管腫瘍の発生数を調べ、非照射マウスより腫瘍の数とサイズが増加することも明らかにしました(図2)。
このような特徴を持つMinマウスを用いて、小児期(2週齢)に放射線を照射し、カロリー制限の開始時期(小児期、若成人期、成人期)の異なるマウスに発生したそれぞれの消化管腫瘍について、腫瘍数、サイズ分布及び悪性度の解析を行い、カロリー制限のがん予防効果を調査しました。
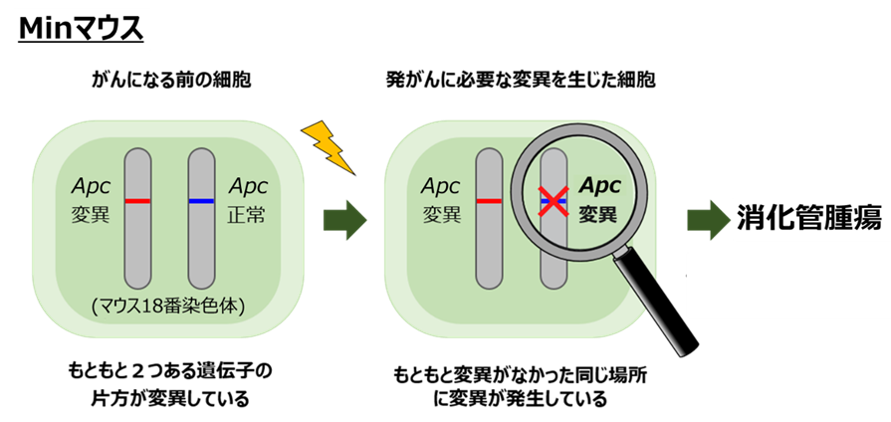
図1 Minマウスに消化管腫瘍が発生する仕組み
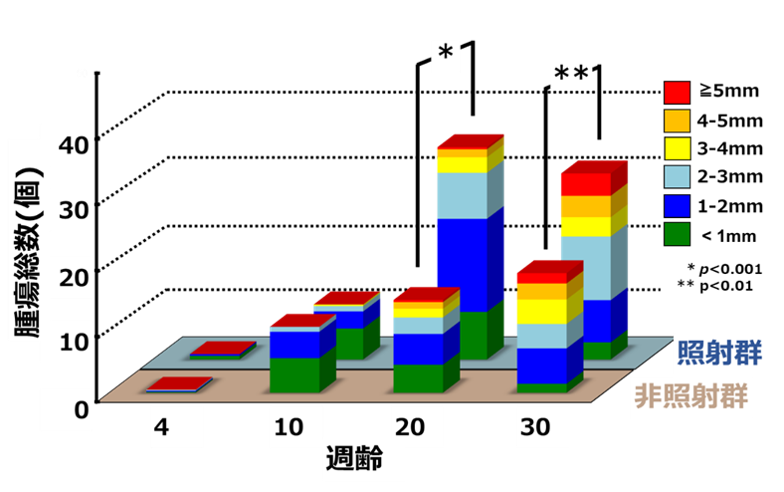
図2 非照射群と照射群における腫瘍の数とサイズの経時的変化
照射群は20週齢および30週齢になると、非照射群に比べて有意に腫瘍総数が増加しました。また、大きいサイズの腫瘍も増加することが分かりました。
研究の手法と成果
研究チームは、小児期に被ばくすると腫瘍数が増加するMinマウスを用いて、非照射群と生後2週齢時に放射線(エックス線、2 Gy)を照射し、カロリー制限しない群、4週齢、10週齢及び20週齢からカロリー制限(図3)を開始した群に発生した腫瘍の総数、大きさ及び悪性度の解析を行いました。実験では、被ばくの影響を見やすくするために、高線量(2 Gy)の放射線を使用しました。また、カロリー制限は量研が以前に行った先行研究と同様に、発達期の成長阻害などの影響が無いと結論づけた32%としました。
実体顕微鏡を用いて腫瘍サイズを計測した結果、カロリー制限により5mm以上の大きいサイズの腫瘍数が有意に減少することが分かりました(図4)。また、成人期からの開始したカロリー制限でも効果的であることが明らかになりました。また、大腸がんに進行することもある良性腫瘍の発生に関係が知られている血液中の中性脂肪を測定した結果、カロリー制限により有意に減少することも明らかにしました。
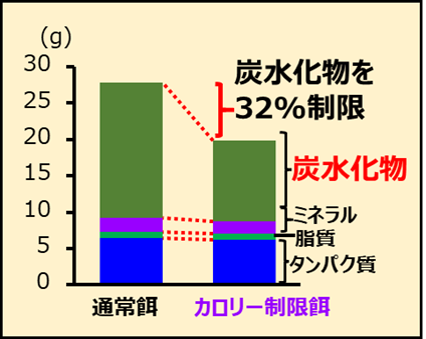
図3 通常餌とカロリー制限餌の成分表
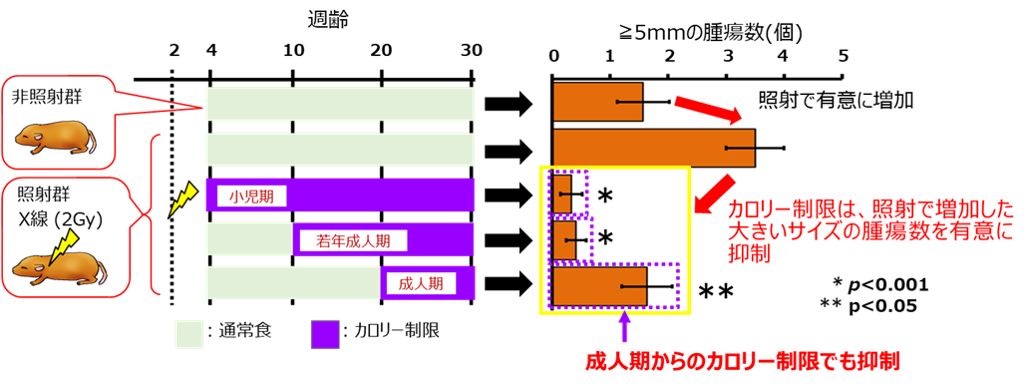
図4 カロリー制限による5mm以上の腫瘍数の抑制効果
さらに、研究チームは、腫瘍の病理組織解析により、血管、リンパ管などのまわりの組織への浸潤などを指標として、悪性度の評価を行いました。その結果、カロリー制限は照射によって増加する悪性腫瘍の割合を抑えることが分かり(図5)、成人期からのカロリー制限でも悪性腫瘍の割合を抑える傾向がみられました。また、カロリー制限は、良性腫瘍が悪性腫瘍への進展を抑制することも分かりました。このように、カロリー制限は、高線量の被ばくによる影響にも予防効果があることが明らかになりました。
これらのことから、カロリー制限は血液中の中性脂肪の増加を抑えることで腫瘍の悪性化を予防する可能性が考えられました。
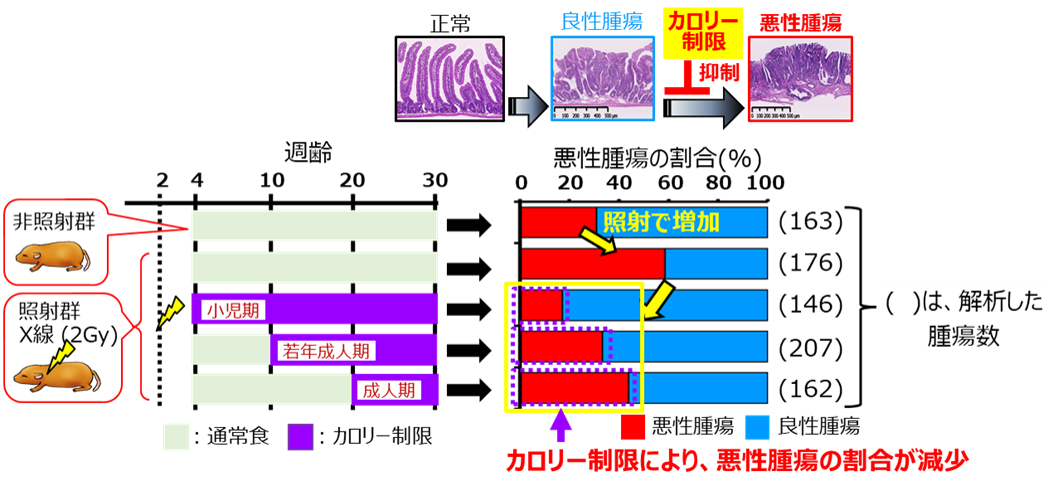
図5 カロリー制限による腫瘍進展抑制効果
今後の展開
本研究により、カロリー制限の放射線誘発消化管腫瘍に対する予防効果がマウスで明らかとなりました。東京電力福島第一原子力発電所事故では、被ばくの線量が少なかったため発がんリスクの問題はないと言われていますが、健康影響に対する不安をお持ちの方もいることと思います。本成果は、放射線災害による被ばくや、放射線を利用した検査・診断・治療による医療被ばく後に懸念されている発がんに対する不安に応え、予防法の開発に繋がるものと期待されます。
研究チームでは、カロリー制限と同様の効果を有する摸倣剤や一般的な飼育環境よりも活発に運動できる環境で飼育することによる被ばく後の発がんリスクの低減化効果についても解析を行っています。今後は、さらに解析を進め、被ばくに関連する発がんを含む健康影響の予防効果の仕組みを明らかにしていきたいと考えます。
将来的にはより簡便ながん予防法の開発に繋がっていくものと考えています。
用語解説
1)Min(Multiple intestinal neoplasia)マウス
家族性大腸腺腫症のモデルマウスで、消化管(小腸)に腫瘍が自然に発生します。Apc遺伝子の1対の遺伝子のうち一方に変異が生じており、さらに残り(正常側)の遺伝子が機能を失うことによって消化管腫瘍を発生します。
2)Apc(adenomatous polyposis coli)
がんの発生を抑制する機能を持つ遺伝子のひとつ。ヒト大腸がんの遺伝性腫瘍のひとつである家族性大腸腺腫症の原因遺伝子です。
3) 変異
遺伝子の情報が変化すること。たとえばDNAの塩基の1個が他の塩基に置き換わることや、塩基の間違った挿入や欠失といった変化があります。
4)有糸分裂組換えと染色体不分離
有糸分裂組換えは、細胞が分裂する過程で、染色体間で交差が起り、染色体上の遺伝子の組合せが組換えられる現象のことです(下図A)。また、染色体不分離は、染色体が正常に分離せず細胞に分配される現象のことです(下図B)。
掲載論文
Takamitsu Morioka, Shunsuke Yamazaki, Hiromi Yanagihara, Masaaki Sunaoshi, Mutsumi Kaminishi, Shizuko Kakinuma. Calorie Restriction Suppresses the Progression of Radiation-Induced Intestinal Tumours in C3B6F1 ApcMin/+ Mice. Anticancer Research, March 2021, 41 (3) 1365-1375; DOI: https://doi.org/10.21873/anticanres.14894
