【発表のポイント】
- マウスiPS細胞や核移植ES細胞にES細胞の約6倍のマイクロサテライト変異を確認。
- ヒト臍帯血赤芽球由来iPS細胞は、種々の方法で樹立した線維芽細胞由来iPS細胞の約1/3のマイクロサテライト変異しか持っていなかった。
- 変異が起こりやすいマイクロサテライト領域(ホットスポット)を同定した。
- 本成果はiPS細胞から分化させた細胞の機能低下、造腫瘍性などの原因になり得るiPS細胞の変異をゲノム解析により得たもので、iPS細胞の再生医療への応用に重要な知見を提供するものである。
国立研究開発法人量子科学技術研究開発機構(理事長 平野俊夫)量子生命・医学部門量子生命科学研究所幹細胞研究グループの上村悟氏主任研究員、菅智技術員、荒木良子グループリーダー、および同部門の安倍真澄上席研究員らの研究チームは、iPS細胞1)におけるマイクロサテライト(MS)2)変異に関する確度の高い情報を得ることに成功しました。
iPS細胞のゲノムには、数百から1千カ所もの点突然変異3)や、その他にも挿入や欠失が見つかることが知られています。しかしながら、MSと呼ばれる単純繰り返し配列領域の異常については、疾患との関連などその重要性が認識されているものの、配列情報解析の困難さからiPS細胞に関してはこれまでほとんど正確には議論されてきませんでした。
研究チームは、MS領域の解析において曖昧さを排除するために、解析に理想的なマウス細胞セットを構築し、さらに得られた変異候補を実験的に確認することでMS変異に関する確度の高い情報を得ることに成功しました。同一の体細胞集団から複数の姉妹多能性幹細胞株をiPS法と核移植(nt)法にて樹立し、それらを相互比較に用いることにより、反復配列解析を困難にしている偽の変異候補の効率的排除に成功しました。またヒトに関しても同様に同一体細胞から樹立した複数の姉妹細胞株を解析対象に用いました。これらの全ゲノム配列を決定し、さまざまなプログラムを組み合わせた情報解析によって得られた変異候補に対し、大規模かつ高感度な検証実験を行いました。その結果、iPS細胞は、ES細胞4)より約6倍MS変異が多いこと、また、以前我々が樹立したヒト臍帯血赤芽球由来iPS細胞(P5 参考文献参照)では、皮膚線維芽細胞から樹立されたiPS細胞の1/3程度にMS変異が抑えられていることを明らかにしました。この結果により、ヒト臍帯血赤芽球由来iPS細胞は、点突然変異に加え、反復配列を含む領域の挿入や欠失も少ないことがわかりました。また、マウスおよびヒトiPS細胞でMS変異が起こりやすいゲノム部位(ホットスポット)も同定されました。
再生医療に用いるiPS細胞の変異は、iPS細胞から分化させた細胞の機能低下、免疫原性、そして造腫瘍性の原因となり得るため、ゲノム解析を行うことは重要です。また、変異の種類、そしてその原因は1種類ではありません。今回得られた成果は、iPS細胞の再生医療研究への展開において、iPS細胞の変異の全体像、そして変異が生じる原因の理解に重要な情報を提供します。
この成果は、「Stem Cell Reports」にて2021年9月24日(金)0:00(日本時間)にオンライン掲載されました。なお、本研究の一部は、JSPS科研費(17H03615, 17K20053 and 20K15707)、武田科学振興財団、上原生命科学財団、三菱財団自然科学研究の助成を受けました。
【研究開発の背景と目的】
iPS細胞を目的の細胞に分化させ病気の原因の解明や創薬、そして再生医療に利用する研究が進められています。iPS細胞ゲノムに存在する変異は、その使用目的によっては重大な問題となり得るため、研究が必要です。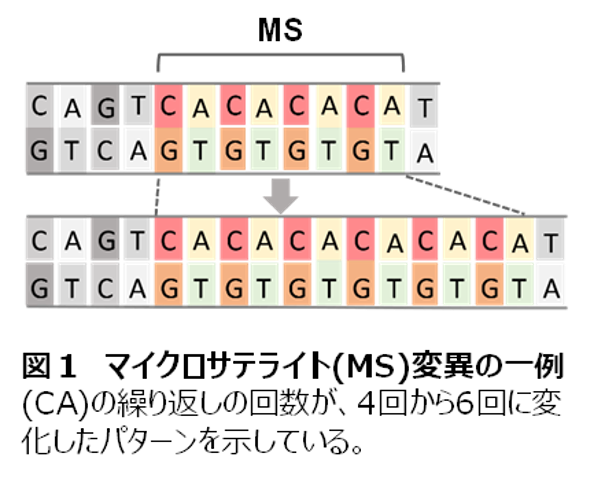
我々はiPS細胞ゲノム解析において、これまで主に点突然変異について明らかにしてきましたが、その際、マイクロサテライト(MS)と呼ばれる1から数塩基程度の単純反復配列領域(図1)は、解析対象領域から外していました(他の研究グループも同様です)。解析における技術的な問題で、偽の変異候補が出やすい領域のためです。ゲノムの塩基配列は、長いゲノムをランダムに500bp程度の長さに断片化し、その断片の両端の100~150塩基の配列を読み取りコンピュータ上でつなぎ合わせることで決定します。その際、各配列がゲノム配列のどこに位置するか、配列の一致率で決めていきますが、ゲノム上に膨大な数の繰り返し配列が散在しているため、繰り返し配列を含む断片はゲノム上の位置の特定が困難になります。特に30億塩基対にも達する全ゲノムを対象にした場合、解析の決定的な障害になってしまいます(マッピングエラー)。さらに首尾よくゲノム上の位置が特定されたとしても、繰り返し配列の場合並べる際に配列単位でのずれが生じ(アラインメントエラー)、偽の変異候補が多数検出されてしまいます。
その一方で、MS領域は疾患とも深い関係があるだけでなく、生命現象を議論する上で無視できない領域であることが明らかになりつつあります。トリプレットリピート病5)と呼ばれる遺伝性の神経・筋疾患が知られているほか、発がんへの関与が示唆されているMS不安定性という特徴は、ある種の修復酵素が機能していないことを意味する指標として使われています。さらに最近では、タンパク質を作る情報を持たないnon-coding RNA6)の発現制御に関わることも報告されています。そこで今回、MS領域に注目し、iPS細胞の変異解析を行いました。
【研究の手法と成果】
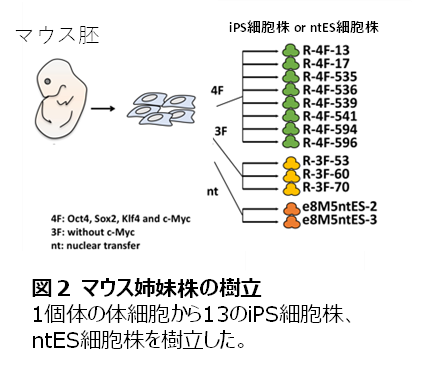 まず、MS領域の解析から曖昧さを排除するために解析に理想的な細胞セットとして、マウス1個体の体細胞から11株のiPS細胞および2株の核移植(nt)ES細胞7)を樹立しました(図2)。これらを用いて初めにMS領域以外の1~75塩基程度の挿入や欠失変異の同定を試み、解析条件をチューニングしました。これによりMS領域以外で、iPS細胞およびntES細胞は、ES細胞に比べ、約6倍変異が多いことが明らかになりました(この変異の差、約6倍は後述するMSで見られた差と同等でした)(図3)。また、これらは複数の手法で確認できました。
まず、MS領域の解析から曖昧さを排除するために解析に理想的な細胞セットとして、マウス1個体の体細胞から11株のiPS細胞および2株の核移植(nt)ES細胞7)を樹立しました(図2)。これらを用いて初めにMS領域以外の1~75塩基程度の挿入や欠失変異の同定を試み、解析条件をチューニングしました。これによりMS領域以外で、iPS細胞およびntES細胞は、ES細胞に比べ、約6倍変異が多いことが明らかになりました(この変異の差、約6倍は後述するMSで見られた差と同等でした)(図3)。また、これらは複数の手法で確認できました。
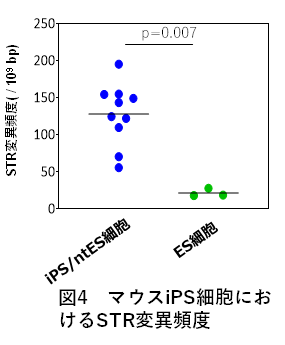
 次に、MS領域のショートタンデムリピート(STR)と呼ばれる2~6塩基程度の繰り返し配列の変異解析を試みました。MS領域の情報解析では、どうしてもエラーが多く出現します。そのため、プログラムで検出された候補全体の20%強にあたる約1千箇所について、姉妹株の配列を目視にて詳細に相互比較し我々の情報解析の能力を検証しました。結果、約13%が偽の変異、正解率は87%であることが判りました。また目視確認で正しいと判定した領域は、複数の手法によりその判定が正しいことが実験的にも証明できました。我々のMS解析結果は、iPS細胞、ntES細胞はES細胞に比べて、約6倍変異が多いことを示していました(図4)。
次に、MS領域のショートタンデムリピート(STR)と呼ばれる2~6塩基程度の繰り返し配列の変異解析を試みました。MS領域の情報解析では、どうしてもエラーが多く出現します。そのため、プログラムで検出された候補全体の20%強にあたる約1千箇所について、姉妹株の配列を目視にて詳細に相互比較し我々の情報解析の能力を検証しました。結果、約13%が偽の変異、正解率は87%であることが判りました。また目視確認で正しいと判定した領域は、複数の手法によりその判定が正しいことが実験的にも証明できました。我々のMS解析結果は、iPS細胞、ntES細胞はES細胞に比べて、約6倍変異が多いことを示していました(図4)。
 次に、ヒトのMS領域の変異解析に挑みました。ヒトMS解析は相同染色体間に基本的な違いがない実験マウスのMS解析よりはるかに困難です。
次に、ヒトのMS領域の変異解析に挑みました。ヒトMS解析は相同染色体間に基本的な違いがない実験マウスのMS解析よりはるかに困難です。
ヒトでは、1対ある染色体間の違いは塩基対レベルで見た場合膨大です。純系の実験用マウスに用いた手法ではエラーが多過ぎて、解析はできませんでした。そこで、HipSTRと呼ばれるプログラムを用いました。これは、MS解析に特化した解析プログラムとして最近開発されたものです。このプログラムで得られたMS変異の候補について、正しく検出されていることが実験的にも確認されました。
 この方法を用いて、20の線維芽細胞由来iPS細胞と14の臍帯血赤芽球由来iPS細胞を比較したところ、臍帯血赤芽球由来iPS細胞のMS変異は線維芽細胞由来iPS細胞の3分の1程度に抑えられていることがわかりました(図5)。
この方法を用いて、20の線維芽細胞由来iPS細胞と14の臍帯血赤芽球由来iPS細胞を比較したところ、臍帯血赤芽球由来iPS細胞のMS変異は線維芽細胞由来iPS細胞の3分の1程度に抑えられていることがわかりました(図5)。
加えて、複数の細胞株で共通してみられるMS領域におけるホットスポットも多数同定されました(マウスSTRで18カ所、ヒトSTRで13箇所、同一塩基の連続領域で113箇所)。
【今後の展開】
再生医学の観点から重要なヒトiPS細胞において、臍帯血赤芽球由来iPS細胞では、以前我々が報告した点突然変異に加えMS領域についても変異が少ないことが明らかになりました。今後、この理由を明らかにすることで、変異の少ないiPS細胞樹立を通して、再生医療分野における安全性向上に貢献します。また今回HipSTRアルゴリズムと姉妹細胞株を用いることでiPS細胞におけるMS変異の解析を達成しその傾向の把握に成功しましたが、ゲノムには未だ見逃されている反復配列領域が沢山存在します。その中には長すぎて現在の全ゲノムシーケンシング能力ではカバーできない領域も含まれます。そしてそのような領域には、疾患と関連した反復配列領域が含まれています。今後は長さも含め解析の網羅率を高め、医学利用に用いる際のゲノム評価をより確実なものにできるよう研究をより進めていき、iPS細胞の再生医療分野への応用に重要な知見を提供していきます。
【参考文献】
Araki, R., Hoki, Y., Suga, T., Obara, C., Sunayama, M., Imadome, K., Fujita, M., Kamimura, S., Nakamura, M., Wakayama, S.and Abe M. (2020). Genetic aberrations in iPSCs are introduced by a transient G1/S cell cycle checkpoint deficiency. Nat Commun 11, 197.
【用語解説】
1)iPS細胞(人工多能性幹細胞)
皮膚等の既に分化した細胞に数種類の遺伝子を導入することなどによって分化多能性(さまざまな細胞に分化する能力)と自己複製能力を持つよう誘導した細胞のこと。なお、幹細胞とは、自分自身を増やす自己複製能力と、ほかの細胞に分化(成長)する能力を持つ、ほかの細胞の元となる特別な細胞のこと。iPS細胞は、再生医療への応用や薬剤開発等への利用が期待されています。
2)マイクロサテライト(MS)
1~数塩基を単位とする反復配列。同一塩基の連続の場合、および、反復の単位が2塩基以上を指す場合もありますが、ここでは2~6塩基程度の反復配列をショートタンデムリピート(STR)と呼んでいます。
MS領域は、ゲノムDNAの複製時に、反復回数が異なるエラーを生じやすいことが特徴です。このことが、MS領域に個人差が大きい原因となっています。
MS領域はゲノム解析が技術的に困難です。その理由は、ゲノムDNAの読み取りの際、DNAの複製時にエラーが生じる上に、また、読み取った塩基配列の情報処理の際に、酷似した配列が多いために、偽の結果を導き出すことがあるためです。
3)点突然変異
1塩基が他の塩基に置換するような変異。
4) ES細胞
受精卵から発生した3.5日胚を培養して得られる多能性幹細胞。
5)トリプレットリピート病
3塩基の繰り返し配列(例えば、CAGCAGCAG・・・・)が異常に伸長することで発症する神経疾患で、親から子孫に疾患遺伝子が伝達される過程でリピートが変動します。リピート数が増えるほど発症年齢が早くなり、症状も重篤になるとされています。
6) non-coding RNA
DNAから転写されるRNAのうち、タンパク質をコードしないRNA。3万近く同定されており、多くは機能不明ですが、個体発生やがん化などへの関与も知られてきています。
7) 核移植(nt)ES細胞
クローン技術によって体細胞の核を卵子の核と置換し発生させ、ES細胞と同様3.5日胚を培養して作製する多能性幹細胞。体細胞を元にして初期胚をつくるという点で、iPS細胞と共通点があります。
【論文について】
雑誌名:Stem Cell Reports
論文タイトル:
Insertion/deletion and microsatellite alteration profiles in induced pluripotent stem cells
著者:
Satoshi Kamimura1,Tomo Suga1, Yuko Hoki, Misato Sunayama, Kaori Imadome, Mayumi Fujita, Miki Nakamura, Ryoko Araki2 and Masumi Abe2(1:筆頭著者、2:責任著者)
