発表のポイント
- 生体脳で神経細胞に脳内レポーター1)と呼ばれる目印タンパク質を発現させて、このタンパク質に結合するイメージング剤を静脈注射することで、脳内の神経回路の活動異常をポジトロン断層撮像法(PET)2)で画像化する技術を世界に先駆けて開発。
- 脳内レポーターを認知症の病因タンパク質とつなぎ合わせることで、病因タンパク質が脳内に異常蓄積する最初期の過程を可視化することに成功。
- これらの技術を活用すれば、認知症における病因タンパク質の蓄積や、それに伴う神経回路の活動異常を正確にキャッチ可能となり、病態解明や治療薬の評価につながると期待される。
国立研究開発法人量子科学技術研究開発機構(理事長 平野俊夫。以下「量研」という。)量子生命・医学部門量子医科学研究所脳機能イメージング研究部(樋口 真人 部長兼グループリーダー、下條雅文 主任研究員)、米国スクリプス研究所、慶應義塾大学医学部内科学教室(神経)は、神経回路の活動異常を正確に捉えることに加え、認知症病因物質蓄積の最初期を、生きている動物の脳において画像化できる革新的な技術を開発しました。
動物の脳機能は、神経細胞が複雑に配線された回路において情報が適切に処理されることにより成り立っています。また、多くのヒト精神・神経疾患で観察される認知機能の低下は、特定の回路における発達異常や機能障害が主要な原因となっていることが指摘されています。例えば、代表的な認知症であるアルツハイマー病では、病因物質の一つと考えられるタウタンパク質が疾患の初期から互いにくっつき合って記憶を司る海馬に蓄積し、海馬につながる回路が活動異常をきたして脳機能が破綻することが指摘されています。しかしながら、こうした神経回路の構造や活動を画像化したり、病因タンパク質の蓄積の最初期を動物脳に傷をつけずに可視化したりすることは技術的に難しく、現在に至るまで実現していませんでした。
そこで本研究では、「脳内レポーター」と呼ばれる動物の生体には存在しない目印を特定の回路を構成する細胞に導入し、この脳内レポーターに対して選択的に結合するイメージング剤を静脈注射することで、回路の活動状態をポジトロン断層撮像法(PET)により画像化する技術を世界に先駆けて開発しました。また、脳内レポーターを2つのパーツに分け、それぞれのパーツをタウタンパク質につなげて脳内に発現させることで、タウタンパク質がくっつき合った時のみ脳内レポーターのパーツもつながって完成形になり、PETで画像化できるように工夫を凝らしました。この工夫によって、これまでは検出することが非常に難しかったタウタンパク質蓄積の最初期を高感度に可視化することにも成功しました。
本技術は上記のように、疾患モデル動物脳における回路のつながりや活動の異常を正確に検知し、脳に障害をもたらす病因タンパク質の蓄積をいち早く検出するなど、病態のさまざまな段階を捉えるツールとなりえます。認知症モデル動物のみならず、脳発達障害モデル動物で見られるような回路形成不全の可視化にも利用可能です。さらに治療薬が回路異常を修復する効果や、異常タンパク蓄積を抑制する効果の評価にも応用が見込まれ、脳疾患の治療法開発に役立つことが期待されます。
本研究は、JST戦略的創造研究推進事業 CREST「記憶構造を解明する新しい光操作・画像法の開発」(JPMJCR1652)、日本医療研究開発機構(AMED)「革新的技術による脳機能ネットワークの全容解明プロジェクト」(JP19dm0207072)、日本医療研究開発機構(AMED)「脳科学研究戦略推進プログラム」(JP19dm0107146)、MEXT/JSPS科研費(18H04752 18K07777)における成果を一部活用したもので、「EMBO Journal」(Impact Factor 11.598)のオンライン版に2021年10月12日(火)19:00(日本時間)に掲載されました。
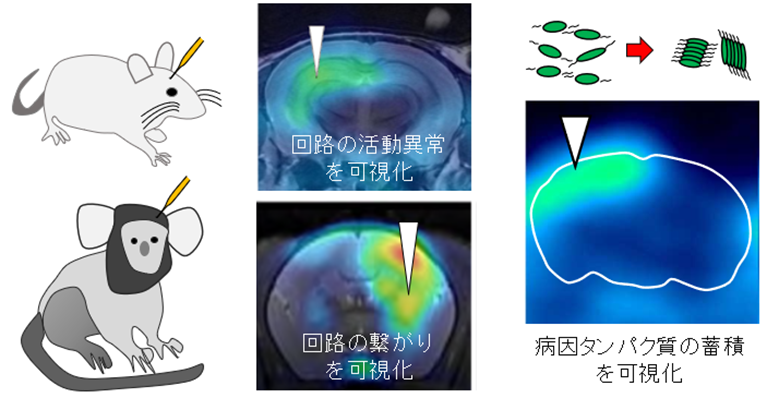
図1:脳深部の回路に導入された脳内レポーターを目印に回路の繋がりや活動異常、病因タンパク質の蓄積の最初期を生体イメージング
研究開発の背景と目的
ヒトの認知機能は、神経細胞により配線された特定の回路に情報が入力され適切に処理されることで成立しており、多くの神経疾患ではこうした回路に機能不全が生じることで様々な臨床症状を呈することが知られています。例えば、アルツハイマー病の場合には、異常な構造を持つ病因タンパク質が記憶に関わる回路に蓄積し機能不全を引き起こすことで、新しい記憶を作ることができなくなり記憶障害を呈することが指摘されています。
こうした神経難病の診断法や治療薬剤を開発する上で、回路障害の全容を明らかにすることは重要です。このため、生きている動物脳において回路の形や状態を客観的に画像として把握できるようにし、さらには、治療薬などの介入による症状の変化を、着目する回路の状態と対応付けながら正確に評価する必要があります。しかしながら、脳組織の深い場所に位置する回路の構造のみならず、その活動状態や病因タンパク質の蓄積を動物の生体脳で可視化し、それらの画像情報を得ることは技術的に難しく、現在に至るまで実現されていませんでした。
本研究では、生体には通常存在しない「脳内レポーター」を脳組織の中で狙った回路にだけ目印として導入し、この脳内レポーターに結合してシグナルを発するイメージング薬剤を用いて、回路の構造や活動状態をポジトロン断層撮像法(PET)で画像化する新しい技術開発に取り組みました。さらに、この技術を活用して、これまで実現することが不可能であった回路障害の原因となるタンパク質の代謝異常などを見ることができるかどうかも評価しました。
研究の手法と成果
1.回路に導入した脳内レポーターに結合する薬剤で回路の活動を画像化に成功
ウイルスベクター3)を用い、狙った回路の神経細胞に脳内レポーター遺伝子を導入すると、その細胞内で脳内レポーターが発現し回路を伝って神経細胞の末端まで広がっていきます。脳内レポーターに結合してシグナルを発するイメージング薬剤を投与すると、導入した細胞と末端に発現した脳内レポーターが可視化されるので回路を画像化できます。
研究グループは、脳内レポーターに結合する化合物に蛍光物質を組み合わせた蛍光イメージング薬剤と、放射性同位体を組み合わせたPET薬剤を開発しました。蛍光イメージング薬剤を用いれば二光子顕微鏡4)で脳細胞を一細胞レベルの解像度で、PET薬剤を用いればPET撮像により脳を領域レベルの解像度で見ることができます。
そこでマウスの大脳皮質と呼ばれる脳表面の領域に存在する神経細胞に脳内レポーターを発現させ、開発した2種類のイメージング薬剤を用いて、これら細胞から脳内に広がる回路構造を実際に画像として描出できるか確認しました。その結果、頭蓋骨にガラス窓を付けて脳内を見えるように処置して、二光子顕微鏡による観察をしながら蛍光イメージング薬剤を投与したところ、脳内レポーターの目印が付いた脳表層にある細胞群を蛍光で個別に光らせ、ガラス窓から見える範囲内を可視化できることが確認されました(図2左a)。そこで次に、放射性薬剤を投与してPET撮像を行ったところ、目印が付いた細胞群で構成される回路の全体を可視化できることが確認されました(図2左b)。これにより、2種類のイメージング薬剤を使い分ければ、脳内レポーターが発現している細胞が配線した回路であるという確実な裏付けを得ながら、回路全体をPETで可視化できるようになりました。
そこで次に、開発したイメージング薬剤で回路の活動状態を可視化できるか調べました。マウス脳組織の深くに位置する海馬と呼ばれる脳領域に対して、神経細胞が活動した際にだけ脳内レポーターが発現するように細工を施したウイルスベクターで脳内レポーター遺伝子を神経細胞へと導入し、薬剤を投与して回路を活性化させました。回路が活性化された後に脳内レポーターの合成が十分に誘導された状態で、PET薬剤を投与しPET撮像を行った結果、回路の活動状態が増加している様子が画像として描出されました。これらのことから、これまで実現不可能であった回路の活動状態をPETで画像評価することに成功しました。
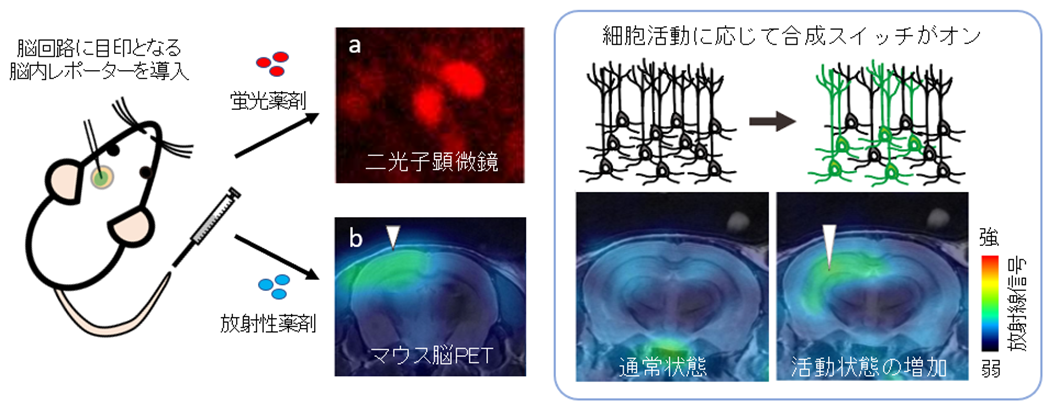
図2:脳内レポーターを神経細胞に発現させ蛍光と放射線で可視化
(左)蛍光と放射線を利用して神経細胞と回路全体を同じ動物脳で画像化
(右)細胞活動に応じて合成スイッチがオンとなる細工を施したウイルスベクターで脳内レポーター遺伝子を海馬の神経細胞に導入し、回路が活動する状態をPET画像化
2.霊長類の脳深部にある回路構造を超高感度で可視化し、領域間でのつながりを解明
マウスなどの小動物は扱いが容易で多くの基礎研究に用いられていますが、げっ歯類脳は霊長類脳と比較して小さく構造的に異なる点も多いことから、ヒトにより近いサルを用いた研究を行うことで非常に有益な情報が得られます。そこで、小型霊長類コモンマーモセットを用いて、大脳皮質と線条体と呼ばれる脳領域のそれぞれの神経細胞に脳内レポーター遺伝子を導入し、これらの領域から他の領域へと延びていく回路の3次元的な構造をPETにより画像描出できるかどうか調べました。
その結果、これらの大脳皮質から視床と呼ばれる脳領域へと延びていく経路(図3右のPET画像1と2、黄色の円)、そして線条体から中脳と呼ばれる脳領域へと延びていく経路(図3のPET画像1と3、白い円)がそれぞれ明瞭に画像描出できることが明らかとなりました。また、同マーモセットから脳組織を摘出し、組織学的な方法で顕微鏡解析をしてみると、PET画像をよく裏付ける結果が得られました。これらのことは、今回開発された技術を使うと、ヒト脳の回路構造の理解にもつながる霊長類の回路を詳細に解析する強力なツールとなり得ることを示す結果といえます。
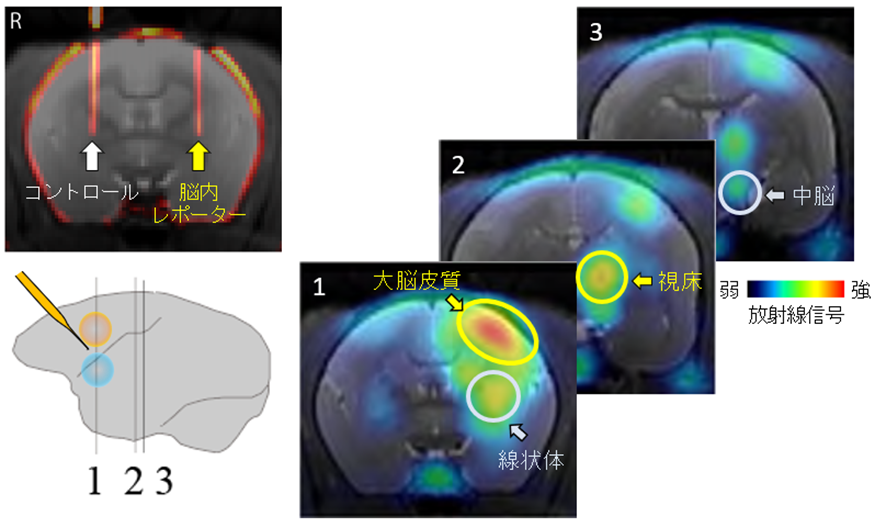
図3:霊長類脳で回路の構造を画像化
(左上)ウイルスベクターで脳内レポーターの遺伝子情報を片側大脳皮質(黄色円)と片側線条体(水色円)の神経細胞へと導入している様子。
(左下)脳内レポーターの導入領域とPET画像提示している脳スライスの概略図
(右) PETで画像描出された投射経路の画像
3.回路障害の原因となる病因タンパク質の蓄積の最初期の過程を画像検出
アルツハイマー病をはじめとする認知症を呈する多くの神経変性疾患では、タウタンパク質と呼ばれる凝集性のタンパク質が集合体を形成して毒性をもち、回路に沈着することで回路の機能不全を生じると考えられています。このタウは、通常は1個の状態で存在し細胞活動に必要な役割を果たしており、役目を終えると細胞内で速やかに分解され取り除かれることが知られています。しかしながら、加齢に伴い徐々に細胞機能が低下してくると、だんだんと神経毒性を持つ集合体を形成し取り除かれなくなってしまい、これらが回路に沈着してさまざまな障害を引き起こすことが知られています(図4上)。従って、タウが集合体を形成していく過程をなるべく早い段階で正確に検出し、集合体を解きほぐす薬剤などを用いて回路に沈着することを未然に防ぐような方法を見出すことができれば、将来的に疾患の早期診断や新しい治療薬剤の開発に繋がる重要な道筋が開けると考えられます。
そこで次に、今回開発した技術を応用してタウが集合体を形成していく過程をPETで画像化することが可能かどうか調べました。まず、脳内レポーターの遺伝子情報を分割(仮にAとBとする)し、遺伝子AとBそれぞれに、細胞内で集合化する性質を持つタウ遺伝子を連結させました。さらに、細胞内に導入後に発現した脳内レポーター断片AとBが近寄るとつながって完成形に戻り、脳内レポーターとしての機能を回復する細工も遺伝子AとBに施しました。イメージング薬剤は、発現した脳内レポーターAとBがそれぞれ断片の状態では結合できませんが、発現したタウが集合化することによりタウに連結した脳内レポーターの断片がつながって完成形に戻ると、再び結合できることを確認しました(図4左下)。
そこで、この細工をした遺伝子をマウス大脳皮質の神経細胞に導入しPET薬剤を用いてPET撮像した結果、タウが神経細胞内に沈着するより前の段階、すなわち回路内で集合体を形成していくタウ蓄積の最初期の過程を画像として捉えることができるようになりました(図4右下)。従って、一例ではありますがこの応用技術は、ヒト疾患脳の回路で認められる病因タンパク質の集合プロセスを再現しながらリアルタイムで可視化し、治療法開発などに活用できる強力なツールとなり得ることを意味していると言えます。
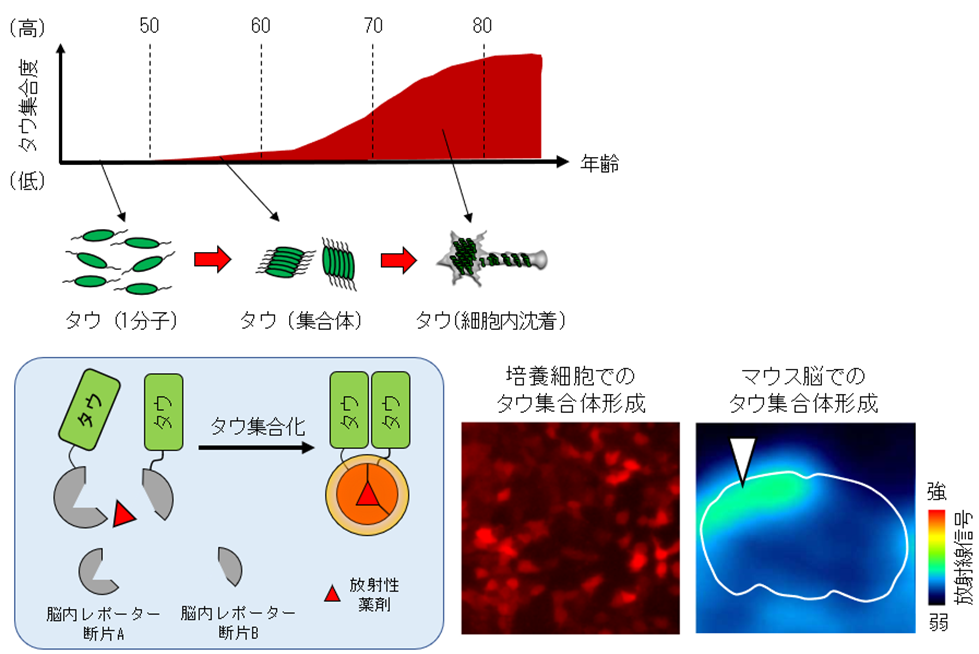
図4:回路におけるタウ集合体形成を放射光で早期検出
(上)アルツハイマー病で観察される加齢に伴ったタウ集合度のイメージ
(左下)タウが集合体を形成するプロセスを画像化するバイオセンサー分子の原理
(右下) 培養細胞(蛍光)とマウス脳(PET)でタウ集合体が形成される様子の画像
今後の展開
本研究の成果は、これまで難しかった生きているモデル動物脳で回路の繋がりや活動状態を画像情報として正確に捉えることを実現し、ヒト認知機能の理解と幅広い精神・神経疾患における回路障害の解明につながると共に、イメージングを基軸とした創薬研究を強力に推進する大きなブレイクスルーになることが期待されます。この技術は霊長類に適用可能なことも確認できたことから、ヒト認知機能の理解や精神・神経疾患における回路障害の解明につながります。アルツハイマー病をはじめとする多くの神経変性疾患では、認知機能が低下するかなり早期段階において回路機能に異常を生じていることが報告されています。また、原因が未だ明らかとなっていない自閉症スペクトラム障害や精神疾患などにおいても、発達期における回路の形成不全やその成熟化異常を原因としていることも指摘されています。従って、本研究で創出された技術を用いて、疾患モデル動物脳で観察される回路障害を正確に把握しながら治療介入による影響を評価することなどが可能となり、早期診断や新しい治療法開発に向けて大きな貢献ができることが想定されます。
蛍光イメージング分野などでは、緑色蛍光タンパク質に代表される有用な目印がこれまで数多く開発され世界中で脳研究に活用されています。今回開発された「脳内レポーター」を用いた技術は、量子イメージングの研究分野にこれまで存在しなかった汎用性の高い目印として活用できることが期待されており、今後改良を重ね創意工夫を凝らすことを通じて様々な脳機能を画像描出する無限の可能性を秘めた研究プラットフォームとなり得ることも大いに期待されます。
用語解説
1)脳内レポーター
哺乳動物の生体脳に存在しないecDHFR(E.coli dihydrofolate reductase)と呼ばれる無害の酵素分子を使って神経細胞に目印を付ける方法です。この酵素は、TMP(Trimethoprim)と呼ばれる化合物とのみ強力に結合する性質を持つことから、TMPに蛍光や放射線を発する物質をつなげた特定のイメージング薬剤を動物に投与することで、この酵素を発現させた特定の神経細胞で構成される回路を蛍光顕微鏡やPETで可視化することができます。
2)ポジトロン断層撮像法
ポジトロン核種(11C、13N、15O、18F等)で標識したイメージング薬剤を静脈より投与することで標的分子である酵素や受容体が存在する特定の体の部位に薬剤を集積させ、そこから放射される陽電子に起因するガンマ線を検出する事を通じて、標的分子の体内分布や局在を画像描出する方法です。
3)ウイルスベクター
ウイルスが持つ細胞への感染性を利用し、狙った細胞に脳内レポーターなど外来性の遺伝子情報を送達する方法です。ウイルス自体の病原性は無く、ヒト遺伝子治療などにも活用されています。
4)二光子顕微鏡
近赤外光を発振するフェムト秒パルスレーザーを利用することで、生体の深い位置にある蛍光分子を観察する事ができる特殊な蛍光顕微鏡です。
【論文について】
タイトル:A genetically targeted reporter for PET imaging of deep neuronal circuits in mammalian brains
著者:Masafumi Shimojo1,* , Maiko Ono1, Hiroyuki Takuwa1, Koki Mimura1, Yuji Nagai1,
Masayuki Fujinaga2, Tatsuya Kikuchi2, Maki Okada2, Chie Seki1, Masaki Tokunaga1, Jun Maeda1, Yuhei Takado1, Manami Takahashi1, Takeharu Minamihisamatsu1, Ming-Rong Zhang2,
Yutaka Tomita3, Norihiro Suzuki3, Anton Maximov4, Tetsuya Suhara1, Takafumi Minamimoto1, Naruhiko Sahara1 & Makoto Higuchi1,**
所属:
1 Department of Functional Brain Imaging Research, National Institutes for Quantum and Radiological Science and Technology, Chiba, Japan
2 Department of Radiopharmaceuticals Development, National Institutes for Quantum and Radiological Science and Technology, Chiba, Japan
3 Department of Neurology, Keio University School of Medicine, Tokyo, Japan
4 Department of Neuroscience, The Scripps Research Institute, La Jolla, CA, USA
掲載紙:EMBO Journal
DOI: https://doi.org/10.15252/embj.2021107757
