1. 発表のポイント
- がん関連酵素であるアミノペプチダーゼNの生体内活性を検出する高感度MRI分子プローブ(注1)の開発に世界で初めて成功しました。
- 開発した分子プローブを用いて生体内アミノペプチダーゼN活性の検出および腫瘍内マッピング(生体内酵素活性の可視化)に成功しました。
- 超核偏極MRIを用いた次世代分子イメージング・診断技術への応用が期待されます。
2.発表概要
東京大学大学院工学系研究科の齋藤雄太朗助教、谷田部浩行大学院生、斉藤圭亮准教授、石北央教授、山東信介教授、量子科学技術研究開発機構の高草木洋一主幹研究員、米国立衛生研究所の山本和俊上級研究員、ムラリ クリシュナ チェルクリ主任研究員らの研究グループは、生体深部におけるがん関連酵素アミノペプチダーゼNの活性を検出する超核偏極MRI分子プローブの開発に世界で初めて成功しました。
超核偏極は、MRI感度を劇的に向上させる量子操作技術(注2)であり、次世代診断技術への応用が期待されています。一方で、この技術を応用するために必要な分子プローブ開発には多くの課題が残されており、特に生体で機能する分子プローブの種類が少ないことや新しい分子プローブを設計する指針が存在しないことが大きな問題となっていました。
研究グループは、有機合成化学、計算化学、生化学、核磁気物理学、腫瘍学などさまざまな分野の知見を駆使し、分子を精密に設計することで新しい超核偏極MRI分子プローブを開発しました。また、開発した分子プローブをモデル動物へ適用し、生体内のアミノペプチダーゼNの活性検出や腫瘍内酵素活性の可視化に成功しました。
アミノペプチダーゼNは、がんの血管新生、転移、悪性度などと密接に関わっており、その活性を計測・可視化することで早期発見や治療効果の迅速な評価が可能になると期待されます。
本研究成果は2022年3月30日付で米国科学振興協会(AAAS)が出版する科学誌「Science Advances」オンライン版に掲載されました。
3.発表内容
核磁気共鳴イメージング(MRI)は、体を傷つけることなく体内を可視化できるため、医療現場で広く用いられている画像診断技術です。通常は生体内に豊富に存在している水や脂質を画像として取得し、臓器や異物の形や大きさを見て診断を行います。しかし、がん診断において腫瘍の形や大きさだけでは、腫瘍の性質や悪性度などを知ることはできません。そのため、診断や治療効果評価に長期間が必要となり、早期発見や治療効果の判断が困難になっています。MRIを用いて、腫瘍の形や大きさだけでなく、腫瘍の中の状態をリアルタイムで計測することができれば、生体を傷つけることなく早期診断や適切な治療が可能になります。
これを実現するためには、MRI感度の向上が必須です。MRIは原理上、さまざまな生体分子を検出することが可能ですが、その感度が極めて低いため、従来のMRIでは生体内に莫大な量が存在している水や脂質の信号を頼りに生体深部の断面を画像化していました。しかし、これだけでは生体分子の分布や代謝といった「腫瘍の中の状態」に関わる情報を十分に得ることができません。この問題を解決する次世代技術として動的核超偏極法(DNP法、注3)が注目されています。この技術は、特殊な機器を用いて分子のMRI感度を数千〜数万倍に向上させることができる量子操作技術です。DNP法を用いるMRI(DNP-MRI)では、体外で高感度化された分子プローブを素早く生体に投与してMRI計測を行うことで、生体内情報を取得することができます。がん診断においては、DNP-MRIによって腫瘍内の酵素活性を検出することで、腫瘍内部の状態を位置情報とともに知ることができます。しかし現状では、生体内で機能する実用的な分子プローブは極めて少なく、その開発が課題となっていました。
DNP-MRIで用いられる分子プローブを開発する最も一般的な戦略は、生体内にもともと存在するアミノ酸や糖などの分子を利用することです。例えば、エネルギー代謝において重要なピルビン酸は、がん細胞が通常細胞に比べてエネルギーや栄養素を多く必要とすることから、がん細胞内で活発に消費されます。これをDNP-MRIで検出するがん診断法が、米国で臨床試験段階にあります。一方で、分子プローブの生体内での反応性や毒性などの性質は、分子それぞれに固有であるため、偶然DNP-MRI分子プローブとして適した性質をもつものしか用いることができませんでした。実際に、DNP-MRIで臨床応用された分子プローブは、ピルビン酸にほぼ限定されています。ピルビン酸だけでは可視化できる情報が限られているため、ピルビン酸とは異なる現象を可視化できるポストピルビン酸の登場が待ち望まれていました。
もう一つの分子プローブ開発戦略として“分子設計”が挙げられます。すなわち、科学的な知見を活かして分子を設計することでDNP-MRIに適した分子プローブを人工的に開発する方法です。この戦略では、分子構造を自在に設計・改変できるため、計測したい現象や標的にしたい酵素に対し、分子の性質を意図して調整することができます。しかしながら、実際に分子設計によって生体内で機能するDNP-MRI分子プローブを開発することは極めて困難です。この原因は、確立された設計指針がないために「どのように分子設計すればいいのか」という知見が乏しいことにあります。
そのような背景の下、研究グループは、有機化学、計算化学、生化学、核磁気物理学、腫瘍学等のさまざまな分野の知見を駆使し、精密な分子設計によって、重要ながん関連酵素の一つであるアミノペプチダーゼN(APN, CD13)の生体内活性を検出するDNP-MRI分子プローブの開発に成功しました(図1左)。さらに、開発した分子プローブを用いることでがん移植モデルマウスにおけるAPN活性の検出および腫瘍内マッピング、すなわち生体内でのAPN活性の可視化に成功しました(図1右)。また、APN阻害剤を投与した際の酵素活性低下を検出することにも成功しました。APNは、がんの血管新生、転移、悪性度などと密接に関わっていることから、DNP-MRIによりその活性を計測することで早期発見や治療効果の迅速な評価が可能になると期待されます。
本研究は、文部科学省「光・量子飛躍フラッグシッププログラム(Q-LEAP)」(JPMXS0120330644)、JST 戦略的創造研究推進事業チーム型研究(CREST)(研究代表者:山東信介、JPMJCR13L4)、CREST(研究代表者:石北央、JPMJCR1656)、科学研究費補助金 基盤研究(A)(研究代表者:山東信介、JP19H00919)、若手研究(研究代表者:齋藤雄太朗、JP20K15396)、国際共同研究加速基金(国際共同研究強化(A))(研究代表者:高草木洋一、JP19KK0369)、新学術領域研究(研究代表者:石北央、JP18H05155、JP20H05090)、基盤研究(B)(研究代表・分担者:石北央、JP18H01937、JP20H03217)、基盤研究(B)(研究代表者:斉藤圭亮、JP18H01186)、新学術領域研究(研究分担者:斉藤圭亮、JP16H06560)、筑波大学計算科学研究センター学際共同利用プログラム(斉藤圭亮)、QST 戦略的理事長ファンド(高草木洋一)、Intramural Research Program of the National Cancer Institute(石田諒、関智宏、山本和俊、ムラリ クリシュナ チェルクリ)の支援を受けて行われました。
4.発表雑誌
雑誌名:Science Advances(オンライン版:3月30日、http://advances.sciencemag.org/)
論文タイトル:Structure-guided design enables development of a hyperpolarized molecular probe for the detection of aminopeptidase N activity in vivo
著者:Yutaro Saito, Hiroyuki Yatabe, Iori Tamura, Yohei Kondo, Ryo Ishida, Tomohiro Seki, Keita Hiraga, Akihiro Eguchi, Yoichi Takakusagi, Keisuke Saito, Nobu Oshima, Hiroshi Ishikita, Kazutoshi Yamamoto, Murali C. Krishna,* Shinsuke Sando*
DOI番号:10.1126/sciadv.abj2667
アブストラクトURL:https://www.science.org/doi/10.1126/sciadv.abj2667
5.発表者
齋藤 雄太朗(東京大学 大学院工学系研究科 化学生命工学専攻 助教)
谷田部 浩行(東京大学 大学院工学系研究科 化学生命工学専攻 修士課程2年生)
田村 伊織(東京大学 大学院工学系研究科 化学生命工学専攻 博士課程1年生)
近藤 洋平(東京大学 大学院工学系研究科 化学生命工学専攻 博士課程3年生)
石田 諒(研究当時:米国国立衛生研究所 国立癌研究所 博士研究員)
関 智宏(研究当時:米国国立衛生研究所 国立癌研究所 博士研究員)
平賀 啓太(東京大学 大学院工学系研究科 応用化学専攻 修士課程2年生)
江口 晃弘(研究当時:東京大学 大学院工学系研究科 化学生命工学専攻 博士課程3年生)
高草木 洋一(量子科学技術研究開発機構 量子生命科学研究所 主幹研究員)
斉藤 圭亮(東京大学 先端科学技術研究センター 准教授)
大嶋 野歩(研究当時:米国国立衛生研究所 国立癌研究所 博士研究員)
石北 央(東京大学 先端科学技術研究センター 教授)
山本 和俊(米国国立衛生研究所 国立癌研究所 上級研究員)
ムラリ クリシュナ チェルクリ(米国国立衛生研究所 国立癌研究所 主任研究員)
山東 信介(東京大学 大学院工学系研究科 化学生命工学専攻 教授)
6.用語解説:
注1:分子プローブ
生体内のある環境や条件に反応してシグナルが変化する薬剤で、分子センサーとも呼ばれる。
注2:量子操作技術
原子レベル以下の微小な世界で成り立つ物理法則(量子力学)を利用した科学技術。単に「量子技術」とも呼ばれる。「超核偏極」は、原子核のもつスピン(核スピン)の状態を操作し、MRIの感度を劇的に向上させる量子操作技術である。
注3:動的核超偏極法
MRI感度を劇的に向上させる超核偏極技術の中で、最も頻用されている手法。超核偏極機と呼ばれる特殊な機械を用い、極低温・高磁場下で、分子プローブと安定なラジカル化合物を混合させたガラス性溶液にマイクロ波を照射し、電子スピンの高い偏極率を核スピンに移すことで超核偏極(MRI高感度化)を達成する。
7.添付資料
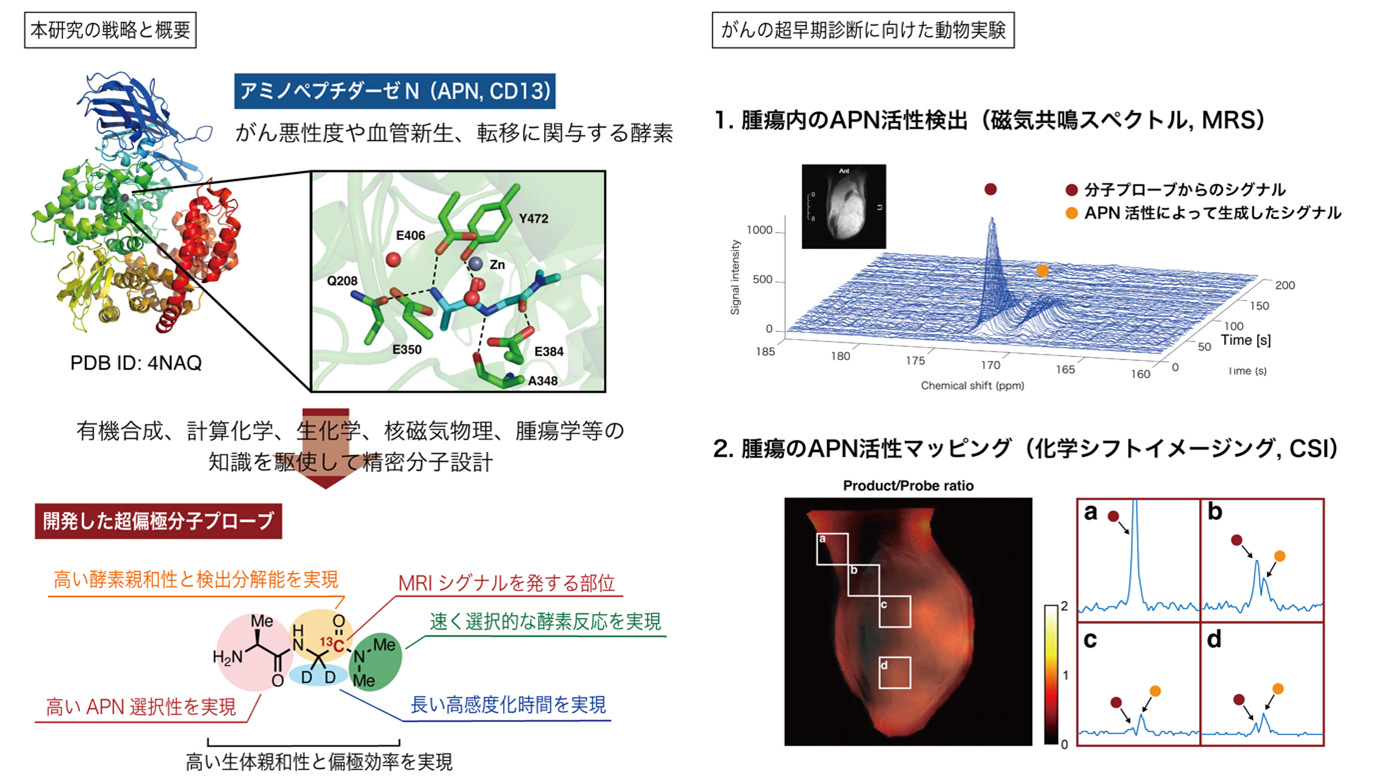
図1 本発表の概要(From Sci. Adv. 8 : e abj2667 (2022). This work is licensed under CC BY-NC (http://creativecommons.org/licenses/by-nc/4.0/)
