本研究のポイント
- 悪性腫瘍(がん)の蛍光/磁性バイモーダルイメージング診断と光温熱治療法(PTT)注1)/化学力学的治療法(CDT)注2)を可能とする超多機能性Gd2O3/CuSナノ粒子(BCGCR)の開発に成功した。
- BCGCRが超多機能性を持ち、がんに対する新規複合的治療法の有効性を明らかにしたと言える。
- BCGCRは、生体内(血管内)に投与しても毒性が無く安全であり、これまで報告されているCuSナノ粒子と比較して、室温で簡便かつ低コストに作製できることから、臨床応用を含めた今後の展開が期待される。
研究概要
国立大学法人東海国立大学機構 名古屋大学 未来社会創造機構 ナノライフシステム研究所/量子科学技術研究開発機構(QST) 量子生命科学研究所の湯川 博 特任教授/プロジェクトディレクター、馬場 嘉信 教授/所長、大学院工学研究科のラ ミンセン博士後期課程学生らは、大学院工学研究科 鳥本 司 教授、亀山 達矢 准教授、大学院医学系研究科 佐藤 和秀 特任講師らとの共同研究において、悪性腫瘍(がん)の蛍光/磁性バイモーダルイメージング診断と光温熱治療法/化学力学的治療法を可能とする超多機能性Gd2O3/CuSナノ粒子(BCGCR)の開発に成功しました。
がんは世界中で主な死亡原因になっており、低侵襲で効果的な治療法の研究開発が進められています。硫化銅(CuS)の強い近赤外光吸収により、BCGCRはレーザー照射により悪性腫瘍内に効率的に熱を発生させることができるため、光温熱治療(PTT)効果を有することを明らかにしました。更に、熱発生によりフェントン反応が促進されるため、ROS産生が加速されることによる非常に高い化学力学的治療(CDT)効果も発揮されることを確認しました。 光温熱治療(PTT)効果と化学力学的治療(CDT)効果の相乗効果により、担がんマウスの腫瘍組織(がん組織)を消滅させることに成功しました。すなわち、Gd2O3/CuSナノ粒子(BCGCR)は超多機能性を持ち、がんに対する新規複合的治療法の有効性をも明らかにしたと言えます。
本研究により、BCGCRが超多機能性を持つとともに、がんの非侵襲的な治療法として極めて有効であることが示されました。BCGCRは、生体内(血管内)に投与しても毒性が無く安全であり、室温で簡便かつ低コストに作製できることから、神経膠腫(悪性脳腫瘍の一種)以外の進行がんに対する治療効果の検証、抗がん剤との併用療法の可能性、及び製剤化検討も含めた臨床応用への今後の展開が期待されます。
本研究成果は、2022年7月25日14時(日本時間)付国際科学誌「ACS Applied Materials & Interfaces」のオンライン版に公開されました。
研究背景と内容
1.背景・目的
がんは世界中での主な死亡原因となっており、有効な治療方法の確立が強く期待されています。がんの治療方法は数多ありますが、最近、がん細胞に酸化的損傷を引き起こすことで、がん細胞を死滅させることが可能なスーパーオキシド(・O2-)、一重項酸素(1O2)、及びヒドロキシラジカル(・OH)などの細胞毒性活性酸素種(ROS)を利用した新規治療方法に注目が集まっています。
特に、本研究で取り組んだ化学力学的治療法(CDT)は、連続的な化学プロセスによりH2O2を細胞毒性があるヒドロキシラジカル(・OH)に変換するメカニズムであり、がん治療の新たな効果的手法として強く期待されています。この方法は、細胞のエネルギー代謝の過程で発生する内因性過酸化水素(H2O2)注2)を非常に毒性の高い活性酸素種(ROS)注3)に変換することで、がん細胞を死滅させます。しかし、これまでの化学力学的治療法(CDT)は低酸素腫瘍微小環境(TME)注4)が酸性であり、かつ、正常細胞と比較してH2O2産生も乏しいため、フェントン反応注5)に基づくROS生成が大きく抑制される問題がありました。
化学力学的治療法(CDT)は一般的にフェントンまたはフェントンのような反応に基づいており、H2O2の酸化的ヒドロキシラジカル(・OH)への変換により治療効果を発揮します。 銅カルコゲニドは、この目的に適した無機ナノ材料として注目を集めています。特に、p型半導体の光増感剤の一種であるCuS ナノ粒子は有力で、幅広い近赤外線(NIR)吸光度、高い光熱変換効率注7)、優れた光安定性を備えています。 NIRレーザー照射下で局所的に熱を発生させることで、熱による死滅効果を示します。そのため、CuSナノ粒子においては、レーザー照射により誘導される光温熱治療(PTT)効果がフェントン反応を促進し、ROS生成を加速することで、極めて効果的な化学力学的治療(CDT)が実現できることになります。つまり、ナノ粒子を介した相乗的なPTT/CDTによる新規複合的治療法が可能になると期待されます。
そこで、本研究では、室温での単純なワンポット合成法による磁性酸化ガドリニウム(Gd2O3)とCuS ナノ粒子の同時合成に取り組み、蛍光/磁性バイモーダルイメージング診断と近赤外光(NIR)照射による光温熱治療法(PTT)、及び効果を増強した化学力学的治療法(CDT)を同時に可能とする超多機能性Gd2O3/CuSナノ粒子(BCGCR)の開発に取り組みました。
2.研究成果
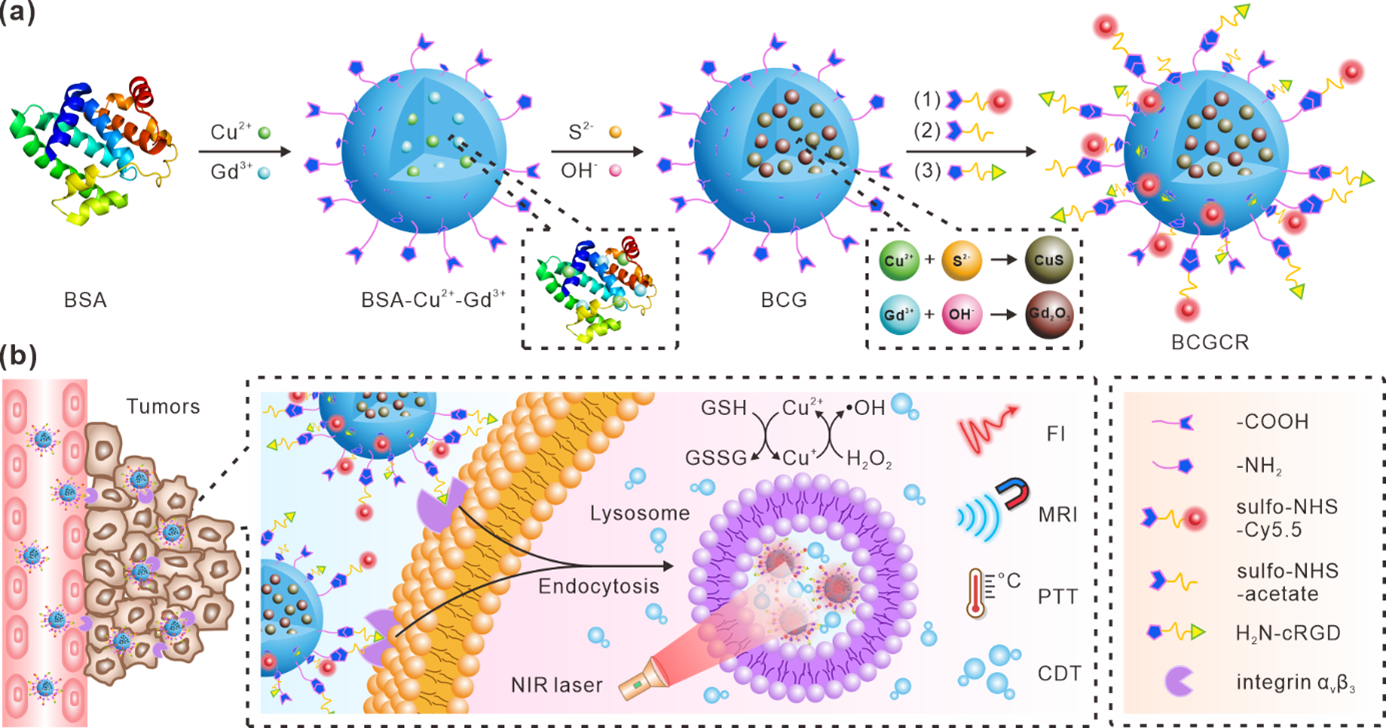
図1. BCGCRの概略図。 (a)BCGCRナノ粒子デザイン。(b)標的悪性腫瘍の蛍光/MRバイモーダルイメージング診断、及びPTT/CDTのメカニズム概要。
超多機能性Gd2O3/CuSナノ粒子(BCGCR)の概略図を示します(図1a)。 ウシ血清アルブミン(BSA)を金属イオンを安定化するためのテンプレートとして利用しました。 CuS ナノ粒子は、強力な近赤外光(NIR)吸収による光温熱治療法(PTT)と、活性酸素種(ROS)の産生による化学力学的治療法(CDT)のために導入しました。また、磁性(MR)イメージングのために酸化ガドリニウムGd2O3を、蛍光イメージングのためにフルオロフォアCy5.5を修飾しました。さらにRGDペプチドの結合により、様々ながん細胞に対する選択的認識能を付与し、がん組織への特異的かつ効率的な集積を可能とする粒子設計になっています。
図1bは、がん診断/治療メカニズムを概説しています。 超多機能性Gd2O3/CuSナノ粒子(BCGCR)は、悪性腫瘍(がん)組織へのEPR効果注8)と特異的認識能により、静脈内投与後に悪性腫瘍(がん)に到達し、その後、がん細胞によるエンドサイトーシス機構によって細胞内に取り込まれます。蛍光/磁性バイモーダルイメージング診断により、悪性腫瘍(がん)の位置が特定されることで、腫瘍患部に対する効率的な近赤外(NIR)光レーザー照射が可能となります。一方、含有されているCuSによる光温熱治療(PTT)効果は、腫瘍組織に損傷を与えるとともに、フェントン反応によるROS生成を加速させます。つまり光温熱治療(PTT)と、ROS生成による化学力学的治療(CDT)の相乗効果によって、がん細胞死を誘導するメカニズムを示しています。
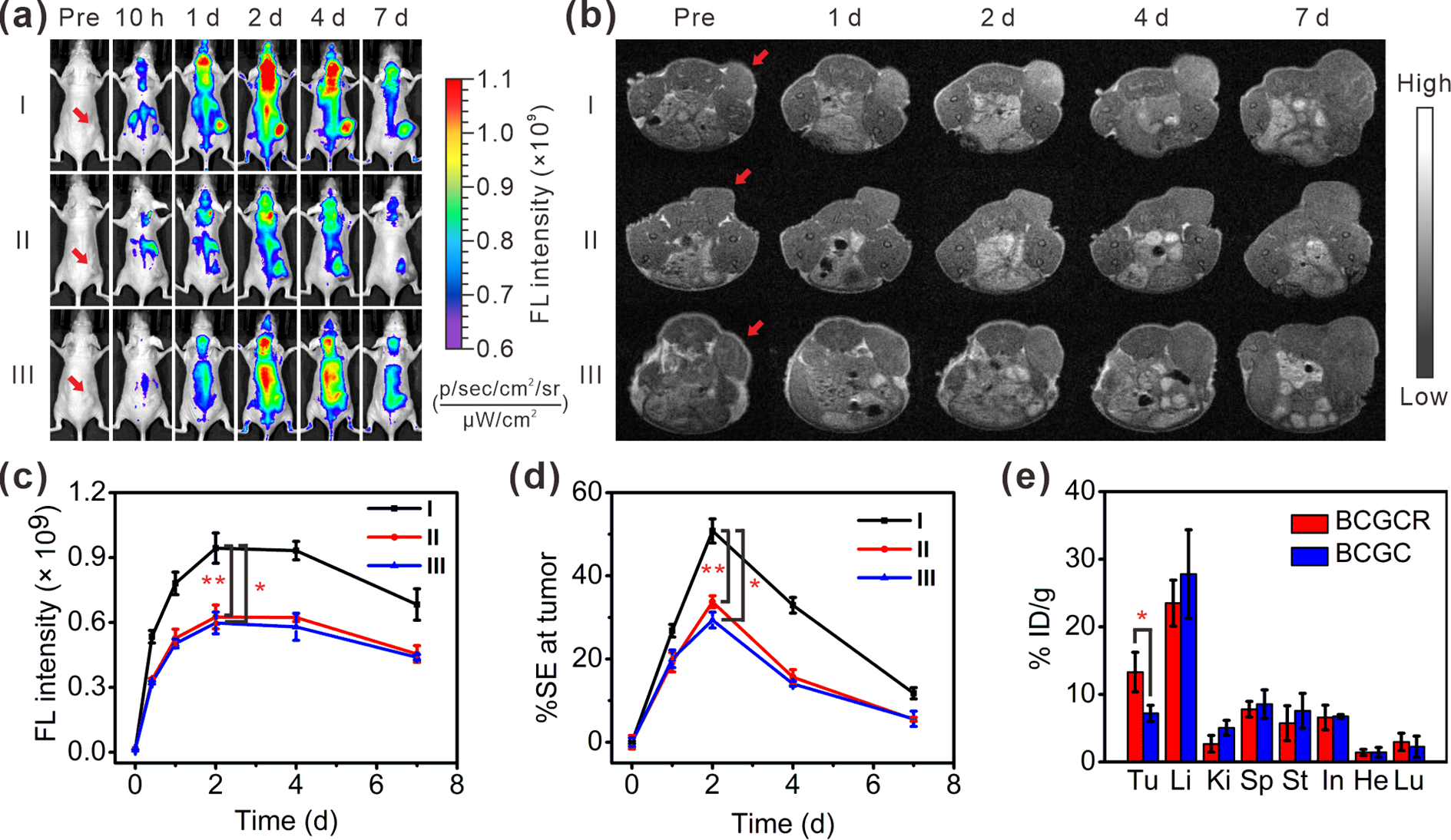
図2. U87MG担がんマウスの蛍光/磁性バイモーダルイメージング診断と生体内分布解析
悪性脳腫瘍の一種である神経膠腫の細胞株(U87MG細胞)由来担がんマウスを準備し、がん組織の検出にBCGCRを利用しました(図2a-b)。開発したBCGCR投与群(グループI)に加え、比較としてRGDペプチドを付与していないBCGC投与群(グループII)と、RGDペプチド単体も同時に大量投与したBCGCR+RGD群(グループIII)を用意し、治療効果を比較しました。その結果、BCGCR投与群(グループI)では、悪性腫瘍(がん)組織における蛍光と磁性(MR)強度が徐々に増加し、投与2日後にBCGCRががん組織に最も集積することが分かりました。 また、BCGCR投与群(グループI)における蛍光/磁性(MR)像は、他の二群よりも強い信号を呈し、RGDペプチドによるがん組織への効率的な集積が確認されました(図2c-d)。 さらに、ICP-AESによる詳細な生体内分布解析により、BCGCR投与群(グループI )は他の二群と比較して、ナノ粒子の集積効率が有意に高いことが明らかになりました(図2e)
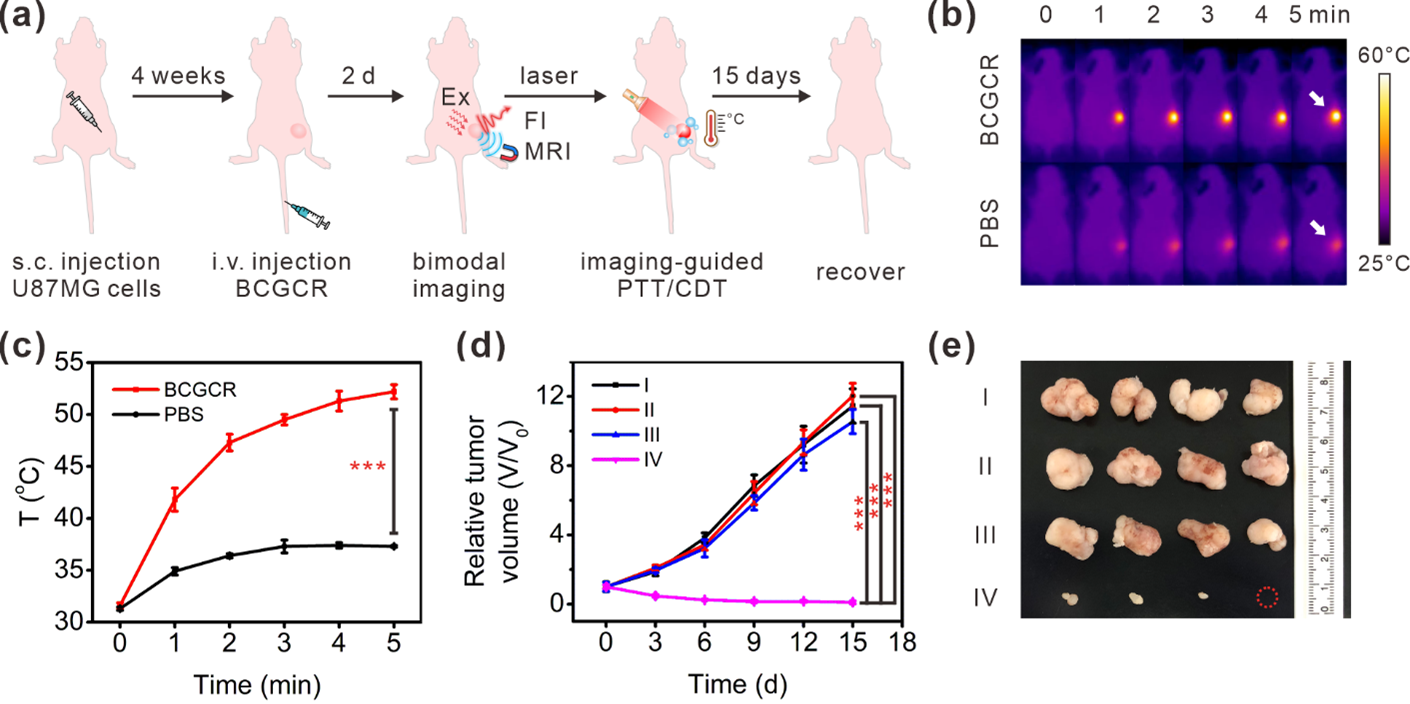
図3. 生体内(In vivo)における悪性腫瘍の相乗的PTT/CDT。
U87MG担がんマウスに対する治療効果を実証しました(図3a)。 がん組織の熱産生画像(サーモグラフィー)と温度変化を図3b-cに示しました。 その結果、BCGCR治療を施したマウス腫瘍部分の温度は、近赤外線(IR)レーザー照射後に急上昇しました。また、BCGCRを投与していない群(PBS群)と比較すると、腫瘍部分の温度上昇が顕著であることが確認されました。
さらに、治療後の腫瘍体積を測定しました。その結果、BCGCR投与群では、近赤外線(IR)レーザー照射により腫瘍成長が大きく抑制されていました。未処置群では、腫瘍が成長し続け、腫瘍の増加が確認されました(図3d)。 投与15日目には、未処置群は腫瘍が極めて大きく成長し続けるのに対し、BCGCR投与群の腫瘍はほとんど消失するのが確認されました (図3e)。
成果の意義
本研究により、蛍光/磁性バイモーダルイメージング診断と相乗的PTT/CTTを実現できる超多機能性Gd2O3/CuSナノ粒子(BCGCR)は、がんの非侵襲的な治療法として極めて有用であることが示されました。今後は、神経膠腫(悪性脳腫瘍の一種)以外の進行がん(肺がん、肝臓がんなど)に対する治療効果の検証、抗がん剤との併用療法の可能性、及び製剤化検討も含めた臨床応用への展開が強く期待されます。
本研究は、独立行政法人日本学術振興会「科学研究費助成事業」基盤B・22H03938、 研究代表:湯川 博、学術変革領域研究A・21H005589、 研究代表:的場 修、基盤A・21H04663、研究代表:的場 修、文部科学省「光・量子飛躍フラッグシッププログラム」(JPMXS0120330644、研究代表:馬場嘉信)、文部科学省「マテリアル先端リサーチインフラ・バイオマテリアル拠点」(研究代表:馬場嘉信)、住友電工グループ社会貢献基金医工連携講座寄付(研究代表:湯川 博)の支援を受けて実施されました。
用語解説
注1)光温熱治療法(PTT):
光温熱治療(PTT)は、光エネルギーを吸収できるナノ粒子を腫瘍内に埋め込んだ後、レーザー光照射をすることで、そのレーザー光の光エネルギーを熱に変換させることで、がん細胞を死滅させる治療方法。
注2)化学力学的治療法(CDT):
化学力学的治療(CDT)は、低酸素腫瘍微小環境を利用した腫瘍内フェントン反応を使用し、毒性の高いヒドロキシルフリーラジカル(•OH)を生成し、選択的な腫瘍組織死滅誘導による治療方法。
注3)内因性過酸化水素(H2O2)
過酸化水素(H2O2)は好気性細胞(酸素を使って生きる細胞)では普通にみられる代謝物であり、その細胞内濃度は生成と分解のバランスにより 10-9~10-7 mol/Lに調節されているといわれている。しかし、腫瘍微小環境(TME)内では、その濃度が低いと考えれている。
注4)活性酸素種(ROS):
活性酸素種(ROS)とは、酸素分子(O2)に由来する反応性に富む分子群の総称です。ROSはミトコンドリア電子伝達系における副産物として、またNOXなどの酵素によって産生される。ROSにはO2の逐次1電子還元産物であるO2-,H2O2,・OHなどが含まれ、生体内に存在するスーパーオキシドジスムターゼ、カタラーゼ、ペルオキシダーゼなどの抗酸化酵素がこれらの代謝に関与している。
注5)腫瘍微小環境(TME):
腫瘍微小環境(TME:Tumor microenvironment)とは、悪性腫瘍細胞(がん細胞)とともに、免疫系細胞、血管系細胞、線維芽細胞などの様々な細胞が作り出す複雑な微小環境のことを指す。免疫抑制性と低酸素状態などを特徴とし、腫瘍発生から増殖・進行に多くの影響を与えることが分かってきている。
注6)フェントン反応:
過酸化水素が、遊離またはタンパク質に結合したCu+(又はFe2+)によって還元され、ヒドロキシルラジカル(・OH)を生成する反応であり、活性酸素種のなかでも、特に反応性の高い・OHを生体内で生成する主要な反応。
H2O2 + Cu+(又はFe2+) →・OH + OH- + Cu2+(またはFe3+)
注7)光熱変換効率(PCE):
吸収された光が熱に変換される効率のこと。
注8)EPR効果
血管には、細胞が酸素や栄養分を取り込むための隙間が空いている。正常血管ではこの隙間は非常に小さく、低分子物質は血管壁を通過しますが、高分子物質は通過することができない。しかし、悪性腫瘍の血管では、血管壁が正常血管よりも粗造になっており、100~200 nm程度の隙間が空いている。この隙間サイズの違いを利用して、100 nm程度以下のサイズに粒径が制御された微粒子を、腫瘍血管からのみ癌組織に到達して患部に集積させることが可能になる。これがEPR効果(Enhanced Permeation and Retention Effect)である。
論文情報
雑誌名:ACS Applied Materials & Interfaces
論文タイトル:Multifunctional Magnetic CuS/Gd2O3 Nanoparticles for Fluorescence/MR Bimodal Imaging-guided Photothermal-intensified Chemodynamic Synergetic Therapy of Targeted Tumors
著者:Minchuan Luo 1, Hiroshi Yukawa 1,2,3,4,5*, Kazuhide Sato 2,4,6, Makoto Tozawa 7, Masato Tokunaga 1, Tatsuya Kameyama 7, Tsukasa Torimoto 7 and Yoshinobu Baba 1,2,3*
DOI: 10.1021/acsami.2c06503
