発表のポイント
- 治療法が限られ予後が悪いとされるトリプルネガティブ乳がん1)、膵がんなどを移植したマウスにα線2)標的アイソトープ治療薬3)の211At-AITM4)を1回投与し、顕著で持続的な抗腫瘍効果があることを確認しました。
- 治療後のがん組織を調べ、代謝型グルタミン酸1型受容体(mGLuR1)5)の発現低下や、細胞老化を示すタンパク質の増加、がん細胞の増殖、転移に関わる遺伝子の発現低下が生じることを発見しました。
- 211At-AITMの顕著で持続的な抗腫瘍効果は、従来から知られているα線によるDNA損傷作用に加えて、がん遺伝子抑制と細胞の老化促進に伴う増殖抑制作用が掛け合わさって発揮されることが明らかとなりました。
- 211At-AITMによる標的アイソトープ治療は、幅広いがん種に対してmGluR1の発現解析に基づく強力かつ安全な個別化治療となることが期待されます。
概要
国立研究開発法人量子科学技術研究開発機構(理事長 小安重夫。以下「量研」という。)量子生命・医学部門 量子医科学研究所 先進核医学基盤研究部 謝琳主任研究員、張明栄部長らは、独自に開発したα線を放出する標的アイソトープ治療薬211At-AITMには、従来知られているDNA損傷作用に加えて、がん細胞の老化促進とがん増殖・転移に関わる遺伝子抑制に伴う細胞増殖抑制作用があることを発見しました。
量研では、がん細胞表面に存在するmGluR1に結合してα線を放出する標的アイソトープ治療薬211At-AITMを開発し、マウス由来の悪性黒色腫細胞に対して顕著な抗腫瘍効果があることを示していましたが、薬の実用化に向けては、ヒト由来のがん細胞にも効果を示すことが重要です。そこで、トリプルネガティブ乳がん、膵臓がん、悪性黒色腫、および大腸がんにおいて、いずれもヒト由来のがん細胞を移植したマウスに対する211At-AITMの治療効果を評価しました。その結果、 211At-AITMを1回投与しただけで、全てのがんにおいて顕著で持続的な抗腫瘍効果が確認できました。一方で、副作用の指標となる体重減少、肝機能と腎機能の障害などは認められませんでした。
顕著な効果が持続する要因を明らかにするため、治療後のマウスから採取したがん組織を様々な生化学的手法で調べました。その結果、mGluR1の発現低下や、細胞老化を示すタンパク質の増加、がん細胞の増殖・転移に関わる遺伝子の発現低下が生じることを発見しました(図1)。211Atを付加していないmGluR1に結合する同量の薬剤を投与した場合や、同じ線量のX線を照射した場合では本研究で発見したようなタンパク質の増減や遺伝子発現の低下は見られませんでした。このことから211At-AITMの顕著で持続的な抗腫瘍効果は、従来から知られているα線によるDNA損傷作用に加えて、mGluR1の発現低下や、がん細胞の老化促進に伴う増殖抑制作用が掛け合わさって発揮されると考えられます。
本研究により、211At-AITMはmGluR1が高発現するがん種に対して持続的な抗腫瘍効果を発揮することが明らかになりました。また、その効果はα線の物理的な作用によって生じることから、mGluR1に対する従来の分子標的薬のような、薬剤耐性獲得による腫瘍増殖効果の低下の心配がありません。これらのことから、211At-AITMによる標的アイソトープ治療は、幅広いがん種に対して、mGluR1の発現解析に基づく強力かつ安全な個別化治療となることが期待されます。
本研究は、日本医療研究開発機構(AMED)による、ムーンショット型研究開発事業「炎症誘発細胞除去による100歳を目指した健康寿命延伸医療の実現(21zf0127003h001)」、JSPS科研費20H03635および21K07659、JSPS二国間交流事業JSBP120207203の支援を受けて実施しました。
この成果は、生命科学研究の分野でインパクトの大きい論文が数多く発表されている米国のCell姉妹誌「Cell Reports Medicine」2023年3月31日にオンライン掲載されました。
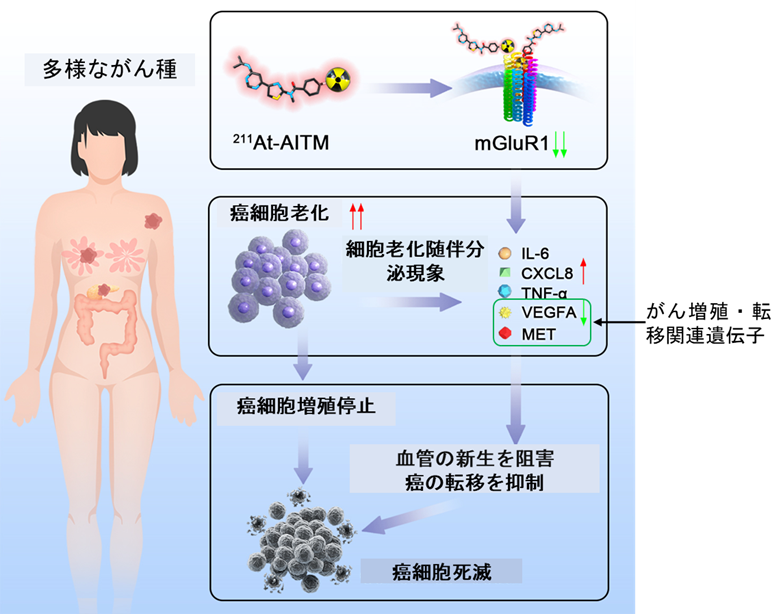
図1: 211At-AITMの新たな抗がん作用メカニズム
補足資料
研究開発の背景と目的
がん細胞は、増殖に必要なエネルギーを得るために様々な代謝経路に異常を生じています。多くのがん細胞ではグルタミン代謝に強く依存しており、その代謝を調節するグルタミン酸受容体の一種である、代謝型グルタミン酸1型受容体(mGluR1)の過剰発現は、乳がん、膵臓がん、悪性黒色腫、大腸がん、肺がんなど多数のがん種の増殖に強く寄与することが示唆されています。
実際に米国のThe Cancer Genome Atlas (TCGA)データベース6)に公開された32種類のがん(合計臨床検体数:10,967)に対して、mGluR1遺伝子の発現頻度を解析した結果、27.03% ~ 100%とばらつきはあるものの、全てのがん種において、mGluR1の発現が見られました(表1)。
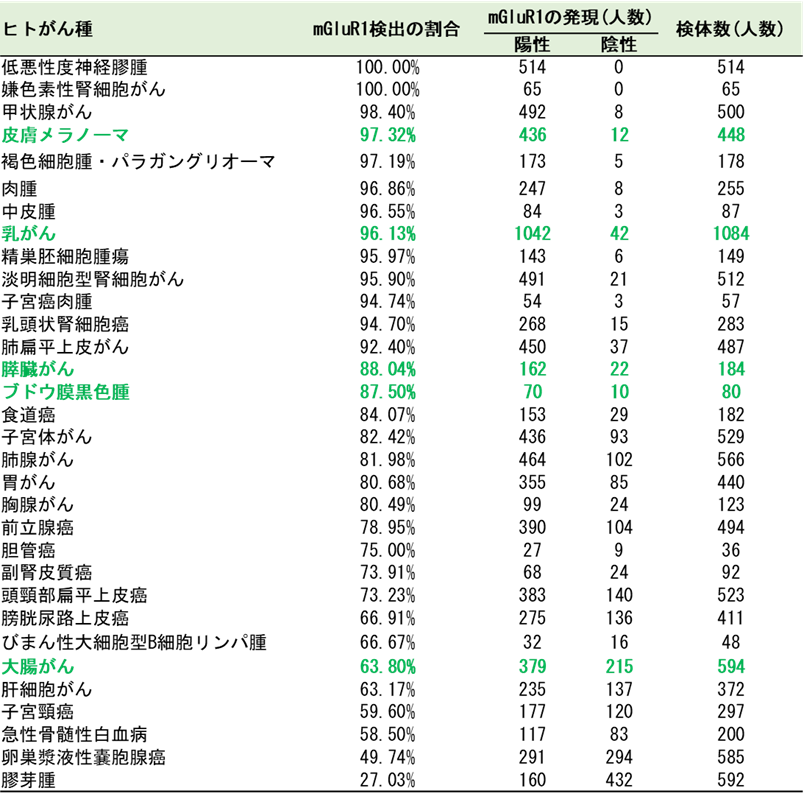
表1. 32種類のがん患者における腫瘍中のmGluR1の検出頻度
mGluR1の発現頻度が高いがん種が上から順に並んでいます。例えば、女性が患うがんの中で最も多い乳がんでは、臨床検体1084のうち1042でmGluR1が発現していた(発現割合が96.13%)という解析結果を示します。
これまで量研では、がん細胞に存在するmGluR1を目印に結合してα線を放出する標的アイソトープ治療薬候補211At-AITMを開発し、マウス由来の悪性黒色腫細胞を移植したマウスに投与して、がん細胞の増殖が顕著に抑制されることを示していました(2019年9月24日プレスリリース)。211At-AITMの実用化に向けては、ヒト由来のがんにも効果があることに加え、複数のがん種で効果が見られれば、大きく弾みがつきます。そこで、表1の結果から、mGluR1の発現頻度が高いがん種の中から、緑色で示した、乳がん、膵臓がん、悪性黒色腫、大腸がんのヒトがん細胞に対して抗腫瘍効果があるかを調べました。
研究の手法と成果
1.ヒトがん細胞に対する211At-AITM 治療効果の評価
本研究では、浸潤性乳がん(トリプルネガティブ乳がん)由来細胞株:MDA-MB231、膵臓がん由来細胞株MIA PaCa2、悪性黒色腫由来細胞株:A375とBowes、大腸がん由来細胞株:DLD1のmGluR1発現を確認し(図2)、これらの細胞を移植したモデルマウスを用いて治療効果を調べました。
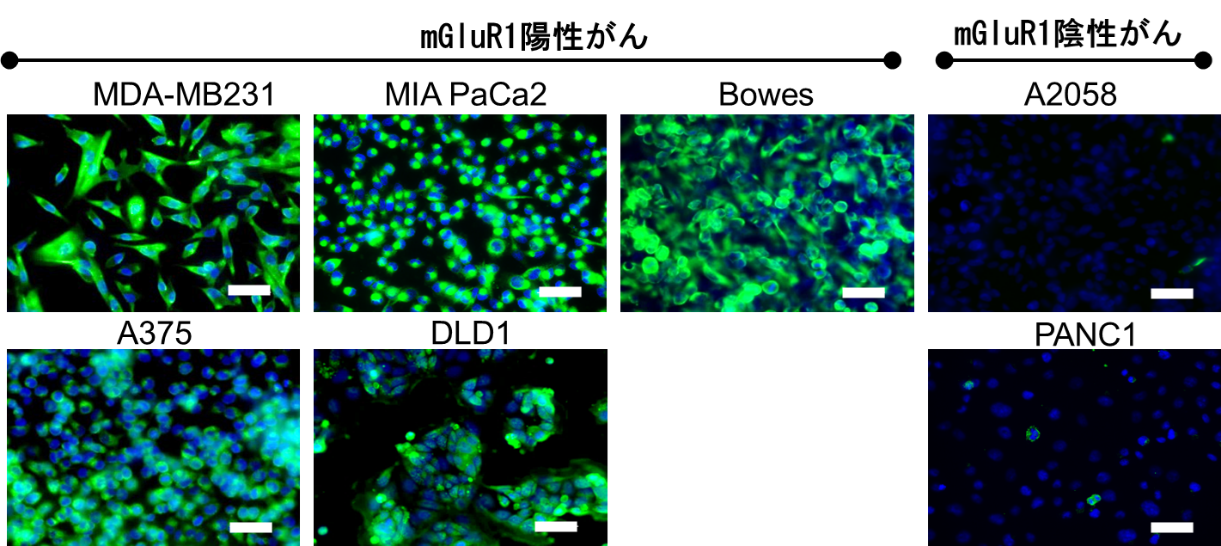
図2:各種がん細胞株におけるmGluR1発現
mGluR1が緑色に染まって見えています。一番右側の列は対照群(mGluR1の発現が低い悪性黒色腫由来細胞株:A2058と膵臓がん由来細胞株:PANC1)です。スケールバー:50 mm。
各種ヒトがん細胞株を移植したモデルマウスに対して、211At-AITM (2.96 MBq) を尾静脈から1回投与し、30日間にわたり、がんの大きさを測定しました。その結果、211At-AITMを投与した群は、投与していない群に比べて、乳がん、膵臓がん、悪性黒色腫および大腸がん、全てにおいて全個体で腫瘍の増殖が抑制され、その効果は 30 日間持続していました(図3)。特に、乳がん、膵臓がんにおいては211At-AITMを投与した群の内、半数の個体で、投与後2-3週間程度で腫瘍の消失が確認されました。なお、211At-AITMを投与した全ての群において、副作用として懸念される体重減少、肝機能や腎機能の低下などは観察されませんでした。
これらのことから、211At-AITMはmGluR1が発現していれば、がん種に関わらず抗腫瘍効果を発揮することが明らかとなりました。
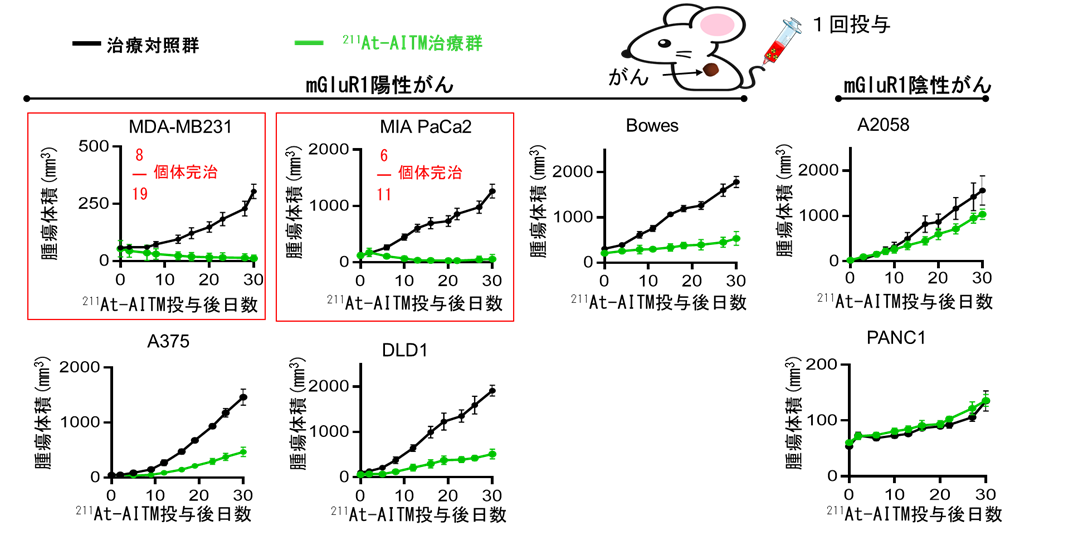
図3:211At-AITM投与による抗腫瘍効果の比較
生理食塩水投与群(治療対照群、グラフの黒線)と比べて、211At-AITM投与群(治療群、緑線)は全個体において、mGluR1陽性の全てのがん種で有意にがん細胞の増殖が抑えられました。特に、乳がん(MDA-MB231)や膵臓がん(MIA PaCa2) に対して211At-AITMを投与された半数の個体において、投与後2〜3週間程度で腫瘍の消失が確認されました(赤枠)。mGluR1の発現が陰性の膵臓がん(PANC1)と悪性黒色腫(A2058)を移植したモデルマウス(一番右側の列)では、がん細胞が増殖していました。
2.持続的な抗腫瘍効果をもたらす機序の解明
標的アイソトープ治療薬のがん細胞に対する作用機序として、薬剤から放出される放射線によりDNAが損傷され、細胞死が誘導されることが知られています。細胞死は数日で起きると考えられますが、211At-AITMによるがん増殖抑制効果は30日と長期にわたって持続しており、DNA損傷の他にも何らかの作用があるのではないかと考えました。
そこで、211At-AITMの抗腫瘍効果の作用機序を解明するため、投与後2、7、および 30 日目の乳がんと膵臓がんの組織切片を免疫染色しました。その結果、投与後2日目にはmGluR1とがん細胞の増殖能を示すKi67の発現が低下しはじめ、7日目以降も低いレベルを維持していました。一方、細胞老化を示す SA-β-galは、2日目、7日目と発現が増加していき、それ以降、高いレベルを維持していました(図4)。
mGluR1に結合する211Atを付加していない同量の薬剤を投与した場合や、同じ線量のX線を照射した場合では、Ki67の発現低下やSA-β‐galの発現増加は見られませんでした。
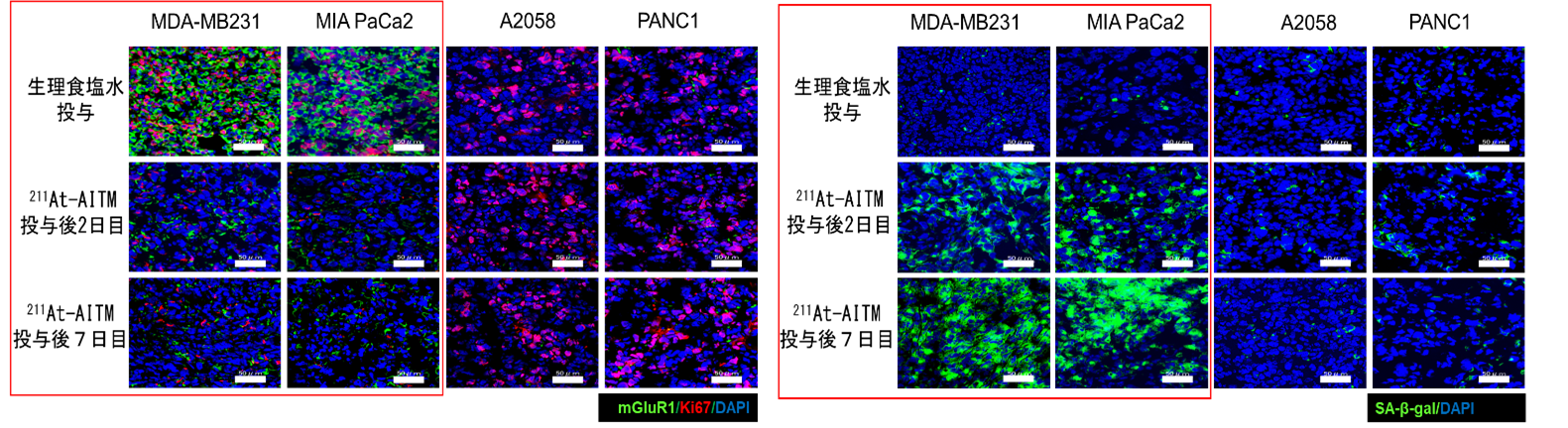
図4:211At-AITM投与後のがん組織切片の免疫染色結果
mGluR1陽性の乳がん、膵臓がんの組織切片では、左図赤枠の結果から、投与後にmGluR1(緑色)とKi67(赤色)の発現が低下していることが、右図赤枠の結果から、SA-β-gal(緑色)の発現が増加していることがわかります。mGluR1が陰性の膵臓がん、悪性黒色腫の組織切片(左右それぞれの図の右側2列)では、発現の増減は見られませんでした。DAPI(青色)は細胞核が染まっていることを示します。スケールバー:50 mm。
SA-β-galが発現しているということは、その細胞が老化していることを示します。そこで、細胞老化随伴分泌現象(SASP)の因子であり、がん細胞の増殖、転移にも強く関わる血管内皮細胞増殖因子 (VEGFA)と上皮間葉転換因子 (MET)の発現を調べました。その結果、211At-AITM投与後にVEGFAとMETの発現も低下していました(図5)。
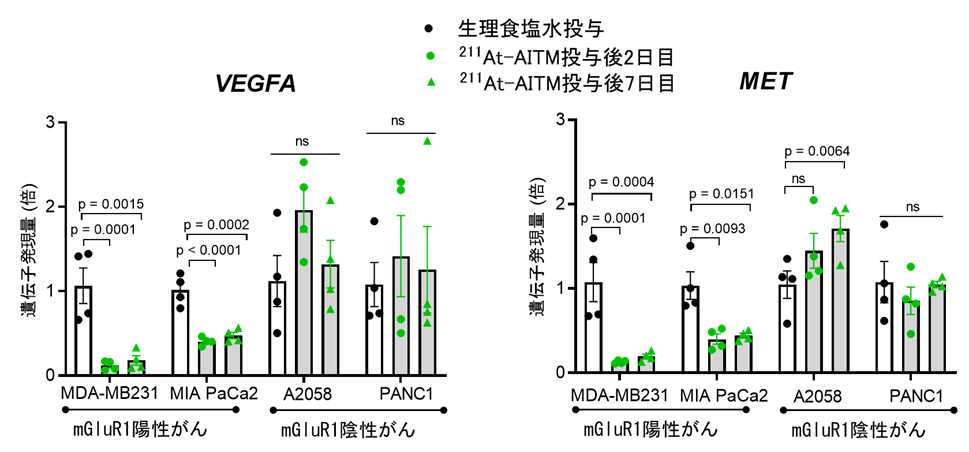
図5:211At-AITM投与後の細胞老化随伴分泌現象因子の発現解析結果
211At-AITM投与前のVEGFA、METの発現量と1とすると、投与後、mGluR1陽性の乳がんでは発現量が10分の1に、膵臓がんでは3分の1に低下していました。mGluR1の陰性の膵臓がん、悪性黒色腫では投与による発現量の低下は見られず、増加もしくは変化なしという結果でした。
以上の結果より211At-AITMの顕著で持続的な抗腫瘍効果は、従来から知られているα線によるDNA損傷作用に、mGluR1の発現低下や、がん細胞の老化促進に伴う増殖抑制作用が掛け合わさって発揮されると考えられます。
今後の展開
本研究により、211At-AITMはmGluR1が高発現していれば、がん種に関わらず持続的な治療効果を発揮することが明らかとなり、さらには、治療法が限られ予後が悪いとされるトリプルネガティブ乳がん、難治がんの膵臓がんで効果を実証できました。また、従来のmGluR1に対する分子標的薬は、投与を重ねるとがん細胞が薬剤耐性を獲得して腫瘍の増殖抑制効果が低下する問題がありました。一方、α線は物理的に作用するため、211At-AITMには薬剤耐性の心配がありません。これらのことは、211At-AITMの実用化に大きな弾みになると考えられます。これらのことから、211At-AITMによる標的アイソトープ治療は、幅広いがん種に対して、mGluR1の発現解析に基づく強力かつ安全な個別化治療となることが期待されます。
今後、ヒトへの応用に向けて、薬剤の構造のさらなる最適化による体内動態の改善と安全性の検討や、治療最適化のための検討などを進めていきます。
用語解説
1)トリプルネガティブ乳がん
エストロゲン受容体(ER)、プロゲステロン受容体(PR)、HER2の遺伝子を発現していない乳がんです。一般的な乳がん治療の中で使用されるホルモン療法やHER2陽性乳がんに使用されるHER2標的療法に反応しないため、臨床的に治療が困難であるとされています。
2)α線
α線はヘリウム(He)原子核が非常に速いスピードで飛んでいるものです。物質中を通過する際、物質と相互作用し、例えば物質中の分子が持っている電子を弾き飛ばしたり(電離といいます)することで、物質に対してエネルギーを付与します。α線は質量が大きく、物質中の分子などと衝突しやすいため、透過性が非常に低く、紙一枚で遮断することができる代わりに、物質中では短い通過距離で高いエネルギーを付与することから、分子などを密に電離することができます。α線を細胞に照射した場合、DNAに修復することが難しいキズ(DNA二重鎖切断)ができます。この現象はα線が、がん細胞を効果的に殺滅できる理由のひとつです。
3)標的アイソトープ治療薬
細胞障害能力を有する粒子線(α線やβ線)や、光子線(γ線)を放出する放射性同位体を用いた治療法。RI内用療法、核医学治療とも呼ばれます。放射性同位体を体内に注射し、がん細胞だけを標的として、がん細胞に粒子放射線を体内から照射し殺傷します。
4)211At-AITM
α線を放出する核種であるアスタチン-211(211At。半減期は7.2時間))をITM(N-[(6-isopropylaminopyrimidin-4-yl)-1,3-thiazol-2-yl]-N-methylbenzamide)で標識した新しい放射性医薬品候補です。ITMは代謝型グルタミン酸1型受容体(mGluR1)に結合することから、211At-AITMはmGluR1を発現するがん細胞を標的とした治療を可能とする。
5)代謝型グルタミン酸1型受容体(mGluR1)
mGluR1は中枢神経系の細胞に広く発現しているタンパク質で、記憶や学習、様々な感覚情報処理を調節しています。正常な末梢臓器では、胃に少量発現していますが、その他の臓器や組織にはほとんど発現していません。一方で、悪性黒色腫、乳がん、大腸がんなど多くの種類のがんで高い発現をしており、がん細胞の増殖、転移などに関与していることがわかっており、mGluR1はがんの診断・治療法の開発にとって有望な標的として注目されています。
6)The Cancer Genome Atlas (TCGA)データベース
2006年に米国国立がん研究所(NCI)と米国国立ヒトゲノム研究所(NHGRI)によって開始されたプロジェクトで、様々ながんに関するゲノムやエピゲノム、トランスクリプトーム、変異情報などのデータを集約し、現在では33のがん種に関する情報を提供しています。TCGAのデータは、世界中の研究者が自由に利用できるため、がん研究や個別化医療、そして新しい治療法を開発するための貴重な情報源となっています。なお、本研究では、mGluR1遺伝子に関するデータが無い慢性骨髄性白血病を除く32種について解析しました。
論文について
タイトル:A 211At-labelled mGluR1 inhibitor induces cancer senescence to elicit long-lasting anti-tumor efficacy
著者:Xie L, Zhang L, Hu K, Hanyu M, Zhang Y, Fujinaga M, Minegishi K, Ohkubo T, Nagatsu K, Jiang C, Shimokawa T, Ashisuke K, Okonogi N, Yamada S, Wang F, Wang R, Zhang MR.
Cell Reports Medicine
DOI:https://doi.org/10.1016/j.xcrm.2023.100960
