発表のポイント
- 酵素反応で生じるラジカル中間体の中性子結晶構造解析に世界に先駆けて成功
- 水素原子の精確な位置情報をもとに、酵素が常温常圧で効率的に機能するための仕組みの一端を解明
- ラジカル中間体を持つ新しい有用酵素開発への応用に期待
【概要】
大阪医科薬科大学、大阪大学、量子科学技術研究開発機構、筑波大学、茨城大学、理化学研究所らの研究グループは、大強度陽子加速器施設(J-PARC)※1内に設置された、物質・生命科学実験施設(MLF)の茨城県生命物質構造解析装置(iBIX) ※2を用いた実験により、銅アミン酸化酵素の触媒反応途上に形成されるセミキノンラジカル中間体の中性子結晶構造解析※3に成功しました。これはラジカルタンパク質として初めての成果であり、活性中心の水素原子の位置を明らかにすることにより、酵素タンパク質内でラジカル中間体が安定に存在できる仕組みの一端を解明しました。同時に活性中心にアミン基質が結合していることも発見し、この基質が、補酵素の構造変化を助けるために反応途中で生成物と入れ替わったものであることを明らかにしました。本研究は、酵素を効率的に働かせるために仕込まれている”手品のタネ”を明かしたといえます。
今回の研究は酵素の精緻な反応メカニズムの一端を原子レベルで明らかにしたものであり、またこれにより、ラジカルを反応中間体とする各種の有用酵素の開発にも大きな進展をもたらすことも期待されます。
本研究成果は、米国科学誌「ACS Catalysis」に、9月7日(木)19時(日本時間)に公開されました。
【発表者】
村川武志:大阪医科薬科大学 医学部 助教
栗原和男:量子科学技術研究開発機構 量子生命・医学部門 量子生命科学研究所 上席研究員
庄司光男:筑波大学 計算科学研究センター 助教
矢野直峰:茨城大学 フロンティア応用原子科学研究センター 助教(現:高輝度光科学研究センター)
日下勝弘:茨城大学 フロンティア応用原子科学研究センター 教授(現:総合科学研究機構)
河野能顕:理化学研究所 放射光科学研究センター 専任技師
鈴木 守:大阪大学 蛋白質研究所 准教授
重田育照:筑波大学 計算科学研究センター 教授
矢野貴人:大阪医科薬科大学 医学部 教授
安達基泰:量子科学技術研究開発機構 量子生命・医学部門 量子生命科学研究所 チームリーダー
谷澤克行:大阪大学 産業科学研究所 招へい教授
岡島俊英:大阪大学 産業科学研究所 准教授
研究の内容
銅アミン酸化酵素は様々な生物種に広く存在し、アミン類をアルデヒドとアンモニアに分解する活性を持っています。活性中心には、銅イオンと補酵素トパキノン(TPQ)を含んでおり、ヒトの血清中の本酵素は、糖尿病の発症にも関与しています。これまで、本酵素は複数の反応中間体を経て効率的に反応を触媒することがわかっており、その過程で、補酵素TPQが大きく構造変化してセミキノンラジカル反応中間体が形成されることが知られていました(図1)。しかし、どのような仕組みで構造変化が起きるのか、その駆動力は何なのかなど、多くの未解明な点が残されていました。また、有機ラジカルは一般に高い反応性を有することが知られていますが、酵素がどのような仕組みでそのようなラジカルを安定に保持しているのかもわかっていませんでした。
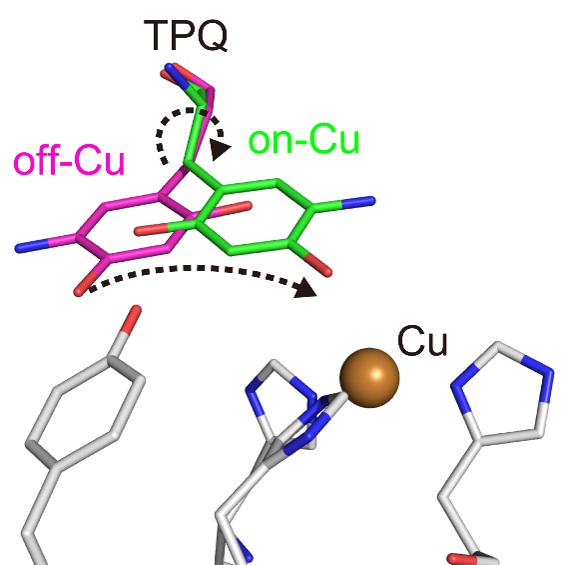
図1 触媒過程における補酵素TPQの構造変化。セミキノンラジカル反応中間体を形成するため、TPQはoff-Cu型からon-Cu型へと反転・スライドする。
研究グループは、微生物由来の銅アミン酸化酵素結晶を、嫌気下で基質アミン溶液に浸漬することによりセミキノンラジカル反応中間体を作り出し、J-PARC※1/MLFのiBIX※2にて中性子回折測定を行うことにより、高分解能の中性子結晶構造解析※3に成功しました。決定された構造では、補酵素TPQは銅イオンに直接配位し、さらに2つの水酸基の水素原子が解離して、周囲のアミノ酸残基と強い水素結合を形成していました(図2)。さらにTPQの芳香環は、周囲の残基とXH-π(XはC, N, O, S)相互作用と呼ばれる弱い相互作用をしていることが判明し、このような相互作用が総合的にラジカル中間体の安定化に寄与していることがわかりました。さらに、実験的に決定された構造に基づいて量子古典混合計算法※4による解析も実施し、補酵素TPQを含めた活性中心解離基のプロトン化状態が正しいことも理論的に証明することができました。
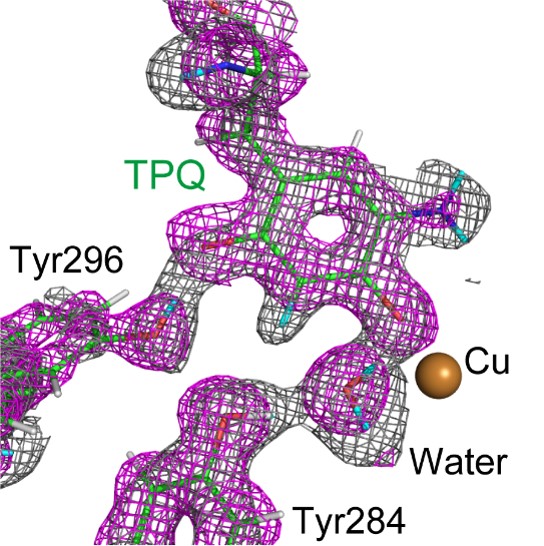
図2 セミキノンラジカル中間体の構造。X線結晶構造解析により得たマップを赤紫色、中性子結晶構造解析により得たマップを灰色の網目で示している。
また活性中心に、基質であるフェニルエチルアミンを検出しました。これまでのX線結晶構造解析による研究では、この分子は生成物のフェニルアセトアルデヒドであると考えられていたのですが、水素原子が検出できる中性子結晶構造解析により、アルデヒドではなくアミンであることが明確に示されました(図3)これにより、触媒過程の途中で第二のアミン基質が生成物であるアルデヒドに置き換わり、それが引き金となって補酵素TPQが構造変化するという仕組みも明らかになりました。このような実にうまく仕組まれた酵素触媒反応のメカニズムは、酵素を効率的に働かせるための“手品のタネ”であり、今回の研究で明らかにされた大きな成果といえます。
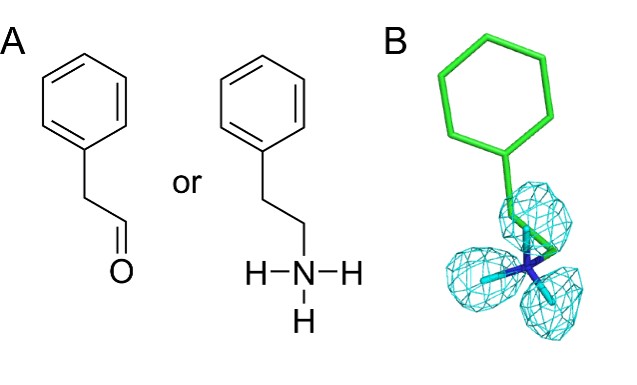
図3 活性中心に検出されたアミン基質。(A)生成物であるフェニルアセトアルデヒド(左)と基質であるフェニルエチルアミン(右)の分子構造。(B)水素原子を検出することのできる中性子結晶構造解析により、検出された分子が、アルデヒドではなくアミンであることが判明した。測定により得た水素(正確には重水素)のマップを水色の網目で示す。
本研究が社会に与える意義(社会的意義)
今回の研究では、酵素の精緻なメカニズムの一端を原子レベルで明らかにしています。酵素科学の分野の大きな研究テーマとして、新しい機能性を持つ酵素の分子設計を行うことが挙げられますが、今回の研究成果が大きく寄与する可能性があります。とりわけ、ラジカルを反応中間体とする各種の有用酵素の開発にも大きな進展をもたらすことが期待されます。
研究者のコメント
タンパク質中を構成する原子のうち、およそ半分が水素原子であり、その一部は水素結合を介して、全体的な構造の安定化、あるいは基質などのリガンドとの相互作用に寄与しています。さらには、酸化還元酵素をはじめとする多くの酵素では、水素原子の移動や反応中間体における水素結合状態は、酵素反応メカニズムの解明に極めて重要な情報となります。そのため、本研究で用いた中性子構造解析によって、酵素構造中(特に反応中間体)において水素原子を可視化できれば、酵素科学の研究分野において、大きな進展につながるものと期待しています。
用語解説
高エネルギー加速器研究機構と日本原子力研究開発機構が茨城県東海村で共同運営している大型研究施設で、素粒子物理学、原子核物理学、物性物理学、化学、材料科学、生物学などの学術的な研究から産業分野への応用研究まで、広範囲の分野での世界最先端の研究が行われている。J-PARC内の物質・生命科学実験施設(MLF)では、世界最高強度のミュオン及び中性子ビームを用いた研究が行われており、世界中から研究者が集まっている。
茨城県がJ-PARC/MLFに設置した2本の中性子ビームラインのうちの一つであり、J-PARC/MLFの強力なパルス中性子源を利用して高分解能のタンパク質結晶構造解析が行える世界最高レベルのパルス中性子単結晶中性子回折装置である。
結晶に中性子を入射し、原子核との相互作用による散乱強度を調べることにより、結晶内に存在する分子の立体構造を得る解析法。同様の手法にX線結晶構造解析があるが、こちらは電子との相互作用を検出するものであり、電子を1つしか持たない水素原子の位置を決定することは極めて難しい。さらに、電子を持たない水素陽イオン(プロトン)については位置情報を得ることが不可能である。中性子結晶構造解析では水素原子(あるいはプロトン)の詳細な観察が可能であり、これが特に生命科学分野で中性子結晶構造解析を行う最大の目的である。中性子実験の際には、データのバックグランドを抑えるため、あらかじめ、結晶を重水に浸すことが多く、水素(軽水素)の一部は重水素に置き換わる。この置換率を調べることにより、その水素原子がどれだけ分子に強く結合していたかがわかる。
活性中心(ここではTPQセミキノンラジカル反応中間体を含む主要残基)は量子力学に基づく方法で記述し、周囲のタンパク質は古典力学に基づく方法(分子力場)で記述することで、計算コストを抑えつつ、タンパク質全体を精度良く取り扱う計算方法。
論文情報
本研究成果は、2023年9月7日(木)19時(日本時間)に米国科学誌「ACS Catalysis」(オンライン)に掲載されました。
<タイトル>
“Neutron crystallography of a semiquinone radical intermediate of copper amine oxidase reveals a substrate-assisted conformational change of the peptidyl quinone cofactor”
<著者名>
Takeshi Murakawa*, Kazuo Kurihara, Mitsuo Shoji, Naomine Yano, Katsuhiro Kusaka, Yoshiaki Kawano, Mamoru Suzuki, Yasuteru Shigeta, Takato Yano, Motoyasu Adachi, Katsuyuki Tanizawa, and Toshihide Okajima*
<DOI>
https://doi.org/10.1021/acscatal.3c02629
