令和6年9月3日
量子科学技術研究開発機構
【発表のポイント】
- iPS細胞1)に見られる点突然変異2)は、iPS細胞樹立に伴って生じる新規の変異である
- 親体細胞や樹立の方法により、iPS細胞における点突然変異数が100個程度の細胞もあれば、1万個以上の細胞もあることを全ゲノム解析により発見した
- 変異解析をタンパク質に翻訳される遺伝子領域だけでなく、遺伝子の発現を制御する領域についても行うことで、より安全性の高いiPS細胞が選別できると期待される
【概要】
国立研究開発法人量子科学技術研究開発機構(理事長 小安重夫)放射線医学研究所 放射線規制科学研究部 荒木良子シニアスタッフ、菅智技術員、法喜ゆう子研究員、および量子医科学研究所 安倍真澄上席研究員らの研究チームは、免疫原性や腫瘍原性の低いiPS細胞株の樹立を目的として、体細胞のゲノムが初期化されiPS細胞へと変わっていく過程の分子機構の解明に取り組みました。その中で、今回iPS細胞に見られる点突然変異はその細胞株の樹立に伴って生じたものであることや、iPS細胞種間でその変異数に大きな差があることを明らかにしました。
iPS細胞には、一般的にゲノム全体で数百から一千カ所(タンパク質を作るための遺伝子情報を有する領域を含む)もの点突然変異が見つかることが知られており、それらは移植の際の免疫原性や造腫瘍性の原因となりうるため、医学利用にあたっては慎重な対応が求められています。研究チームは今回、様々な方法で樹立した100種を超えるヒトiPS細胞株やマウスiPS細胞株の全ゲノムを解析し、iPS細胞に見られる点突然変異がiPS細胞樹立に伴って新規に生じるものであることや、点突然変異数が1万個を超えるiPS細胞もあれば、100個にも満たないものもあることを示しました。
従来、iPS細胞の安全性に関わるゲノム変異の評価は、ゲノムの大きな構造変化やタンパク質を作るための遺伝子情報を有する領域(特にがん関連遺伝子)を対象に行われていましたが、本研究のように全ゲノムを対象として変異の有無を注意深く評価することで、より安全性の高いiPS細胞を選び出すことが可能になると考えられます。再生医療の実現に有用とされるiPS細胞は、局所放射線障害や内部被ばくの治療など放射線研究の領域でも期待されます。この成果は、iPS細胞の再生医療利用が抱える問題の解決に大きく貢献する成果です。
本成果は、「Nature Communications」にて2024年6月11日(火)にオンライン掲載されました。
【研究開発の背景と目的】
iPS細胞を目的の細胞に分化させ移植治療に用いる試みや、患者の細胞からiPS細胞を樹立し病気の発生メカニズムの解明や創薬に利用する取り組みが精力的に進められています。一方で、iPS細胞を樹立する過程、すなわち体細胞のゲノムが初期化されiPS細胞へと変わっていく過程の分子機構に関しては未だ十分には解明されておらず、議論が続いている課題があることも事実です。その一つが、iPS細胞ゲノムに存在する点突然変異の存在です。これらは移植の際の免疫原性、そして造腫瘍性の原因となりうるため、取り扱いは慎重に行われる必要があります (参考文献1)。
これまで、皮膚の線維芽細胞や末梢血等の体細胞を用い、ウイルス由来のベクターや、遺伝子挿入の起こらないエピゾーマルベクター、メッセンジャーRNA等の様々な方法で山中因子を導入したiPS細胞が樹立され、そのゲノム内の点突然変異の解析が行われてきました。そしてiPS細胞株のゲノムあたり300~1,000カ所(遺伝子のタンパク質コード領域あたりにすると平均6カ所)の点突然変異が報告されています。
この変異発生機構に関しては長く解らないままでしたが、近年我々は、その原因がゲノム初期化に伴うDNA損傷チェックポイント機能の低下、さらには、DNA損傷の要因となる活性酸素がその時期に一致して発生することが主な原因であることを突き止めました。さらに、活性酸素が少ない臍帯血由来赤芽球3)をiPS細胞樹立の親体細胞として用いることで、変異数を劇的に抑制できることも報告しました(参考文献2)。
しかしながら、これまでiPS細胞で見つかる点突然変異はiPS細胞樹立に伴う現象ではなく、もともと親体細胞に存在していたものであるという考えが支配的でした。そこで、今回、100種を超えるiPS細胞株を用いて全ゲノムシーケンシング解析によりゲノムに存在する変異を明らかにし、その起源と発生機構を明らかにすることを目的に研究を行いました。
【研究の手法と成果】
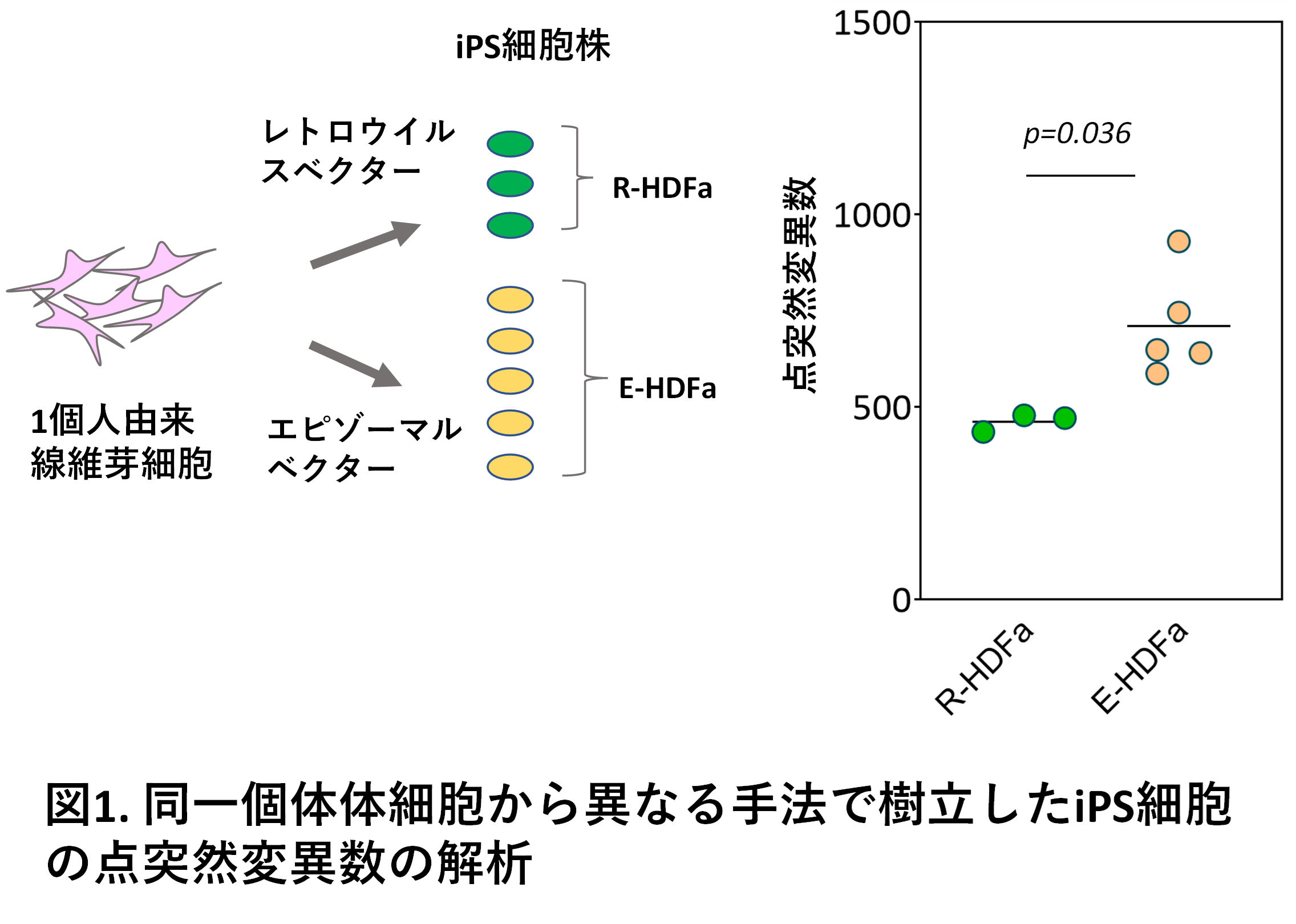
今回我々は次の3つの解析の結果からiPS細胞に見られる点突然変異は、iPS細胞樹立に伴うものであることを示しました。
第1の解析として、一人(一個人)の皮膚線維芽細胞から異なる2つの方法(良く使われるレトロウイルスベクターおよびエピゾーマルベクターを用いる方法)でiPS細胞株を樹立し、全ゲノムを対象に点突然変異を解析しました。その結果、変異数が樹立法に依存することが明確に示されました(図1)。
第2の解析として、同一マウス個体から調製した体細胞からレトロウイルスベクター法により33種のiPS細胞株および2株の核移植ES細胞(iPS細胞と同様、ゲノム初期化による多能性幹細胞)を樹立し、各々の株の全ゲノムに存在する点突然変異を解析しました。その結果、親体細胞株に既に存在していた変異として株間で共通に存在する変異はほとんど観察されず、検出された変異の大部分はそれぞれの株に特有の変異でした。
そして、第3の解析として同じ個体から樹立されたヒトiPS細胞姉妹株に関しても親体細胞株と、5株のiPS細胞姉妹株に含まれる点突然変異の詳細な比較解析から、iPS細胞の変異が元の親体細胞株に存在した変異ではないことが強く示唆されました。
これらの3つの独立した実験はどれもiPS細胞で検出される点突然変異のほとんどがiPS細胞樹立に伴って新規に生じた変異であることを示していました。
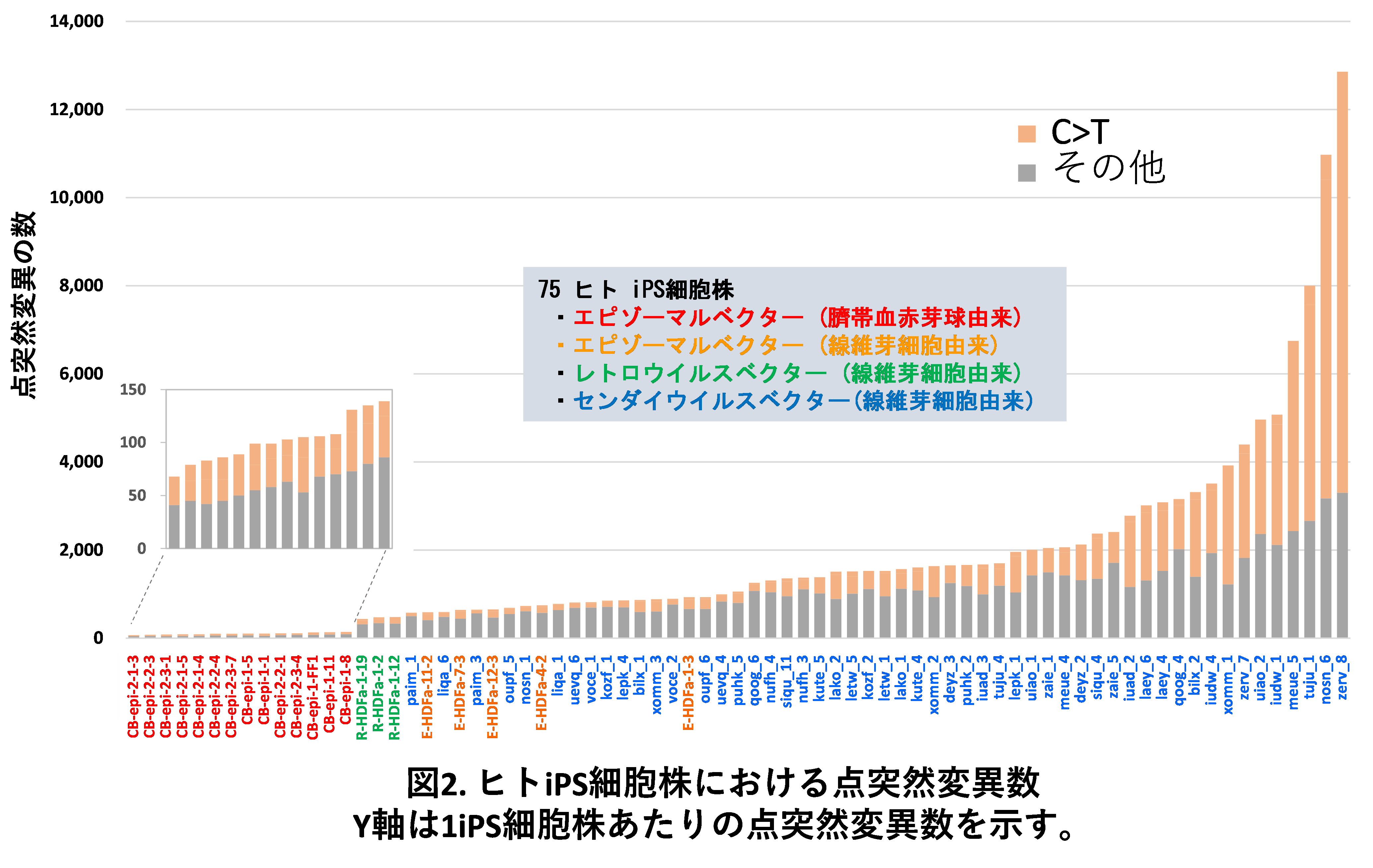
この様な結果を得た後、75種のヒトiPS細胞株の全ゲノムを解析したところ、点突然変異数が従来考えられていたよりはるかに多い、数千から1万以上のiPS細胞が見つかりました。その一方で、我々が変異数を劇的に抑制できると報告していた臍帯血由来赤芽球を親体細胞としたiPS細胞では、全ゲノムで見ても変異数が極めて少ないことが確認できました(図2)。
また、通常は極めて効率的に修復されるC(シトシン)からT(チミン)への変異(C>T変異)が多くのiPS細胞でみられ、総変異数を押し上げる主因となっていました。また、遺伝子発現調節に重要なCG配列でのC>T変異を、通常(親から子に受け継がれ、身体中ほぼすべての細胞に存在する変異。生殖細胞系列変異と呼ばれる)とiPS細胞とで比べたところ、iPS細胞でより多く生じていました。さらに特定のレトロトランスポゾン4)と呼ばれる配列のCG配列でより高い頻度で変異が生じることも示されました。
【今後の展望】
今回の研究を含めた我々のこれまでの研究で、iPS細胞樹立が点突然変異を伴う反応であることが明らかになりました。しかしその一方で今回の結果は、従来のようながん遺伝子領域に加えて、遺伝子発現の制御領域の変異の評価も注意深く行うことで安全なiPS細胞を選び出すことが可能なことも意味しています。さらに、従来定義されている遺伝子制御領域に加え、今回変異上昇が検出されたある種のレトロトランスポゾンは、最近、遺伝子の近傍に存在しその発現制御に関与することが議論されており、注意深い解析の必要性が示唆されました。
また、改めてヒト臍帯血由来赤芽球から樹立されたiPS細胞の優位性(変異が生じにくい細胞であること)が示されました。ヒト臍帯血由来赤芽球から樹立したiPS細胞は、タンパク質をコードする遺伝子領域に変異を全く持たない株も存在し、その他のゲノム領域にも変異が極めて少ない(参考文献1、2)ことから、医学利用において他のiPS細胞には見られない大きな利点を有しています。
今回の研究では、遺伝子発現制御に深くかかわっているCG配列においてiPS細胞で変異が生じる機構として、脱メチル化反応が関与している可能性を示唆する結果を、マウス細胞を用いた実験で得ています。このようにiPS細胞樹立時に変異を生じる機構の解明をさらに進めることにより、変異を抑制する方法の開発などにつながることが期待されます。
【参考文献】
1.Araki R, Uda M, Hoki Y, Sunayama M, Nakamura M, Ando S, Sugiura M, Ideno H, Shimada A, Nifuji A, Abe M. Negligible immunogenicity of terminally differentiated cells derived from induced pluripotent or embryonic stem cells. Nature. 2013,494:100-4.
2. Araki R, Hoki Y, Suga T, Obara C, Sunayama M, Imadome K, Fujita M, Kamimura S, Nakamura M, Wakayama S, Nagy A, Wakayama T, Abe M. Genetic aberrations in iPSCs are introduced by a transient G1/S cell cycle checkpoint deficiency. Nat Commun. 2020, 11:197.
【謝辞】
本研究の一部は、AMEDムーンショット型研究開発事業「細胞運命転換を用いた若返りによるがんリスク0の世界」細胞運命転換によるがん組織を支えるネットワークへの介入による治療の概念実証とそのメカニズムの解明、JSPS科研費基盤研究B(21H02689)、の助成を受けました。
【用語解説】
1)iPS細胞(人工多能性幹細胞)
皮膚等の既に分化した細胞に数種類の遺伝子を導入することなどによって分化多能性(様々な細胞に分化する能力)を誘導した細胞のこと。なお、幹細胞とは、自分自身を増やす自己複製能力と、ほかの細胞に分化(成長)する能力を持つ、ほかの細胞の元となる特別な細胞。iPS細胞は、再生医療への応用や薬剤開発等への利用が期待されています。一方で、iPS細胞のゲノムには全体で数百から一千か所もの点突然変異が見つかることが知られ、これらは移植の際の免疫原性、造腫瘍性の原因となりうるため、取り扱いは慎重に行われています。
2)点突然変異
ゲノムDNAの構成因子である塩基が一つ、なんらかの理由で他の塩基に置き換わる現象。変異がタンパク質を生むゲノム部位に生じると、そのタンパク質の機能が損なわれたり、逆に、機能が異常に促進されたりすることがあり、それが原因で細胞が正常の状態から逸脱して増殖する、つまり、がん化を起こす場合があることが知られています。
3) 赤芽球
赤芽球は、一般的には赤血球になる前の分化段階の細胞です。本研究でiPS細胞の材料とした細胞は、臍帯血からエリスロポエチン等増殖因子を加えて培養し増やした細胞群であり、厳密には、赤芽球を含む様々な分化ステージの集団となります。
4)レトロトランスポゾン
実はヒトゲノムの40%以上がレトロトランスポゾンと呼ばれる配列で占められています。ゲノム上に似た配列が多いことから反復配列の一種です。これらの配列は、転写・逆転写を経てほかのゲノム部位にDNAとして挿入されることがあるため、可動遺伝子とも呼ばれています。進化との関連や疾患の原因、さらには、発生、分化への役割も注目されている一方、最近、iPS細胞においてこれらが活性化されることが報告され、注目されています。
【掲載論文】
タイトル:iPS cell generation-associated point mutations include many C>T substitutions via different cytosine modification mechanisms
著者:Ryoko Araki1, Tomo Suga1, Yuko Hoki1, Kaori Imadome1, Misato Sunayama1, Satoshi Kamimura1, Mayumi Fujita1 and Masumi Abe2
著者所属:
1; Department of Radiation Regulatory Science Research, Institute for Radiological Science, National Institutes for Quantum Science and Technology
2; Institute for Quantum Medical Science, National Institutes for Quantum Science and Technology, Chiba, Japan
雑誌名:Nature Communications
