



 2025年7月15日
2025年7月15日
熊本大学
量子科学技術研究開発機構
総合科学研究機構
茨城県
J-PARCセンター
ポイント
- がんに関わるヒトの酵素 (MTH1) の基質・阻害剤結合部位の全原子構造をX線と中性子を用いて高精度で決定しました。
- MTH1の酵素反応過程を時系列に観察することにより、従来の研究手法では長年議論にとどまっていた反応機構を初めて実証しました。
- MTH1の高精度構造に基づいた既存の阻害剤の改良や新規阻害剤の設計などが可能になり、新たな抗がん剤の創出につながることが期待されます。
概要
国立大学法人熊本大学大学院生命科学研究部 (薬学系) の中村照也准教授、同研究室卒業生の平田啓介さん、藤宮佳菜さん、博士前期課程2年の後藤大空さんの研究グループは、国立研究開発法人量子科学技術研究開発機構 量子生命科学研究所の玉田太郎プロジェクトディレクター、一般財団法人総合科学研究機構 中性子産業利用推進センターの日下勝弘グループリーダー、ドイツ ミュンヘン工科大学のAndreas Ostermann主任研究員らのグループと共同で、X線と中性子を用いて、がんに関わるヒトの酵素 (MTH1) の高精度の全原子構造を決定し、MTH1の酵素反応過程を時系列に観察しました。その結果、MTH1と基質a)・阻害剤との結合には、これまで観察の困難であったプロトン (水素原子) が重要な役割を果たしていることを実験的に実証し、従来の研究手法では長年議論にとどまっていたMTH1の酵素反応機構も明らかにしました。MTH1はがんに関わる酵素であるため、本研究は、MTH1の高精度構造を基にした新しい抗がん剤の創出につながることが期待されます。
本研究成果は、令和7年7月14日の週に米国の科学誌 Proceedings of the National Academy of Sciences of the United States of America (PNAS) にオンラインで発表されます。本研究は、科学研究費助成事業 (24K01966, 18K06600)、独立行政法人日本学術振興会卓越研究員事業、新学術領域研究事業 (15H01050)、公益財団法人鈴木謙三記念医科学応用研究財団、持田記念医学薬学振興財団、篷庵社、国立研究開発法人日本医療研究開発機構創薬等先端技術支援基盤プラットフォームAMED/BINDS (JP22ama121001) の支援を受けて実施されました。中性子回折実験は、大強度陽子加速器施設 (J-PARC) の物質・生命科学実験施設 (MLF) に設置された茨城県中性子ビームライン (iBIX) の県プロジェクト研究において、また、ミュンヘン工科大学の研究用原子炉 (FRM II) において実施し、X線回折実験は高エネルギー加速器研究機構のPhoton Factoryと大型放射光施設SPring-8にて実施しました。
背景
生体内で生じる活性酸素種は、遺伝情報を担うDNAだけでなくその材料であるヌクレオチドも酸化します。8-oxo-dGTPは通常のヌクレオチドであるdGTPの酸化体であり、これがDNAに取り込まれるとがんや老化の原因となります。MTH1は8-oxo-dGTPだけでなく2-oxo-dATPなどの他の酸化ヌクレオチドとも結合して分解する酵素であり、細胞内の酸化ヌクレオチド除去酵素として働いています (図1)。一方で、MTH1はがん細胞で高発現し、がん細胞を酸化ストレスから保護していると考えられており、MTH1阻害剤のがん細胞増殖抑制効果が報告されて以降、新規作用機構の抗がん剤ターゲットとしても注目されています (1, 2)。
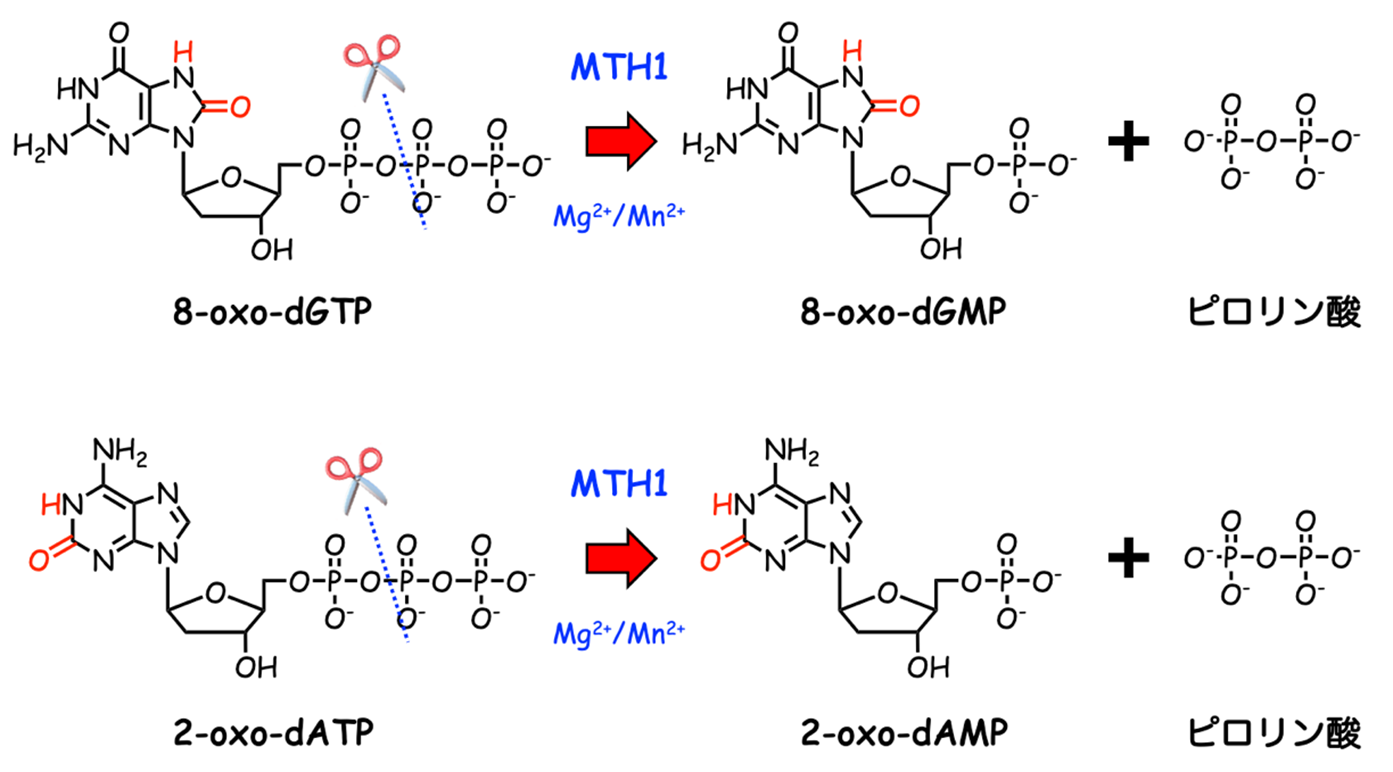
図1 MTH1による酸化ヌクレオチドの加水分解
これまでに熊本大学の研究グループは、X線結晶構造解析b)により8-oxo-dGTP結合型と2-oxo-dATP結合型のMTH1のX線結晶構造をそれぞれ決定しました (3-5)。その結果、MTH1の基質結合ポケットのプロトン (水素原子) の付加/脱離 (プロトン化/脱プロトン化) の状態が、基質や阻害剤との結合に重要であることを提案しましたが、実験的な実証には至っていませんでした (図2)。また、MTH1が8-oxo-dGTPと2-oxo-dATPを加水分解するには、Mg2+やMn2+イオンとの結合が必須であることが報告されていますが (図1)、MTH1がこれら金属イオンとの結合によって、どのようにヌクレオチドを分解するかという反応過程を観察した例はありませんでした。
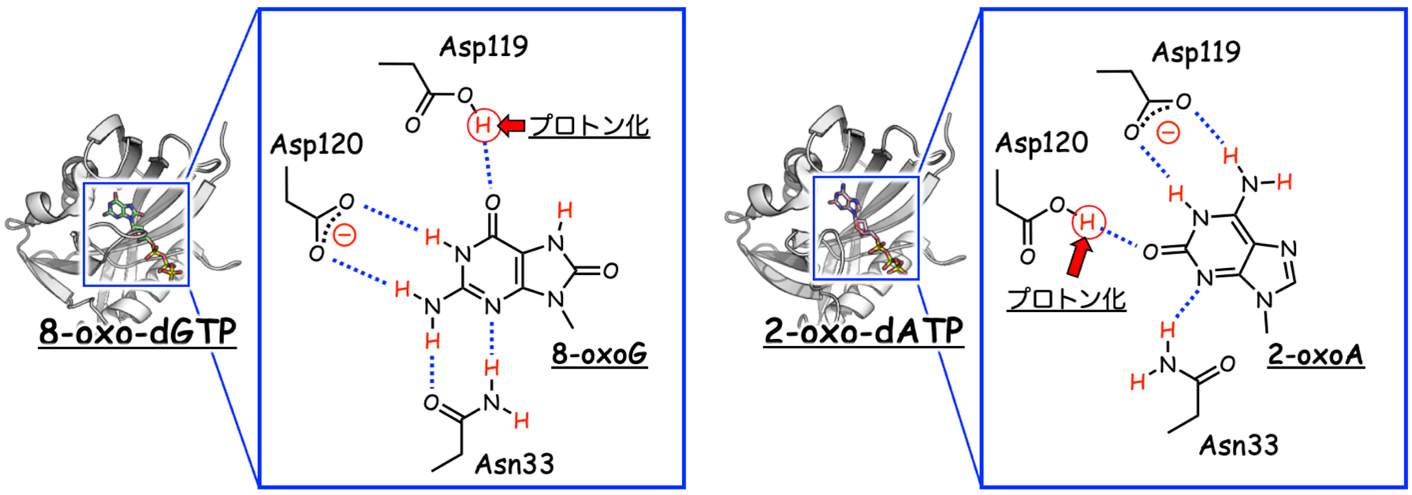
図2 これまでに提案していた基質結合
左:8-oxo-dGTP、右:2-oxo-dATP
研究の内容・成果
X線結晶構造解析では、MTH1構造中の水素原子を観測することは困難であったため、水素原子を高感度で直接観察できる中性子に着目して、中性子結晶構造解析c)を行いました。8-oxo-dGTP結合型と2-oxo-dATP結合型のMTH1の中性子結晶構造をそれぞれ決定し、8-oxo-dGTP結合および2-oxo-dATP結合に関わる水素原子を高感度で観察することに成功しました (図3)。その結果、MTH1は、119番目のアスパラギン酸 (Asp119) にプロトンが付き (プロトン化)、120番目のアスパラギン酸 (Asp120) にはプロトンが付かない (脱プロトン化) 状態で、8-oxo-dGTPと結合することが明らかになりました。一方、2-oxo-dATPと結合する際には、MTH1のAsp119にプロトンが付かず、Asp120にプロトンが付いた状態であったため、8-oxo-dGTP結合時と比べてプロトン化/脱プロトン化の関係が変化していることがわかりました。この結果は、これまでに報告してきた実験結果からの予測と一致しています (図2)。今回の中性子結晶構造解析によって水素原子を直接観察することで、MTH1はAsp119とAsp120のプロトン化状態を変え、化学構造の異なる8-oxo-dGTPと2-oxo-dATP両者と結合することを実験的に初めて実証し、この仕組みがこれまでに創出されたMTH1阻害剤との結合にも重要であることを示しました。
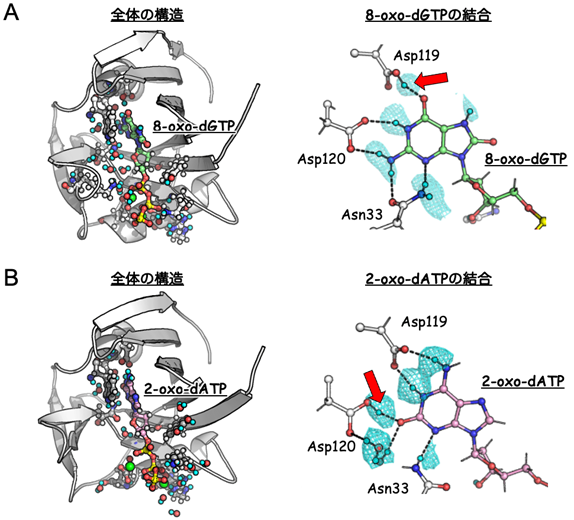
図3 MTH1の中性子結晶構造解析の結果
(A) 8-oxo-dGTP結合型の構造。(B) 2-oxo-dATP結合型の構造。基質結合に関わる全原子を表示し、観察された重水素は水色で示している。水色のメッシュは重水素由来の密度マップ。赤矢印はそれぞれプロトン化したAsp119の重水素とプロトン化したAsp120の重水素を示している。
また研究グループは、時分割X線結晶構造解析d)という「結晶内の酵素反応を可視化する手法」を確立した経験を活かし (6, 7)、MTH1がMn2+イオンの結合とともに8-oxo-dGTPと2-oxo-dATPを加水分解する過程を可視化しました。その結果、MTH1の活性部位 (3つのグルタミン酸Glu52, Glu56, Glu100で構成され、化学反応が進行する部位) に3つのMn2+イオンが結合して、水分子が活性化されることで基質のリン原子への求核攻撃が起こり、反応が触媒されることが実験的に実証されました (図4)。反応中のプロトンの位置は観察することができませんでしたが、8-oxo-dGTPおよび2-oxo-dATP結合型の中性子結晶構造のプロトンの位置から、Glu52が水分子のプロトンを引き抜くことで反応が進行することが示唆されました。従来の研究手法の結果からは、MTH1の属する加水分解酵素ファミリーの反応には2つの金属イオンが関与する「2金属イオン機構」と3つの金属イオンが関与する「3金属イオン機構」の2つのモデルが長年にわたって議論されていますが、今回の研究により、MTH1は3金属イオン機構により反応を触媒することが明らかになりました。
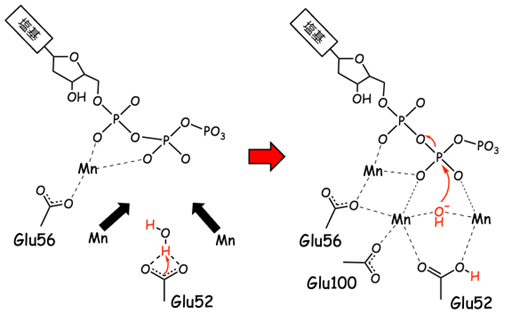
図4 MTH1の3つのMn2+イオンを介した反応機構
展開
これまでに世界中の研究グループが、抗がん剤開発を目指して数多くのMTH1阻害剤を合成しています。そのほとんどの阻害剤がMTH1のAsp119とAsp120と結合するため、本研究で得られたMTH1の高精度な構造に基づいた既存の阻害剤の改良や新規阻害剤の設計などが可能になり、新たな抗がん剤の創出につながることが期待されます。
用語解説
a) 基質
酵素が作用して化学反応を受ける物質のこと。MTH1の基質は8-oxo-dGTPや2-oxo-dATPである。
b) X線結晶構造解析
X線を用いて分子の立体構造を決定する実験手法。調製した結晶試料にX線を照射し、結晶によって回折したX線を測定することで分子の立体構造を決定できる。
c) 中性子結晶構造解析
中性子を用いて分子の立体構造を決定する実験手法。X線結晶構造解析では観察の困難な水素原子を高感度で観察できる。
d) 時分割X線結晶構造解析
酵素結晶は、水分の含有率が高いため (〜40%以上が水)、結晶状態であっても酵素活性を保持していることが多い。この特徴を活かして、酵素結晶に反応開始となる金属イオン溶液を染み込ませることで、反応時間毎の酵素結晶を調製して、反応開始から終了までの過程を観察する手法。
引用文献
1) H. Gad, et al., MTH1 inhibition eradicates cancer by preventing sanitation of the dNTP pool. Nature 508, 215–221 (2014).
2) K. V. M. Huber, et al., Stereospecific targeting of MTH1 by (S)-crizotinib as an anticancer strategy. Nature 508, 222–227 (2014).
3) S. Waz, et al., Structural and kinetic studies of the human nudix hydrolase MTH1 reveal the mechanism for its broad substrate specificity. Journal of Biological Chemistry 292, 2785–2794 (2017).
4) T. Nakamura, et al., X-ray structure analysis of human oxidized nucleotide hydrolase MTH1 using crystals obtained under microgravity. Int. J. Microgravity Sci. Appl. 36, 360103 (2019).
5) T. Nakamura, et al., Protonation states of Asp residues in the human Nudix hydrolase MTH1 contribute to its broad substrate recognition. FEBS Lett 597, 1770–1778 (2023).
6) T. Nakamura, Y. Zhao, Y. Yamagata, Y. Hua, W. Yang, Watching DNA polymerase η make a phosphodiester bond. Nature 487, 196–201 (2012).
7) T. Nakamura and Y. Yamagata, Visualization of mutagenic nucleotide processing by Escherichia coli MutT, a Nudix hydrolase. Proc Natl Acad Sci U S A 119, e2203118119 (2022).
論文情報
論文名:Neutron and time-resolved X-ray crystallography reveal the substrate recognition and catalytic mechanism of human Nudix hydrolase MTH1
著者:Keisuke Hirata# (#共第一著者), Kana Fujimiya#, Andreas Ostermann, Tobias E. Schrader, Takeshi Hiromoto, Masataka Goto, Takao Arimori, Yu Hirano, Katsuhiro Kusaka, Taro Tamada, and Teruya Nakamura (責任著者)
掲載誌:Proceedings of the National Academy of Sciences of the United States of America:PNAS
DOI:10.1073/pnas.2510085122
URL:https://www.pnas.org/doi/10.1073/pnas.2510085122
