発表のポイント
- α線がん治療薬に対して特異的に応答するがん細胞の遺伝子を発見
- これらの遺伝子の応答を手掛かりに、より正確で効果的な診断・治療が可能に
- 診断と治療を融合した効率的ながん治療法「セラノスティクス」の発展に貢献
国立研究開発法人量子科学技術研究開発機構(理事長 平野俊夫、以下「量研」)量子ビーム科学研究部門高崎量子応用研究所の坂下哲哉上席研究員・大島康宏主任研究員・横田裕一郎主幹研究員、慶應義塾大学先端生命科学研究所(所長 冨田勝)の荒川和晴准教授・河野暢明特任講師らは共同で、α線がん治療薬211At-Mabg(アスタチン211-メタアスタトベンジルグアニジン)1)の治療や診断の新たな指標となる遺伝子候補を世界で初めて発見しました。
α線がん治療は、全身に転移したがんにも威力を発揮するがん治療法として注目されています。量研では、ヒトへの臨床応用を目指して、α線がん治療薬の開発を進めています。2016年には加速器で製造した211Atで標識したノルアドレナリン類似体211At-Mabgの開発に成功しました(2016年6月プレスリリース)。本研究チームは、この新しいα線がん治療薬が悪性褐色細胞腫がん細胞に高い治療効果を示すことをマウス実験により確認し、その治療メカニズムの解明に役立つ生体指標(バイオマーカー2))の探索に取り組みました。そして今回、最新の遺伝子解読技術(RNAシーケンス解析3))を利用して全遺伝子の発現量変化を測定することで、α線がん治療薬211At-Mabgに対して特異的に応答する4つの遺伝子を特定しました。
α線は体外からは測定できないため、α線がん治療薬が狙い通りにがん細胞に届いて作用しているかの診断は困難でした。今回特定した遺伝子の中にはPETなどの放射線イメージング法と組み合わせて体の外からその応答を可視化できるものもあり、それを指標として正確な診断が可能になります。他の遺伝子も、それぞれがん細胞の死滅や転移などに関わることが知られており、最適ながん治療法の選択や新たながん治療法の開発に役立つと期待されます。
現在、治療しながら診断も行う効率的ながん治療法としてセラノスティクス4)が注目されています。本成果は、α線がん治療におけるセラノスティクスの発展に貢献すると期待され、セラノスティクスの国際的な専門誌Theranostics誌に2019年2月27日(水曜日)にオンライン掲載されます。
1 研究の背景と目的
セラノスティクス(Theranostics)4)は、治療(Therapy)と診断(Diagnosis)を融合した効率的ながん治療法として注目されています。現在、治療と診断を同時に行う放射性医薬品の開発が活発に進められています。その一方、セラノスティクスの発展のため、がん治療の効果や診断精度を向上させる生体指標(バイオマーカー1))の探索も重要な研究課題となっています。特に、α線放出核種を用いたがん治療薬の開発は、現在、スタートしたばかりであり、体外からの診断が難しいなどの課題を克服するため、新たな指標の探索が強く望まれている状況です。
量研は、これまでに、加速器を用いて製造したα線を放出する核種211Atを標識した211At-Mabg(アスタチン211-メタアスタトベンジルグアニジン)1)の開発に成功し、ヒトでの臨床応用を目指しています。211At-Mabgに特異的なバイオマーカーを見つけることができれば、α線がん治療薬211At-Mabgの治療効果や診断精度を向上させることに繋がるのではないかと研究チームは考えました。
211At-Mabgに特異的なバイオマーカーを見つける手法として、近年発達が著しい次世代シーケンス技術を用いたRNAシーケンス解析(全遺伝子の発現変動解析)3)に着目しました。これまでにも、α線がん治療薬の細胞応答については、マイクロアレイ5)を用いた研究が数例行われていますが、効果的なバイオマーカーの発見には至っておりません。そこで、本研究では、より感度の高い遺伝子解読技術であるRNAシーケンス解析を用いて、211At-Mabgの治療効果の予測と向上に役立つ指標遺伝子を探索することを、研究の目的としました。
2 研究の手法と成果
211At-Mabgを合成し、褐色細胞腫の細胞株Pc-12に処置して、RNAシーケンス解析を、処置直後から3, 6, 12時間後に実施しました。また、α線の特異的応答であることを調べるため、基準放射線として知られる60Coγ線の照射と未処理の細胞培養を比較対象として実施し、α線がん治療薬211At-Mabgに特異的に発現変動する遺伝子の探索を行いました。
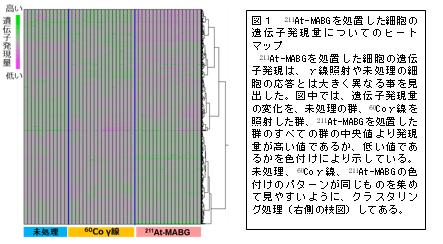
その結果、211At-Mabgを処置した細胞の遺伝子発現の応答は、γ線照射や未処理の細胞の応答とは、大きく異なることが分かりました(図1)。
そして、有意に変動した211At-Mabgによる特異的な数千の遺伝子発現応答のうち、発現量、実験条件等により最も顕著に変動した161遺伝子を、統計的に絞りこみました。それらの中で、特に、上位にランクし、かつ効果的なバイオマーカーと考えられる遺伝子を、1つずつ丹念に放射線との関連など各種文献等を用いて調べました。最終的に、研究チームとして4つの211At-Mabgに特異的な指標候補遺伝子(Otub1, Mien1, Vdac1, Vegfa)を選定しました(図2)。いずれも、γ線照射や未処理細胞と比べて著しく高い発現を示すとともに、低濃度の211At-Mabgの投与初期から発現量が増加し、持続的な応答を示します。
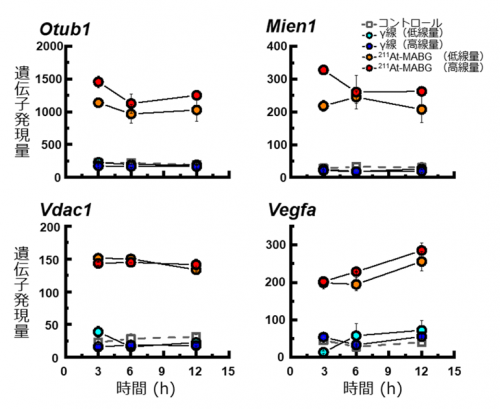
図2 4つの211At-Mabg特異的に応答する指標候補遺伝子(Otub1, Mien1, Vdac1, Vegfa)の遺伝子発現量の変化
いずれの遺伝子においても、γ線照射や未処理細胞と比べて著しく高い発現を示すとともに、低濃度の211At-Mabgの投与初期から発現量が増加し、持続的な応答を示すことから、指標として適した応答を示しています。図中で、211At-Mabg処置細胞の低線量(80%生存率)、高線量(10%生存率)の遺伝子発現量の変化を、各々赤丸実線、橙色実線で、未処理細胞の遺伝子発現量の変化を白抜き四角点線、60Coγ線照射細胞の低線量(80%生存率)、高線量(10%生存率)の遺伝子発現量の変化を、各々青色丸実線、空色丸実線で示しています。縦軸は、遺伝子発現量の相対値を、横軸は、処置、照射後の時間を表しています。
最適ながん治療法の選択や新たながん治療法の開発に役立つ遺伝子
タンパク質の分解を抑制するOtub1遺伝子6)は、がん抑制タンパク質p53の分解を抑えてp53の働きを安定化させることによりがん細胞の殺傷を促進する一方、がん細胞同士の接着を減らすことにより転移にも関係することが、報告されています(図3)。がん細胞の遊走を促進するMien1遺伝子7)は、転移促進に関係することが知られています(図3)。これらの遺伝子の働きを高めたり、弱めたりすることにより、がん治療法の選択や新たながん治療法の開発に役立つ可能性があります。
α線がん治療薬が狙い通りに細胞に届き作用しているかを診断可能な遺伝子
Vdac1遺伝子8)は、ミトコンドリア膜上のチャネル(膜内外の連絡通路)に対応する遺伝子です。この産物であるVdac1タンパク質8)は、ミトコンドリア膜において、Tspoタンパク質9)、Antタンパク質9)と複合体を形成し、細胞内の酸化ストレスの程度に応じて、アポトーシス等をコントロールすると考えられています(図3)。特に、Tspoは神経炎症のマーカーとして知られており、PET核種を標識した放射性診断薬が多数開発されています。量研においても、タンパク質発現量とPETイメージングシグナルの相関が良い定量性に優れた放射性診断薬が開発されています。211At-Mabgを処置したPc-12細胞では、数時間後から24時間後にかけて顕著なTspoタンパク質発現量の増加を示すことを観察しました。
血管内皮増殖因子の1つであるVegfa遺伝子10)は、がんの血管新生に関わる遺伝子で、従来、腫瘍マーカーとして良く知られた遺伝子です(図3)。
これらの遺伝子の産物であるタンパク質の放射線イメージング等を行うことにより、α線がん治療薬が狙い通りに細胞に届き作用しているかを診断できる可能性があります。
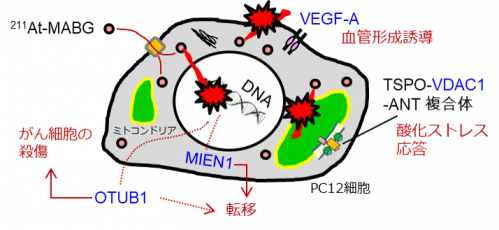
図3 がん治療効果の予測と向上に役立つ4つの指標候補遺伝子の働き
タンパク質の分解を抑制するOtub1遺伝子ががん細胞の殺傷と転移に、がん細胞の遊走を促進するMien1遺伝子が転移に関わることが知られています。ミトコンドリア膜上のチャネルをコードするVdac1遺伝子は酸化ストレス応答に関係し、血管内皮増殖因子の1つであるVegfa遺伝子は、血管形成誘導にかかわる事が知られています。Otub1遺伝子とMien1遺伝子は治療効果の向上(治療)に、Vdac1遺伝子とVegfa遺伝子は、放射線イメージング等による効果の予測(診断)に役立つ可能性があります。
3 今後の展開
がん細胞に対するRNAシーケンス解析により、α線がん治療薬211At-Mabgに特異的な“がん細胞の殺傷、転移、酸化ストレス応答、血管形成誘導”に関わる4つの指標遺伝子を発見しました。今回特定した遺伝子の中に、PETなどの放射線イメージング法と組み合わせて体の外からその応答を可視化できるものがあり、それを指標として正確な診断が可能になります。他の遺伝子も、それぞれがん細胞の死滅や転移などに関わることが知られており、最適ながん治療法の選択や新たながん治療法の開発に役立つと期待されます。がん細胞を用いて得られた本成果を、今後は、マウスで実証し、将来のヒトの臨床応用に向けて取り組みたいと考えています。
現在、治療しながら診断も行う効率的ながん治療法としてセラノスティクスが注目されています。本成果は、α線がん治療におけるセラノスティクスの発展に貢献すると期待されます。
4 用語解説
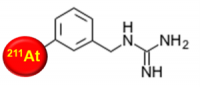
1) 211At-Mabg(アスタチン211-メタアスタトベンジルグアニジン)
ノルアドレナリンと似た化学構造を有するベンジルグアニジンという物質に、211Atを標識した化合物です。211At-Mabgは、褐色細胞腫がノルアドレナリンを積極的に取り込む細胞膜の通路を利用し、ノルアドレナリンと同様に褐色細胞腫細胞に取り込まれます。
2) バイオマーカー
病気や治療の状態を客観的に測定し評価するための指標。疾患を特定するための診断マーカー、経過を予測するための予後マーカー、薬剤が作用するかどうかを診る薬力学マーカー、治療による効果を予測する予測マーカーなど、多様なバイオマーカーがある。個別化医療や新薬開発において、多様なマーカーの開発が進められています。
3) RNAシーケンス解析
細胞内で遺伝子が機能するためには、まずゲノムから特定の遺伝子の配列をMrnaという分子に「転写」し、それを元にタンパク質へと「翻訳」するという、「発現」というプロセスを経ます。超並列DNAシーケンサーを用いて、細胞内Mrnaの逆転写産物(RNAを読み取りできるようにDNAに変換したもの)を網羅的に配列決定し、遺伝子ごとに数を数えることで、どの遺伝子がどれだけ転写されているか、を調べることができます。実際に転写物の相対的な「数」がわかるため、統計処理後に感度良く遺伝子の発現量を調べることができます。また、特にがん細胞中では遺伝子に変異が入ることが知られていますが、配列決定を伴うため、変異の検出も同時に可能です。
4)セラノスティクス
セラノスティクスは、診断と治療を融合した効率的ながん治療法として注目されています。核医学のがん治療における代表的なセラノスティクスの治療法は、甲状腺がんの放射性ヨウ素内用療法です。放射性ヨウ素(131I)は、画像診断に用いるγ線と治療効果が期待できるβ線を放出するため、診断と治療を同時に行うことが可能です。また、セラノスティクス分野では、治療効果を高めたり、診断精度を向上させたりすることが可能な標的バイオマーカーの探索も重要な課題となっています。
5) マイクロアレイ
DNAチップとも呼ばれ、細胞内の遺伝子発現量を測定するために、多数のDNA断片をプラスチックやガラス等の基板上に高密度に配置した分析器具。あらかじめ塩基配列の明らかな1本鎖のDNAを多種、基板上に配置しておき、これに検体を反応させれば、検体のDNA配列と相補的な塩基配列の部分にのみ検体のDNA鎖が結合する。
6) Otub1遺伝子
細胞内タンパク質の分解を抑制することに関わる遺伝子で、がん抑制タンパク質p53の分解を抑えることにより、がん細胞の殺傷を促進します。その一方、がん細胞同士の接着因子であるカドヘリンを減らすことにより転移にも関係すると報告されています。
7) Mien1遺伝子
がん細胞の遊走を促進する遺伝子で、アクチン骨格の再構築によりがん細胞の接着性を変化させることにより転移促進に関係することが知られています。
8) Vdac1遺伝子、Vdac1タンパク質
ミトコンドリア膜上のチャネル(膜内外の連絡通路)に対応する遺伝子です。この産物であるVdac1タンパク質は、ミトコンドリア膜において、Tspoタンパク質9)、Antタンパク質9)と複合体を形成し、細胞内の酸化ストレスの程度に応じて、自発的な細胞死等をコントロールすると考えられています。
9) Tspoタンパク質、Antタンパク質
ミトコンドリア膜に局在するタンパク質。これら2つのタンパク質は、同じくミトコンドリア膜に局在するVdac1タンパク質8)等と協調して働くことにより、ミトコンドリア膜の透過性を変えるだけでなく、自発的な細胞死、酸化ストレス応答など、多様な機能を発揮すると考えられています。
10) Vegfa遺伝子
血管内皮増殖因子には、Vegf-Aの他に複数の因子が存在し、全体としてVegfファミリーと呼ばれています。それらの1つであるVegfa遺伝子は、がんの血管新生に関わる遺伝子であり、Vegfタンパク質の産生により血管を腫瘍に引き込み、栄養や酸素を取り込む働きがあります。そのため、腫瘍マーカーとして良く知られた遺伝子です。
5 論文について
Anti-tumor Effects and Potential Therapeutic Response Biomarkers in α-Emitting meta-211At-Astato-Benzylguanidine Therapy for Malignant Pheochromocytoma Explored by RNA-sequencing, Theranostics
Yasuhiro Ohshima1, Nobuaki Kono2, Yuichiro Yokota1, Shigeki Watanabe1, Ichiro Sasaki1, Noriko S. Ishioka1, Tetsuya Sakashita1, Kazuharu Arakawa2,3
1Department of Radiation-Applied Biology Research, Quantum Beam Science Research Directorate, National Institutes for Quantum and Radiological Science and Technology, 1233 Watanuki, Takasaki, Gunma 370-1292, Japan.
2Institute for Advanced Biosciences, Keio University, 246-2 Mizukami, Kakuganji, Tsuruoka, Yamagata, 997-0052, Japan
3Faculty of Environment and Information Studies, Keio University, 5322 Endo, Fujisawa, Kanagawa, 252-0882, Japan