発表のポイント
- 精製タンパク質と光熱変換顕微鏡法を用いて筋収縮機能の温度特性を評価する顕微解析法を構築
- 筋肉が温まると収縮する「加熱筋収縮」を4種類の精製タンパク質のみで再現することに成功
- 心臓が体温において効率的に拍動できるメカニズムの一端を解明
概要
早稲田大学大学院先進理工学研究科博士後期課程(研究当時)の石井秀弥(いしいしゅうや、現東京慈恵会医科大学博士研究員)、国立研究開発法人量子科学技術研究開発機構主任研究員の大山廣太郎(おおやまこうたろう)(兼 JSTさきがけ研究者)、中部大学生命健康科学部助教の新谷正嶺(しんたにせいね)、東京慈恵会医科大学准教授の福田紀男(ふくだのりお)、ならびに早稲田大学名誉教授の石渡信一(いしわたしんいち)の研究グループは、シンガポール科学技術研究庁(A*STAR)、と大阪大学の研究者たちと共同で、筋収縮機能の温度特性を評価する顕微解析法を構築し、心臓が体温において効率的に拍動できるメカニズムの一端を解明しました。
我々哺乳類の筋肉は、まず細胞の中でカルシウムイオンの濃度が上昇し、次に筋肉を動かすスイッチの役目を担うタンパク質がONになることで、力が生まれて収縮します。本研究グループはこれまで、短時間の加熱(熱パルス)によって筋肉の細胞が収縮することを発見・報告し、この新しい「加熱筋収縮」では、カルシウムイオン濃度の上昇が伴わないことを示してきました。しかし、なぜカルシウムイオン無しでも、熱だけで収縮できるのか、詳細な仕組みを十分に証明できていませんでした。またカルシウム濃度でON/OFFが制御される筋肉にとって、「加熱筋収縮」が優位に働いているのかどうかも不明でした。そこで今回、本研究グループは「加熱筋収縮」の起きる仕組みをタンパク質分子の働きから証明するため、筋肉の主要なタンパク質を精製し、筋収縮の温度特性を精密に評価できる顕微解析法を新たに開発しました。その結果、4種類のタンパク質のみを用いて「加熱筋収縮」を再現することに成功しました。さらに、哺乳類の心臓には、体温を利用し、カルシウムイオン濃度上昇に応じて効率よく収縮する仕組みが備わっていることを示唆する知見を得ました。
本研究はJSPS科学研究費、JSTさきがけ、日本心臓財団などの助成を受けて行われたもので、研究成果は「Journal of General Physiology」に2019年4月22日(アメリカ東海岸時間)にオンライン掲載される予定です。これにともない本研究成果の報道解禁を日本時間2019年4月23日(火)正午(12時)以降といたします。ご協力、よろしくお願いいたします。
(1)これまでの研究で分かっていたこと
私たちの心臓の筋肉(心筋)や手足を動かすための筋肉(骨格筋)の動き(収縮)は、筋肉の細胞に届く電気的な刺激によって、細胞内カルシウムイオン(Ca2+)濃度が一時的に上昇(Ca2+トランジェント)することで始まります。この筋収縮は、筋肉に含まれる、2種類の主要なタンパク質フィラメントが互いに滑り運動することで起こり、これらのフィラメントはそれぞれ、アクチン分子を主とする「アクチンフィラメント」に「トロポニン・トロポミオシン複合体」などが結合した「細いフィラメント」と、ミオシン分子を主とする「太いフィラメント」とよばれます。筋肉が弛緩しているとき細胞内Ca2+濃度は低く、細いフィラメントを構成するトロポニン・トロポミオシン複合体がアクチンフィラメントとミオシン分子の相互作用を阻害しています(スイッチがOFFの状態)。Ca2+トランジェントは、この筋収縮のスイッチを担うトロポニン・トロポミオシン複合体に作用し、アクチンフィラメントにミオシン分子が結合できる状態(スイッチがONの活性化状態)にすることで、筋収縮を誘導します。
このような教科書に記述される生理的ステップ以外にも、筋収縮を誘導するメカニズムがありうることを、本研究グループはこれまでに報告してきました。ラットから調製した心筋細胞が0.2~0.5秒間だけの加熱(熱パルス)に応答して、Ca2+トランジェントを起さずに収縮する「加熱筋収縮」現象を発見・報告しています(Oyama et al., Biochem. Biophys. Res. Commun. 2012)。Ca2+トランジェントを介さない点において、加熱筋収縮には、電気的興奮による生理的収縮とは異なる収縮誘導メカニズムがあると考えられます。この加熱筋収縮は、心筋細胞に限らず、骨格筋でも生じうることが報告されています(Marino et al., 2017;過去のプレスリリース「光をあてたナノ粒子から出る「熱」で、筋肉をワイヤレスに活性化する新手法を開発」)。
私たちの体温は1日の中で変化し、体の部位ごとにバラツキもありますが、おおむね一定に保たれています。体温と、加熱筋収縮現象、そしてCa2+で誘導される筋肉の収縮。この3者に、何か関係はあるのでしょうか。
(2)今回の研究で新たに実現しようとしたこと、明らかになったこと
本研究グループは「加熱が細いフィラメントを活性化状態へシフトさせる」ことが加熱筋収縮の本質であると提案してきたものの、多種多様なタンパク質が共存する細胞実験においてこれを実証することは困難でした。今回、本研究グループは、加熱筋収縮を4種類の精製タンパク質のみで再現することに成功しました。それだけにとどまらず、得られたデータを詳細に解析することによって、体温が細いフィラメントを部分的に活性化する効果を持っていることを明らかにしました。
(3)そのために新しく開発した手法
本研究では、精製タンパク質だけでガラス基板上に筋収縮を再現できる「in vitro 滑り運動系」を利用しました。本研究グループは今回、ウサギ骨格筋アクチン、ヒトαトロポミオシン、ウシ心筋トロポニンで細いフィラメントを再構成し、ウサギ骨格筋またはブタ心筋由来のミオシン分子を接着させたガラス基板を用いました。この再構成した細いフィラメントは直径が10ナノメール程度のため、そのままでは見ることができません(1ナノメートルは1ミリメートルの百万分の一)。そこで蛍光顕微鏡で観察できるように、蛍光色素で標識してあります。一本一本のタンパク質フィラメントの動き(滑り運動)を蛍光顕微鏡で観察して、移動速度を解析しました。ここに、水に吸収される波長帯の赤外レーザー光を対物レンズで集光することで、水中に微小な熱源を生み出すことができる、光熱変換顕微鏡(Oyama et al., Lab Chip 2012;過去のプレスリリース「細胞内を歩くナノ温度計を開発 ミクロンサイズの細胞内小器官内部の温度変化を世界で初めて測定」)を組み合わせました。
こうして、精製タンパク質を用いて筋収縮機能の温度特性を評価できる顕微解析法を新たに構築しました(図1)。この局所光加熱法の特徴は、レーザー集光点を中心に100マイクロメートル程度の範囲へ、最高約20℃の同心円状の温度勾配を形成することにあります。それによって、光学顕微鏡の同一視野内で、様々な温度のもとで動き回るフィラメントを一度に観察できます。もう一つの特徴は、加熱用レーザー光照射中の局所的な温度勾配の形成と、照射終了後に温度勾配が消失する過程が約1秒で完了する点です。加熱用レーザー光の照射を素早く切り替えることで、同じフィラメントに着目したまま、温度特性を連続的に評価することができるようになりました。
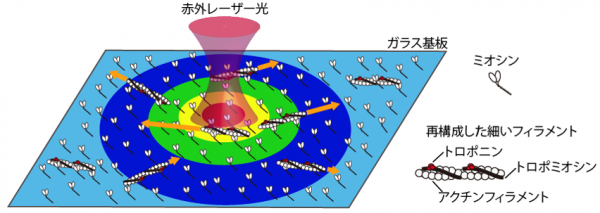
図1:本実験系の模式図
(4)今回の研究で得られた結果及び知見
筋肉が弛緩する低Ca2+濃度では、トロポニン・トロポミオシン複合体のスイッチがOFF状態のため、再構成した細いフィラメントの滑り運動は加熱前(25˚C)では観察されません。そこに赤外光を集光して加熱を与えると、細いフィラメントの滑り運動が開始しました。これは、本研究グループがこれまでに報告してきた加熱筋収縮を再現する結果でした。さらにフィラメントの動きをよく観察すると、熱源に近いほど(温度が高いほど)速く、光加熱を終えて温度が元に戻るとすぐに停止しました。そこで、滑り運動の温度特性を、厳密に評価しました。その結果、体温付近の温度(37˚C前後)まで加熱しているときにも滑り運動が観察され、その速度は100%活性化したときの3割程度であることが分かりました。この結果は、細いフィラメントは体温付近において低Ca2+濃度であっても部分的に活性化されており、Ca2+トランジェントに応じて効率よく筋収縮を起せる状態にあることを示唆しています。
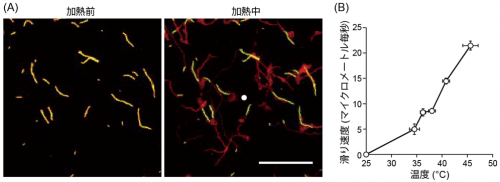
図2:(A)低Ca2+濃度における加熱前(25˚C)(左)および加熱中(右)における細いフィラメントの滑り運動の様子。緑は撮影開始時のフィラメント、赤は加熱前および加熱中2秒間での各フィラメントの軌跡を示す。緑と赤が重なる点は黄色になる。加熱前(左)で全てのフィラメントが黄色なのは、滑り運動していないことを示す。白丸は熱源(レーザー集光点)。スケールバーは20マイクロメートル(マイクロメートルは1ミリメートルの千分の一)。(B)光熱変換顕微鏡で調べた、低Ca2+濃度における細いフィラメントの滑り運動速度の温度依存性。ウサギ骨格筋ミオシンの場合。
(5)研究の波及効果や社会的影響
本研究は、「体温が細いフィラメントを活性化状態へシフトさせる」という新しい視点から、生体内の心筋がCa2+濃度変化に効率よく応答して収縮できる仕組みを示したものです。この成果は、心臓における体温の生理学的意義の理解を深めるとともに、温度に着目した新しい治療法の開発への展望を開きます。たとえば、制御系タンパク質における変異は心筋のCa2+感受性を下げ、十分な収縮力が発揮できない拡張型心筋症の原因になることが知られています。そのような弱い心筋収縮を適切な強度とタイミングで加熱することで正常な収縮力を維持する技術が確立されれば、副作用の少ない、画期的な新しい治療法への道が開けるかもしれません。
(6)今後の課題
本研究は心臓のトロポニン・トロポミオシンで構成される細いフィラメントを用いて行いました。同様に、骨格筋タンパク質で構成した細いフィラメントを用いた詳細な解析から、骨格筋の2つの役割である筋収縮と熱産生の相乗効果(例えば運動前のウォーミングアップが細いフィラメントを活性化することで筋肉のパフォーマンスを高めている可能性)に関する知見が得られるかもしれません。また、体温の違う動物や、環境に応じて体温が大きく変化する動物といった、様々な特徴の動物に由来するタンパク質を用いることで、動物の筋肉が、それぞれの生育環境において周囲の温度や体内の温度を有効利用している可能性を評価できると期待できます。
(7)用語説明
in vitro 滑り運動系
制御タンパク質を含めて、アクトミオシンの運動・制御特性を調べるための手段として広く用いられている実験系です。ガラス基板上でアクトミオシン収縮システムを再構成し、光学顕微鏡を用いてタンパク質一分子レベルで滑り運動の様子を観察することができます。最も広く用いられているのは、滑り運動の速さから各条件におけるアクトミオシンの活性を調べることです。また、他の技術と組み合わせることが多く、本研究では赤外(IR)レーザーを利用する局所熱パルス法を組み合わせました。
(8)論文情報
雑誌名:Journal of General Physiology
論文名:Microscopic heat pulses activate cardiac thin filaments
執筆者名:Shuya Ishii (石井秀弥) *1, Kotaro Oyama (大山廣太郎) *1, *2, *3, *4, Tomomi Arai (新井智実) *1, *2, Hideki Itoh (伊藤秀城) *1, *5, Seine A. Shintani (新谷正嶺) *6, Madoka Suzuki (鈴木団) *4,7, Fuyu Kobirumaki -Shimozawa (小比類巻生) *2, Takako Terui (照井貴子) *2; Norio Fukuda (福田紀男) *2, Shin'ichi Ishiwata (石渡信一) *1
著者所属(研究当時):*1:早稲田大学、*2:東京慈恵会医科大学、*3:国立研究開発法人量子科学技術研究開発機構、*4:JSTさきがけ、*5:シンガポール科学技術研究庁(A*STAR)、*6:中部大学、*7:大阪大学
注:3月28-31日に神戸国際会議場で開催された第9回FAOPS会議(アジア・オセアニア生理学会連合大会)で、石井秀弥がJGPポスター賞を受賞しました。
Journal of General PhysiologyのSNSアカウントでも写真付きで報じられています。
JGP Twitterアカウント: https://twitter.com/jgenphysiol
JGP Facebookアカウント: https://www.facebook.com/JGenPhysiol/
(9)引用文献
- Marino, A.*, Arai, S., Hou, Y., Degl’Innocenti, A., Cappello, V., Mazzolai, B., Chang, Y.T., Mattoli, V., Suzuki, M.*, and Ciofani, G.* (*Corresponding authors), ACS Nano, 11(3), 2494–2508 (2017), Gold Nanoshell-Mediated Remote Myotube Activation.
- Oyama, K., Mizuno, A., Shintani, S.A., Itoh, H., Serizawa, T., Fukuda, N., Suzuki, M.* and Ishiwata, S.* (*Corresponding authors), Biochem. Biophys. Res. Commun., 417, 607-612 (2012), Microscopic heat pulses induce contraction of cardiomyocytes without calcium transients.
- Oyama K, Takabayashi M, Takei Y, Arai S, Takeoka S, Ishiwata S.* Suzuki M.* (*Corresponding authors), Lab Chip. 12(9):1591-1593 (2012), Walking nanothermometers: spatiotemporal temperature measurement of transported acidic organelles in single living cells.
(10)関連する過去のプレスリリース
- 光をあてたナノ粒子から出る「熱」で、筋肉をワイヤレスに活性化する新手法を開発
- 細胞内を歩くナノ温度計を開発 ミクロンサイズの細胞内小器官内部の温度変化を世界で初めて測定
【研究内容に関するお問合せ先】
- 東京慈恵会医科大学細胞生理学講座准教授 福田紀男
Tel : 03-3433-1111(内線: 2221) E-mail: noriof@jikei.ac.jp
- 早稲田大学名誉教授 石渡信一
E-mail:ishiwata@waseda.jp
【報道・プレスリリースに関するお問合せ先】
- 早稲田大学広報課 猪俣・富田
Tel: 03-3202-5454 E-mail: koho@list.waseda.jp
- 国立研究開発法人量子科学技術研究開発機構 経営企画部広報課 中
Tel: 043-206-3026 E-mail: info@qst.go.jp
- 東京慈恵会医科大学広報課 豊田
Tel: 03-3433-1111 E-mail: koho@jikei.ac.jp
- 中部大学学園広報部 佐久間
Tel: 0568-51-4465 E-mail: cuinfo@office.chubu.ac.jp
