発表のポイント
- 生体への放射線照射により発生する二次電子が及ぼすDNA分子の損傷プロセスは未だに解明されておらず、シミュレーションによる予測が切望されていた。
- 独自に開発した動的モンテカルロシミュレーションコードを用いた解析で、DNA損傷の複雑化を促進させる極低エネルギー二次電子の役割を解明した。
- 放射線により突然変異やがんを誘発する初期要因の解明を目指した研究への貢献が期待できる。
国立研究開発法人日本原子力研究開発機構(理事長 児玉敏雄)原子力基礎工学研究センターの甲斐健師研究副主幹らは、国立研究開発法人量子科学技術研究開発機構(理事長 平野俊夫)の渡邊立子上席研究員ら及び東京農工大学(学長 大野弘幸)の鵜飼正敏教授との共同研究により、放射線照射による突然変異の誘発や発がんの主要な原因となる遺伝子情報の変質に関する新たなプロセスをシミュレーションにより解明しました。
生体に放射線が照射され、遺伝子情報の担い手であるDNA分子が損傷した場合、そのほとんどは修復されますが、ごくまれに修復されにくいナノメートルレベルで局在化したDNA損傷(クラスター損傷1))が生じ、その結果遺伝子情報が変質すると考えられています。クラスター損傷により生じる化学的な変異部位についての正確な構造や生成のプロセスについては、未だ解明されていません。
本研究では、様々な放射線照射により生体内で生成される電子に注目し、細胞中のDNAとの相互作用に着目しました。DNA分子への電子線照射をナノメートルレベルで模擬する動的モンテカルロシミュレーションコード2)を開発し、クラスター損傷をもたらす電子の挙動の詳細なシミュレーションに初めて成功しました。この結果の解析から、照射した電子線と生体内で生じた極低エネルギー二次電子3)の作用により生成されたクラスター損傷が、修復酵素4)によりDNA二重らせんの切断(二本鎖切断)に変換され、その切断端の近傍に遺伝情報を担う塩基5)の損傷がもたらされていることを明らかにしました。極低エネルギー二次電子が生体内で遺伝子情報の変質に関与することを示した本結果は、放射線による突然変異やがんの誘発の初期要因を解き明かすための重要な役割を果たすものと期待できます。
今後は、放射線照射により生じる複雑なDNA損傷の定量的評価に必要な研究に展開する予定です。本成果は、2018年1月28日に英国王立化学会の『Physical Chemistry Chemical Physics』に掲載されました。
研究開発の背景と目的
細胞中のDNAが放射線にさらされると、DNAの二重らせんのうちの片鎖の切断(一本鎖切断)や二重らせんの完全な切断(二本鎖切断)、遺伝情報を担う塩基の酸化損傷など、様々なDNA損傷が生成されます。もし複数の損傷が同時に、DNA分子上の10 nm(ナノメートル)程度のごく狭い領域(100万分の1cmで、DNAの1~2らせんピッチに相当)に生じると、生体の持つ修復反応が困難となり、細胞死や突然変異・発がんなどの影響が誘発されると考えられていました。このようなナノメートルレベルに局在化した損傷は、クラスター損傷と呼ばれています。クラスター損傷を調べるための現在の主要な化学的手法では、DNAを構成する低分子に分解して分析を行うため、損傷が近接しているか否かといった空間情報が失われます。また、近年多く用いられている塩基損傷を特異的に認識する修復酵素を利用した生化学的な方法についても、クラスター損傷部位でDNAの立体構造の歪みが大きくなるほど酵素反応が起こりにくくなるため、クラスター損傷部位は検出できません。そのため、計算機を用いたシミュレーションによる、クラスター損傷の構造と生成プロセスの予測が切望されていました。
放射線が生体中へ入射した場合、生体を構成する物質との相互作用を通じて二次電子と呼ばれるエネルギーの低い数多くの電子が生じます。これらの二次電子は、細胞中のDNAと高い確率で相互作用を及ぼすことが知られています。従来の研究では、10 eV6)程度のエネルギーを持つ電子であってもDNAにある確率で損傷を与えることが指摘されていました。しかし、近年では解離性電子付着(DEA)7)と呼ばれる効果により、数eV程度の電子も鎖切断を誘発することが報告されました。さらに水和前電子8)と呼ばれるほぼ完全にエネルギーを失い1 eV以下となった電子であっても、解離性電子移行(DET)9)により、DNA分子中の塩基の損傷を誘発することが実験により明らかになりました。そのため、クラスター損傷の生成機構を解明するためには、これらの10 eV未満の低エネルギー電子が生成される初期の位置を正確に特定し、DEAやDETがクラスター損傷の誘発に関与するかを検討する必要があります。
本研究では、まず、比較的高いエネルギーの電子線(1 keV)を水中でDNAに照射する状況をコンピューター上で設定し、イオン化10)や電子的励起11)及びDEAによるクラスター損傷の誘発頻度を評価しました。そして、この反応で生じた二次電子によるDETを考慮することで、生体修復の起こりにくさ、及び損傷除去修復による付加的なDNAの分子鎖の切断を考慮した遺伝子情報の喪失過程のモデルを構築し、生体影響を誘発し得る初期要因について解析しました。
研究の手法
本研究では、高エネルギー電子や二次電子がエネルギーを失って0.025eV程度まで減速された熱化と呼ばれる状態まで電子挙動を計算機で追跡するための動的モンテカルロシミュレーションコードを独自に開発しました。負の電荷を持つ二次電子は、その生成に伴って生じる正電荷分子により静電相互作用(クーロン力)を受けます。特にエネルギーの小さい電子ほど、この効果は大きくなることが予想されます。そこで、クーロン力を計算に取り込むことで、過去の研究では一切考慮されてこなかった、自らの発生源となる正電荷を持つイオンへ低エネルギー電子が引き戻される詳細な挙動まで計算可能にしました。
実際のDNAの半径は約1 nmであるため、本研究ではDNAを横と奥行きがそれぞれ2 nmの断面を持つ長い直方体としてモデル化しました(図1)。この仮想DNA分子領域を縦方向(図1のy軸)に対して1 nmの空間メッシュで区切り、DNAモデルの単位ブロックとしました。このブロックは、3塩基対12)分のDNA分子を含む体積に相当します。このDNAモデルから40 nm離れた位置から初期入射放射線として1 keVの電子線を入射させました。
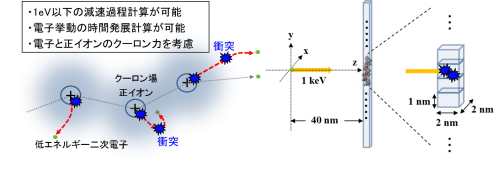
図1 本研究で開発したシミュレーションコードの特徴とシミュレーションに用いたDNAモデル。
得られた成果
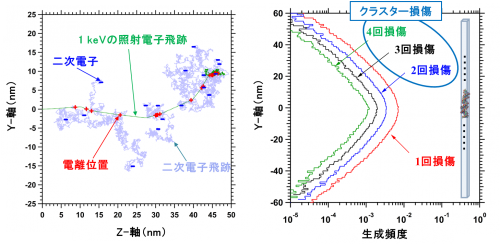
図2 左図は1 keV電子の進行に伴う反応過程(飛跡)を示し、右図はDNAの3塩基対以内に誘発される衝突頻度の計算結果を示しています。
図2(左)に1 keV電子線が生体中で次第にエネルギーを失う様子(飛跡)を示します。入射された1 keVの電子はエネルギーを失って完全に止まるまでに50 nm程度進み、その間にDNAや周囲の水と相互作用しながらイオン化や電子的励起などを繰り返し、数10 eV程度のエネルギーを持つ二次電子を数多く生成します。これらの二次電子の挙動は非常に複雑です。図2(右)に、図1の微小体積ブロック中における、イオン化や電子的励起及びDEAを誘発する1回の電子衝突反応(クラスター化せず孤立して生じた損傷に対応)と、2回以上衝突反応(クラスター損傷に対応)の頻度を示します。結果が示す通り2回以上の衝突頻度を足し合わせると、1回損傷の頻度と同程度にまでなることが分かりました。また、DNAの主鎖部位と塩基部位の電子との反応確率の違いから、クラスター損傷部位には一本鎖切断が高い確率で生じていることが予測されました。
図3(左)は、二次電子のエネルギー分布が時間経過に対し、どのように変化するかを示しています。これまで二次電子は、100 fs(100フェムト秒、1 fsは10-15秒)以内にエネルギーを失って熱化すると考えられていましたが、数100 fs経過しても熱化しないことが分かりました。図3(右)は、二次電子の空間分布の時間変化です。DNAとその周囲に存在する水の層も含めた約10 nm付近にも分布することが分かりました。水の層に移動した電子は水和前電子になり、塩基に効率よく損傷を引き起こすという最新の知見も考慮することで、塩基損傷のDNA上での位置を予測することができました。
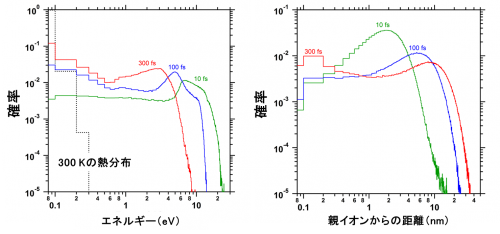
図3 左図は低エネルギー二次電子のエネルギー確率分布の時間変化を表し、右図はこれらの電子の空間確率分布の時間変化を表しています。
以上のシミュレーション結果を総合すると、図4(1)-(4)に示すような複雑なDNA損傷の生成プロセスと生体影響の関係が予測できます。
- 1 keVの電子線がDNA中を通過した場合、この時に発生した二次電子との衝突反応や正イオンのクーロン力で引き戻された二次電子により、半径1 nm(3塩基対)以内に一本鎖切断や塩基損傷(青い四角)からなるクラスター損傷が形成されます。一方、二次電子はさらに周囲の水分子と相互作用を繰り返し、10 nm程度の比較的離れた場所で水和前電子になり、塩基損傷を誘発します。
- (1)クラスター損傷部位はDNAの立体構造を歪めるため、修復酵素はこれらを修復できなくなる可能性が高くなります。(2)塩基損傷部位のごく近傍には他の損傷がないため、修復酵素が損傷塩基を速やかに除去し、DNA主鎖(図で下の鎖)に切れ込みが新たに入ります。
- この新たに生じた一本鎖切断が、最初の一本鎖切断の反対鎖(相補鎖)に生じた場合、DNAの熱運動のため二重らせんが分離し二本鎖切断が生じます。二本鎖切断が修復されない場合、細胞は死に至る重篤な損傷となります。
- 一方、通常細胞内では、二本鎖切断の修復を担う様々なタンパク質が協同して働くことで、その大部分は再結合することが実験的に分かっています。しかし、たとえこの二本鎖切断が修復された場合でも、塩基損傷などが残るため生体の正確な遺伝子情報が失われ、突然変異や発がんに繋がる可能性を示しています。
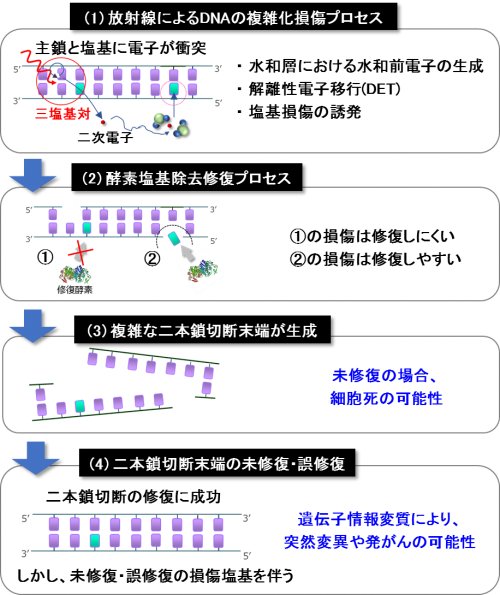
図4 本研究で予測した塩基損傷を伴う二本鎖切断の生成プロセスと生体影響の関係を示しています。
まとめ及び今後の予定
本研究のシミュレーションにより、低エネルギー電子とDNA修復酵素の両者が複雑に関わる分子プロセスが、DNA損傷の複雑化に寄与し、突然変異などの最終的な生体影響の違いを生み出していることを明らかにしました。特に、二本鎖切断末端に除去し切れなかった塩基損傷が含まれる場合、例え二本鎖切断が再結合して細胞が生存し、細胞分裂が行われても、損傷塩基のために正確な遺伝子情報が失われ、将来の細胞のがん化に繋がる可能性があると考えられます。本結果は、様々な放射線による突然変異やがんの誘発の初期要因に、生体内で生成する極低エネルギー二次電子が関与することを示した重要な研究成果です。今後は、放射線照射により複雑なDNA損傷が生成される割合を定量的に評価する研究へと展開する予定です。
用語説明
- クラスター損傷
DNA分子上の10 nm程度のごく狭い領域(DNAの1~2らせんピッチに相当)に一本鎖切断や塩基損傷が複数個生じたものをクラスター損傷と定義しています。その中でも特に、1nm以内に複数個の損傷が生じると修復効率が極端に減少することが人工合成DNA損傷を利用した実験的研究から分かっています。 - 動的モンテカルロシミュレーションコード
媒質中に照射された電子は、確率論的に衝突しながら減速していきます。そのため、一様乱数を利用しながら衝突位置を特定していきます。この様な計算手法を実施するコードをモンテカルロシミュレーションコードと呼びます。媒質中で電離が誘発されると、電離により二次電子が生成されますが、この二次電子は親イオンのクーロン場の影響を受けながら運動すると考えられます。この動力学的運動を考慮したコードを動的モンテカルロシミュレーションコードと呼びます。 - 二次電子
物質にエネルギーの高い電子が照射されると、原子との衝突で低エネルギーの電子が発生します。これを二次電子と呼びます。 - 修復酵素
生体には、DNAグリコシラーゼやAPエンドヌクレアーゼと呼ばれる、損傷したDNAの塩基(アデニン、グアニン、シトシン、チミン)を認識・除去する酵素があります。これらの酵素は塩基損傷を除去した後に、修復の次のステップに繋げるため一度DNAの鎖に切断(ニック)を入れます。これを利用して、塩基損傷部位を鎖切断に変換することで、電気泳動法などによる分子量や分子構造の変化として検出が可能となります。 - 塩基
DNAは主鎖とアデニン(A)、チミン(T)、グアニン(G)、とシトシン(C)の4種類の分子から構成されます。これら4種類の分子は塩基と呼ばれます。 - eV(エレクトロンボルト)
電子1個を1Vの電位差で加速したときに得るエネルギーで、1.6021766208(98)×10−19 [J]に相当します。 - 解離性電子付着(dissociative electron attachment(DEA))
低エネルギー電子(10 eV以下)が分子に衝突すると、一時的に電子が反結合性の軌道に取り込まれ、分子が負の電荷をもつイオン(アニオン)になった後に解離することがあります。これは解離性電子付着と呼ばれ、DNA分子に付着すると鎖切断が生じる場合があることが知られています。 - 水和前電子
水分子は中性であっても双極子という電荷の偏りを持ちます。そのため、液相のように水分子が集団で存在している系では、空間内に正電荷に弱く偏った位置が存在します。この正電荷に電子が弱く束縛された状態を水和前電子と呼び、エネルギーは0から-0.5 eV程度になります。この水和前電子はその周囲の水分子の配向分極が進むと強く束縛され水和電子になり、エネルギーは-3 eV程度になります。 - 解離性電子移行(dissociative electron transfer(DET))
解離性電子移行は水和前電子によりDNA分子の解離が誘発される現象です。これは、水中のDNAが-0.5 eV以下の領域に反結合性の電子軌道を持つためで、水和前電子が主にDNA分子の塩基に移行し、一時的に負の電荷をもつ塩基イオン(アニオン)になった後に解離します。 - イオン化
原子内の電子が、放射線のエネルギーを吸収して原子の束縛を振り切って離脱する現象をイオン化といいます。 - 電子的励起
原子内の電子が、放射線のエネルギーを吸収して原子に緩やかに束縛される現象を電子的励起といいます。分子の場合、この電子的励起が誘発されると、分子が解離することがあります。 - 塩基対
DNAの塩基は、A とT、G とCという決まった組を作り、それぞれの塩基が水素結合で繋がったものが塩基対です。
