成果のポイント
- マウスの脳に移植したiPS細胞1)由来神経前駆細胞2)が神経細胞に分化3)し、神経回路4)を形成する脳内動態を生体脳で直接可視化することに成功。
- 特定の薬剤だけが結合する人工受容体5)と分子画像技術(PET6)及びfMRI7))を融合させた世界初の技術により実現。
- 移植神経前駆細胞に由来する神経細胞の機能評価や、移植による神経難病治療メカニズムの解明に役立ち、再生医療を加速すると期待。
国立研究開発法人量子科学技術研究開発機構(理事長 平野俊夫)放射線医学総合研究所脳機能イメージング研究部は、国立大学法人京都大学iPS細胞研究所(CiRA)(所長 山中伸弥)と、マウスの生体脳内に移植したiPS細胞由来神経前駆細胞が神経細胞に分化し、脳内で神経回路を形成したことをイメージングする新しい手法を開発しました。
神経細胞死により引き起こされる神経難病の多くは根本的な治療法がなく、iPS細胞由来神経系細胞の移植による再生医療が次世代の治療法として期待されています。例えば、神経難病の一種であるパーキンソン病(PD)の治療研究では、PDモデルザルにおいてiPS細胞由来ドパミン神経前駆細胞の脳内移植により運動機能の改善が報告されています。しかし、移植されたiPS細胞由来の神経細胞が、移植後の脳内で神経回路を形成するかどうかといった機能的な評価を、生体を傷つけずに実施する手段はありませんでした。
そこで、人工受容体と呼ばれる、生体内には存在しない低分子化合物(クロザピン-N-オキシド:CNO)が選択的に結合するタンパク質を目印に、移植細胞から分化した神経細胞を生体内で直接可視化する方法を開発しました。本法では、CNOをポジトロン核種の11Cで標識したPET薬剤(11C-CNO)を合成し、神経細胞に分化したときに人工受容体タンパク質が発現するiPS細胞由来神経前駆細胞を作製しました。作製した細胞を脳の海馬8)に移植した正常マウスに11C-CNOを投与してその脳をPETで撮像し、11C-CNOの集積を画像化することにより、生体脳で分化した神経細胞を直接可視化しました。
また、人工受容体にCNOを作用させて脳活動を抑制したマウスの脳をfMRIで撮像した結果、海馬内の移植した場所とは別の領域で脳血流の低下が確認されました。これはiPS細胞由来神経細胞が他の領域の神経細胞との間に回路を形成したことを示唆します。
本成果は、iPS細胞の神経細胞への分化の評価だけでなく、人工受容体を操作することにより移植細胞が治療効果を発揮するメカニズムの解明や、治療効果の予後予測による治療方法の最適化に役立つことから、神経難病の再生医療を加速すると期待されます。
本研究は、日本医療研究開発機構(AMED)「革新的技術による脳機能ネットワークの全容解明プロジェクト」(平成27年度に文部科学省により移管)、科学研究費助成事業「新学術領域研究」、科学技術振興機構(JST)戦略的創造研究推進事業(CREST)における成果を一部活用したもので、北米神経科学学会の学会誌「The Journal of Neuroscience」2016年11月9日号に掲載されました。
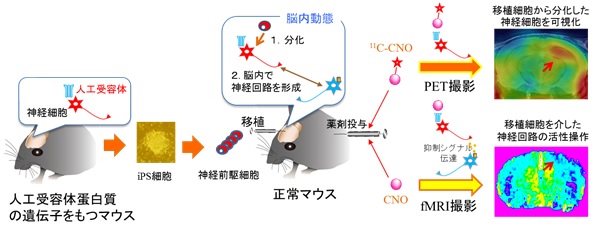
図1. 人工受容体を目印にしたiPS細胞由来神経前駆細胞から分化した神経細胞の脳内動態の画像化
脳内に移植されたiPS細胞由来神経前駆細胞は神経細胞へ分化し、脳内に元々存在する神経細胞と神経回路を形成して、機能します。完全に神経細胞までに分化させてから移植すると脳に生着しないため、神経細胞に分化する手前の神経前駆細胞にして移植します。
研究開発の背景と目的
アルツハイマー病やパーキンソン病などの神経難病では、神経細胞死により認知機能障害や運動障害が起こります。現在、根本的な治療法がなく、死滅した神経細胞の代わりに働くよう、iPS細胞などから分化させた神経系の細胞を移植する治療が次世代の治療法として非常に期待されています。例えば、パーキンソン病モデルザルでは、iPS細胞由来ドパミン神経前駆細胞の脳内移植により運動機能の改善が認められ、パーキンソン病治療にむけて研究が進められています。
しかし、脳内に移植された細胞がどの時期にどれだけ神経細胞になったか、または移植した神経細胞が脳内で神経回路を形成しているかなど移植細胞の脳内動態を生体で評価する手段はありませんでした。このため、殆どのケースで症状の変化だけを指標に細胞移植による治療法の開発が進められています。
細胞の動態を追跡するため、移植細胞に目印となる遺伝子を導入し、その遺伝子が働いたときに合成されるタンパク質を蛍光やPETなどで画像化する手法が開発されています。特に、高い感度と定量性を有し、低侵襲で、実験動物のみならずヒトにも応用できるPETによる移植細胞の画像化は世界中で開発が進められています。しかし、細胞の移植後の脳内動態を直接可視化した例はありません。
そこで本研究では、神経細胞に分化した場合にのみヒトムスカリン4人工受容体(hM4D)9)が発現する遺伝子改変マウス(hM4D-Tgマウス)から作製したiPS細胞を用いて、移植後のiPS細胞由来神経前駆細胞から分化した神経細胞をPETにより画像化し、移植先の脳細胞との神経回路形成をfMRIにより評価することを目的としました。
研究の手法と成果
まず、hM4Dだけに結合する薬剤クロザピン-N-オキシド(CNO)をポジトロン核種の11Cで標識したPET薬剤(11C-CNO)をhM4D-Tgマウスに投与して、PETで撮影することによりhMD4の画像化を試みました(図2-A)。その結果、免疫染色でhM4Dの存在が確認できた皮質と海馬を含む前頭部において、hM4D-Tgマウスでは正常マウスより高い11C-CNOの集積が認められました。一方、免疫染色でhM4Dの存在が確認されなかった小脳における11C-CNOの集積は正常マウスと同程度でした(図2-B)。これにより、11C-CNOを用いたPET撮影により、生体脳におけるhM4Dの発現を画像化できることを確認しました。
hM4DをCNOで活性化させると、抑制性神経伝達が行なわれて、神経細胞の活動性が低くなります。fMRIを用いてCNOを投与した後の脳内の血流量を計測しました。その結果、hM4D-Tgマウスでは前頭部に血流の低下が認められ、神経活動が抑制されたのに対し、正常マウスの同様な脳部位では脳血流の低下がなく、CNO投与は正常マウスの脳活動に影響がないことが示されました(図2-C)。これにより、CNO投与により、hM4D遺伝子を発現する神経細胞の機能を操作できることを確認しました。
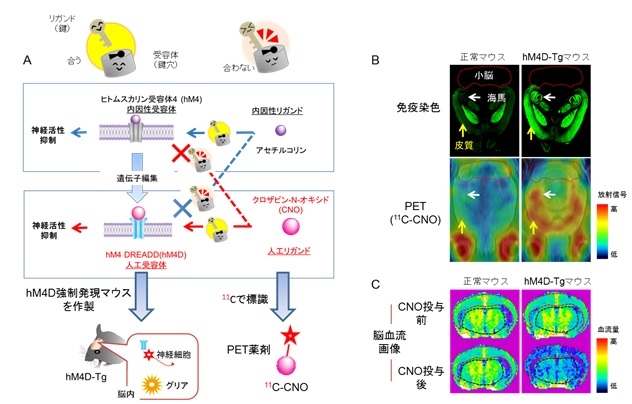
図2. ヒトムスカリン4人工受容体の生体イメージングと機能操作
A:
ヒトムスカリン4人工受容体(hM4 DREADD;hM4D)遺伝子は、元々生体にある内因性受容体ヒトムスカリン受容体4(hM4)遺伝子に変異が2カ所入っています。クロザピン-N-オキシド(CNO)はhM4Dにのみ作用する薬剤で、hM4DとCNOは鍵と鍵穴の関係となっており、両者が結合したときのみ、抑制性シグナル伝達が行われ、神経細胞の活動性が低下します。
本研究では、神経細胞だけにhM4D 遺伝子が発現する遺伝子改変マウスhM4D-Tgを作成しました。また、CNOをポジトロン核種11Cで標識して、hM4Dイメージング用PET薬剤11C-CNOを合成しました。
B:
hM4とhM4Dの両方に結合する抗hM4抗体を用いた免疫染色(上段)では、正常マウスに比べて、hM4D-Tgマウスでは海馬や皮質を含む前頭部において蛍光シグナルが強いことが確認できましたが、小脳部では顕著な差は認められませんでした。11C-CNOを用いたPET画像(中段)でも、正常マウスに比べて、hM4D-Tgマウスの前頭部ではPET薬剤の高い集積が認められましたが、小脳部には顕著な差は認められませんでした。(白矢印;海馬、黄矢印;皮質、赤点線で囲まれる領域;小脳)
C:
脳血流画像では、CNO(1mg/kg)の投与により、hM4D-Tgマウスでは皮質と海馬(赤点線で囲まれる領域)及びその近傍の視床(黒点線で囲まれる領域)を含む脳領域の血流が低下したのに対して、正常マウスでは血流に変化はありませんでした。
さらに、hM4D-Tgマウスの皮膚から作製したiPS細胞(hM4D-iPS細胞)由来神経前駆細胞を正常マウスの海馬内のCA3と呼ばれる領域に移植し、定期的にPETとfMRI撮影を行いました(図3-A)。
PET撮影の結果、hM4D-iPS細胞由来神経前駆細胞を移植した部位では移植40日後に11C-CNOの高い集積が認められました。hM4Dは神経細胞でのみ発現することから、hM4D-iPS細胞由来神経前駆細胞は、移植後40日前後で神経細胞に分化したと考えられます(図3-B)。
また、fMRI撮影の結果、CNO投与によって、hM4D-iPS細胞由来神経前駆細胞を移植した海馬のCA3領域だけでなくCA1領域でも脳血流の低下が認められました。通常、CA3領域の神経細胞が神経軸索を伸ばして、CA1領域の神経細胞と脳固有の神経回路を形成していることが知られています。よって今回の結果は、CA3領域に移植した神経細胞が、移植とは無関係なCA1領域の神経細胞と新たな神経回路を形成し、シグナル伝達が正常に行われたことを示していると考えられます(図3-C)。
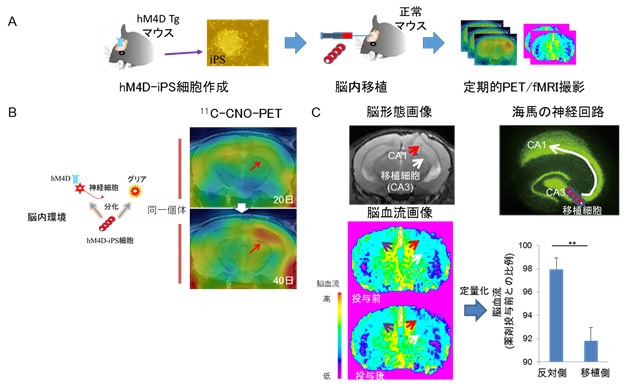
図3. iPS細胞由来神経前駆細胞から分化した神経細胞の可視化と機能操作による神経回路形成の検証
A:
hM4D-Tgマウスの皮膚から作製したiPS細胞(hM4D-iPS)由来神経前駆細胞を、正常マウスの海馬のCA3領域に移植し、定期的にPETとfMRI撮影を行いました。
B:
hM4D-iPS細胞由来神経前駆細胞は、移植後、グリア細胞など他の脳神経系の細胞に分化することもありますが、神経細胞に分化した場合のみhM4Dを発現します。hM4D-iPS細胞由来神経前駆細胞を移植した同一個体のマウスの脳の11C-CNO-PET画像では、20日(上段)は11C-CNOの集積が認められませんが、40日(下段)後では高集積が認められました。(赤矢印;iPS細胞の移植部位)
C:
iPS細胞由来神経前駆細胞が移植されたCA3領域(左図白矢印)と神経回路を有するCA1領域(左図赤矢印)の脳血流を定量した結果、反対側のCA1領域(左図紫矢印)に比べて、iPS移植側の血流がCNO投与により有意に低下しました(右下グラフ)。このことは、CA3領域に移植したhM4D-iPS細胞由来神経前駆細胞から分化した神経細胞がCA1領域とCA3領域を連結する脳固有の神経回路(右上図)に沿う形で、神経軸索を伸ばして、CA1領域にある神経細胞と新たな神経回路を形成しシグナル伝達を行ったことを示しています。
今後の展開
本技術を用いて、神経難病疾患モデル動物の脳に移植したiPS細胞由来神経前駆細胞が、いつ、どれだけ神経細胞に分化したかなど、脳内動態を生体で評価することが可能となります。また、移植した細胞の働きを、薬剤を用いて抑制または興奮させる操作を行った場合に、細胞移植によって改善した症状がどのように変化するかを調べることで、移植した細胞の機能が症状改善にどの程度貢献しているかを知ることができます。この技術は、人工受容体を操作することにより移植細胞が治療効果を発揮するメカニズムの解明と、治療効果の予後予測による治療方法の最適化、治療方針の決定判断に大きく役立つことから、神経難病の再生医療を加速させると期待されます。
また、hM4Dのような人工受容体は、ヒトの受容体遺伝子にわずかな変異を入れたもので、免疫拒絶反応が起きるリスクが低いとされています。そのため、欧米では側頭葉てんかん治療において脳の一部を摘出する従来の外科的治療の代わりに、人工受容体遺伝子による治療を用いる動きが加速しており、本技術はこのような遺伝子治療の開発への応用も見込まれます。
用語解説
1)iPS細胞
体細胞へ数種類の遺伝子等を導入することにより、非常に多くの細胞に分化できる分化多能性と、分裂増殖を経てもそれを維持できる自己複製能を持った細胞です。その分化多能性から、様々の組織臓器の細胞を自分の体細胞で作製することができます。
2)神経前駆細胞
神経前駆細胞は、神経細胞(ニューロン)もしくはグリア細胞へと分化する能力が有ります。
3)分化
細胞が特定の役割を持った細胞へと変化していくことを分化と言います。iPS細胞はある条件下で神経前駆細胞へと分化し、さらに神経前駆細胞は神経細胞やグリア細胞など、より専門的な細胞へと分化します。
4)神経回路
神経細胞は、細胞間に形成される接合部位とその構造(シナプス)を介して脳が働くための基盤である神経回路を作っています。神経回路ができるには、正しく分化した神経細胞が正しい場所に配置され、そこから正しい経路を伸びた神経突起が特定の標的と正しく結合する必要があります。海馬のCA1領域にある神経細胞の軸索がCA3領域に伸びて、CA3領域にある神経細胞と繋がることで形成される神経回路はよく知られている神経回路の1つです。移植されたiPS細胞が神経細胞に分化した後、元々生体にある移植先の神経細胞と神経回路を形成することが脳内神経機能を回復させる重要なプロセスと考えられています。
5)人工受容体
本来生体内に存在する受容体(内因性受容体)に数塩基の遺伝子変異を入れることにより作られた、本来生体にはない受容体です。神経のシグナル伝達は、神経伝達物質(リガンド)とそれが結合する受容体の結合により機能します。人工受容体の一種であるDREADD(Designer Receptors Exclusively Activated by Designer Drugs)は、生体内に存在するリガンドが結合することはなく、その人工受容体に結合する特定の人工リガンドのみが結合して、その活性が制御されます。この技術を用いることで、特定の神経細胞の機能を人工的に操ることが可能になります。
6)PET
陽電子断層撮影法(Positron Emission Tomography)の略称。特定の体の部位に集積したり体内物質に結合したりするポジトロン核種(11C、13N、15O、18F等)で標識したPET薬剤より放射される陽電子に起因する一対の対向するガンマ線を検出することによって、体深部に存在する生体内物質の局在や量を測定して画像化する方法です。
7)fMRI
磁気共鳴機能画像法(functional Magnetic Resonance Imaging)の略称、脳内の局所神経活動により変化した局所脳血流に伴って変化する磁場の信号強度を検出する技術です。
8)海馬
脳の記憶や空間学習能力に関われる脳領域で、神経細胞がわかりやすく並んでいるために、早くからその回路や神経細胞性質が明らかにされてきました。
9)ヒトムスカリン4人工受容体(hM4D:Human Muscarinic receptor 4 DREADD)
本来生体内に存在する内因性受容体アセチルコリン受容体の一種であるムスカリン4受容体(hM4)の遺伝子配列に2カ所変異を入れることで作製された人工受容体(DREADD)です。hM4はその内因性リガンドであるアセチルコリン(一種の神経伝達物質)と結合すると、抑制性神経伝達が行なわれて神経活動が低下します。hM4Dは遺伝子変異によりアセチルコリンとの結合性を失い、その代わりに生体にない人工リガンドクロザピン-N-オキシド(CNO)と結合します。内因性受容体と内因性リガンドが鍵穴と鍵の関係となっているように、hM4DとCNOも別の鍵穴と鍵の関係になって、お互いに交差的に反応することはありません(図2-A参照)。
論文について
- タイトル
Multimodal Imaging for DREADD-expressing Neurons in Living Brain and Their Application to Implantation of iPSC-derived Neuroprogenitors - 著者
Bin Ji1,4, Hiroyuki Kaneko1, Takafumi Minamimoto1, Haruhisa Inoue2,4, Hiroki Takeuchi2, Katsushi Kumata1, Ming-Rong Zhang1, Ichio Aoki1, Chie Seki1, Maiko Ono1, Masaki Tokunaga1, Satoshi Tsukamoto1, Koji Tanabe2, Ryong-Moon Shin1, Takeharu Minamihisamatsu1, Seiji Kito1, Barry J. Richmond3, Tetsuya Suhara1,4 and Makoto Higuchi1,4* - 所属
- 国立研究開発法人 量子科学技術研究開発機構 放射線医学総合研究所
- 国立大学法人 京都大学 iPS細胞研究所(CiRA)
- 米国国立精神衛生研究所
- 国立研究開発法人 科学技術振興機構 CREST
- 掲載誌名
The Journal of Neuroscience
