 令和6年6月6日
令和6年6月6日
国立研究開発法人量子科学技術研究開発機構
国立研究開発法人科学技術振興機構(JST)
発表のポイント
- パーキンソン病1)やレビー小体型認知症2)の中核をなすαシヌクレイン3)病変を検出するPET4)薬剤(18F-C05-055))を開発し、患者の生体脳で可視化することに世界で初めて成功した。
- PETで捉えたαシヌクレイン沈着量が運動症状の重症度と関連したことから、本PET薬剤は病気の進行度の客観的評価に利用でき、治療薬の効果判定に有用な可能性がある。
- 疾患モデル動物脳でのαシヌクレイン沈着も検出できる本PET薬剤は、非臨床から臨床までの橋渡し研究に利用でき、αシヌクレイン沈着を標的とする病態解明や診断・治療薬開発を促進することが期待される。
概要
国立研究開発法人量子科学技術研究開発機構(理事長 小安重夫、以下「QST」)量子医科学研究所脳機能イメージング研究センターの遠藤浩信主任研究員と量子生命科学研究所の小野麻衣子研究員らは、パーキンソン病およびレビー小体型認知症患者脳におけるαシヌクレイン沈着病変を世界で初めて可視化し、その沈着量が運動症状の重症度と関連することを明らかにしました。
パーキンソン病やレビー小体型認知症は、αシヌクレインというタンパク質の病的な凝集体が出現し、神経細胞死を引き起こすことが示されています。パーキンソン病は、根本治療薬のない進行性の脳の病気のうちアルツハイマー病6)に次いで多いにも関わらず、αシヌクレイン病変を生体脳で可視化する技術は未確立で、患者が亡くなった後で脳の病理検査(組織を取り出して染色等を行う)により病変を調べない限り、確定診断は行えませんでした。
QSTでは、アルツハイマー病の原因となりうるタウタンパク質7)の病変を世界に先駆けて画像化するなど、異常タンパク質の沈着を生体脳で可視化する技術の開発に取り組んできました。そうした開発で得たノウハウを活用し、タウ病変よりもさらに量が少なく画像化が難しいとされるαシヌクレイン病変の生体脳での検出に挑み、2022年に製薬企業との連携でPET用薬剤(18F-SPAL-T-06)を開発しました。このPET薬剤では、αシヌクレインが多量に沈着する多系統萎縮症という疾患では病変を画像化できましたが、病変量が非常に少ないパーキンソン病やレビー小体型認知症では病変の画像化に至っていませんでした。
そこで本研究では、αシヌクレイン病変に強く結合する別のPET用薬剤として18F-C05-05を開発し、パーキンソン病やレビー小体型認知症のモデルとなるαシヌクレイン病態伝播マウスおよびマーモセットで、病変を画像化できることを明らかにしました。次にこのPET薬剤を臨床で評価し、パーキンソン病やレビー小体型認知症の患者で病変を検出できることを実証しました。また、PETで検出されるαシヌクレイン病変の量と、運動症状の進行の間に関連性があることが示されました。
今回新たに開発された18F-C05-05は、脳の病理変化に基づくパーキンソン病やレビー小体型認知症の診断や病気の進行度を客観的な評価に利用できることに加えて、治療薬開発時の効果判定にも有用な可能性があります。また、疾患モデル動物と患者の両方でαシヌクレイン沈着を検出できることから、非臨床と臨床をつなぐ橋渡し研究に利用でき、病態解明や治療薬開発を促進することが期待されます。
本研究は、科学技術振興機構(JST)ムーンショット型研究開発事業『臓器連関の包括的理解に基づく認知症関連疾患の克服に向けて』、日本医療研究開発機構(AMED)「脳とこころの研究推進プログラム(革新的技術による脳機能ネットワークの全容解明プロジェクト)『変性性認知症による脳機能ネットワーク異常の全容解明』および『神経変性疾患のタンパク凝集・伝播病態と回路傷害の分子イメージング研究』」、「脳とこころの研究推進プログラム(精神・神経疾患メカニズム解明プロジェクト)『シヌクレイノパチーを全身病として捉えた病態解明と疾患修飾療法の開発』」、「ムーンショット型研究開発事業『病気につながる血管周囲の微小炎症を標的とする量子技術、ニューロモデュレーション医療による未病時治療法の開発』」、「認知症研究開発事業『病原性シードの構造生物学的理解に基づくαシヌクレイン伝播分子機構解明』」、「認知症研究開発事業『認知症の発症に関わるアストロサイト機能不全分子の同定とメカニズムの解明』」、MEXT/JSPS科研費JP22K07529、新潟大学脳研究所共同研究費補助金(2021-201907)の支援により開発した基盤技術を活用した成果で、神経科学分野のトップジャーナルの一つでインパクトの大きい論文が数多く発表されている科学誌「Neuron」のオンライン版に2024年6月6日(木)午前0時(日本時間)に掲載されました。
研究開発の背景と目的
パーキンソン病は、大脳の奥深くにある中脳8)という場所における黒質ドーパミン神経細胞の減少が、発症や進行に深く関わることが知られています。有病者は人口10万人あたり100から180人と推定されており、病状が進行する際に神経が脱落する神経変性疾患の中では、アルツハイマー病に次いで多い病気です。ドーパミン神経細胞が減少する理由は完全にはわかっていませんが、神経細胞の中にαシヌクレインというタンパク質が凝集してレビー小体という病変を形成することが、神経細胞死に関係すると考えられています。またレビー小体型認知症では黒質だけでなく、大脳などにもレビー小体が形成されることがわかっています。
パーキンソン病やレビー小体型認知症は、患者が亡くなった後の脳を調べてαシヌクレイン病変を見つけることで確定診断がなされます。最近では脳脊髄液や血液中の病的なαシヌクレインを検出できることが示されてきていますが、生体画像検査によってαシヌクレイン病変が疾患に特徴的な場所に存在することがわかれば、診断の強力な根拠が得られます。また、αシヌクレインの沈着を抑える治療薬の開発が進められていますが、このような治療の効果を評価する手段としても、αシヌクレイン病変の画像化が必要とされます。
QSTでは、これまで異常タンパク質の沈着を生体脳で可視化する技術の開発に取り組み、世界に先駆けてアルツハイマー病の原因となりうるタウタンパク質の病変の画像化(2013年プレスリリース:https://www.qst.go.jp/site/qms/1753.html)や、同技術の改良によりタウ病変をより高いコントラストで捉え、アルツハイマー病や前頭側頭葉変性症など多様な認知症を早期に診断・鑑別できることを実証しました(2020年プレスリリース:https://www.qst.go.jp/site/press/45206.html)
こうした異常タンパク質病変の画像化に関するノウハウを活用して産学連携により開発したαシヌクレイン病変を画像化するPET用薬剤(18F-SPAL-T-06)は、αシヌクレイン病変量の比較的多い多系統萎縮症では病変を捉えることができました(2022年プレスリリース:https://www.qst.go.jp/site/press/20220831.html)が、αシヌクレイン病変量が非常に少ないパーキンソン病やレビー小体型認知症では、病変を捉えることができませんでした。そこで本研究グループは、少量のαシヌクレイン病変であっても検出を可能にする能力をもつPET薬剤の開発を目指しました。
研究の手法と成果
本研究では、αシヌクレイン病変を含むヒトの脳組織に様々な構造をもった候補薬剤を直接反応させることによって、αシヌクレイン病変に高い結合力を持つ薬剤(C05-05)を同定しました。さらにパーキンソン病やレビー小体型認知症のモデル動物である、αシヌクレイン病態伝播モデルマウスやマーモセットにおいて、生体内のαシヌクレイン凝集体が明瞭に可視化できることを確認しました。18F-C05-05は脳内で持続的に高い濃度が維持されるため、少量の病変も検出できることが期待されました。
基礎研究で18F-C05-05が有望であることが確かめられたため、次いでこのPET薬剤の臨床評価を実施しました。健常高齢者8名、パーキンソン病患者8名、レビー小体型認知症(軽度認知障害含む)患者2名を対象に18F-C05-05を用いて PET撮影を行い、中脳におけるαシヌクレイン沈着を捉えられるかどうかを調べました。健常高齢者群と比較した結果、パーキンソン病およびレビー小体型認知症患者群では中脳に18F-C05-05の高集積を認めました(図1)。
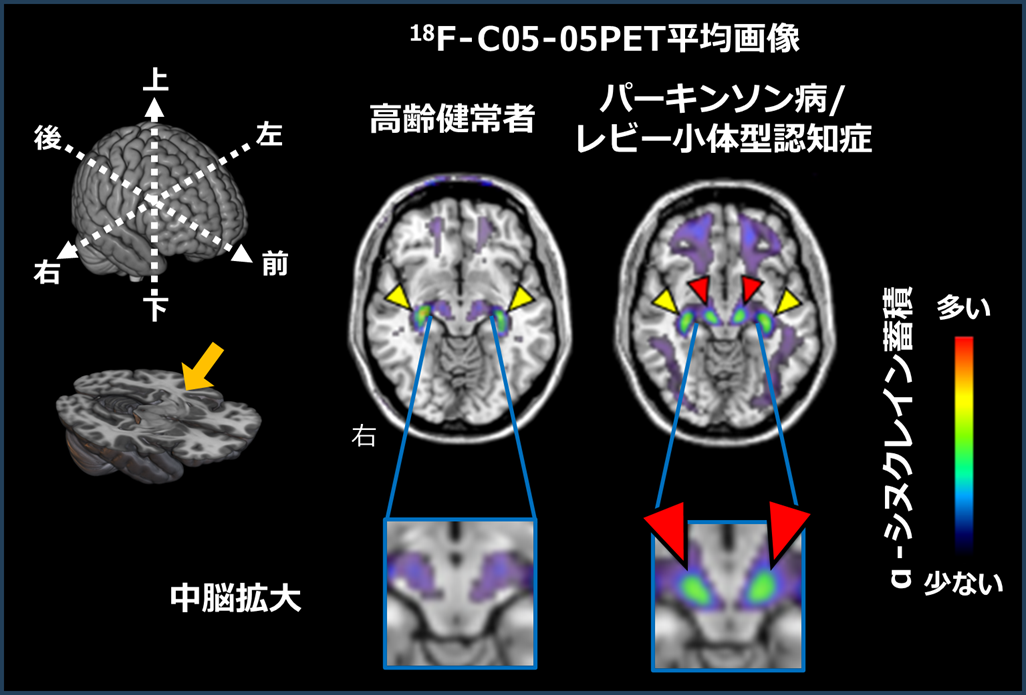
図1 健常8人とパーキンソン病8人/レビー小体型認知症2人の平均PET画像
赤矢頭は中脳の主に黒質を中心としたα-シヌクレイン沈着を示唆する18F-C05-05の集積を示す。黄色矢頭はα-シヌクレインとは無関係と考えられる、脳実質外の脈絡叢(脳内の隙間である脳室に存在する血管に富んだ組織)での18F-C05-05の集積を示す。下段は中脳の拡大図を示す。
また、パーキンソン病やレビー小体型認知症患者のPETで検出される中脳αシヌクレイン沈着は、運動症状の重症度と相関することが見出されました(図2)。この結果は18F-C05-05が診断のみならず、病気の進行度の評価にも有用であることを示しています。将来的には治療薬が病気の進行を抑えられるかどうかの客観的な判定にも利用できる可能性があります。
科学技術振興機構(JST)ムーンショット型研究開発事業『臓器連関の包括的理解に基づく認知症関連疾患の克服に向けて』の高橋良輔PMのコメントは以下の通りです。「レビー小体病(パーキンソン病やレビー小体型認知症)でみられる異常αシヌクレイン凝集体(レビー小体)のPETでの可視化は長く待ち望まれた技術であり、今後の展開によってレビー小体型認知症の未病のバイオマーカーともなりうる。ムーンショット目標2認知症克服プロジェクトの画期的成果である」。
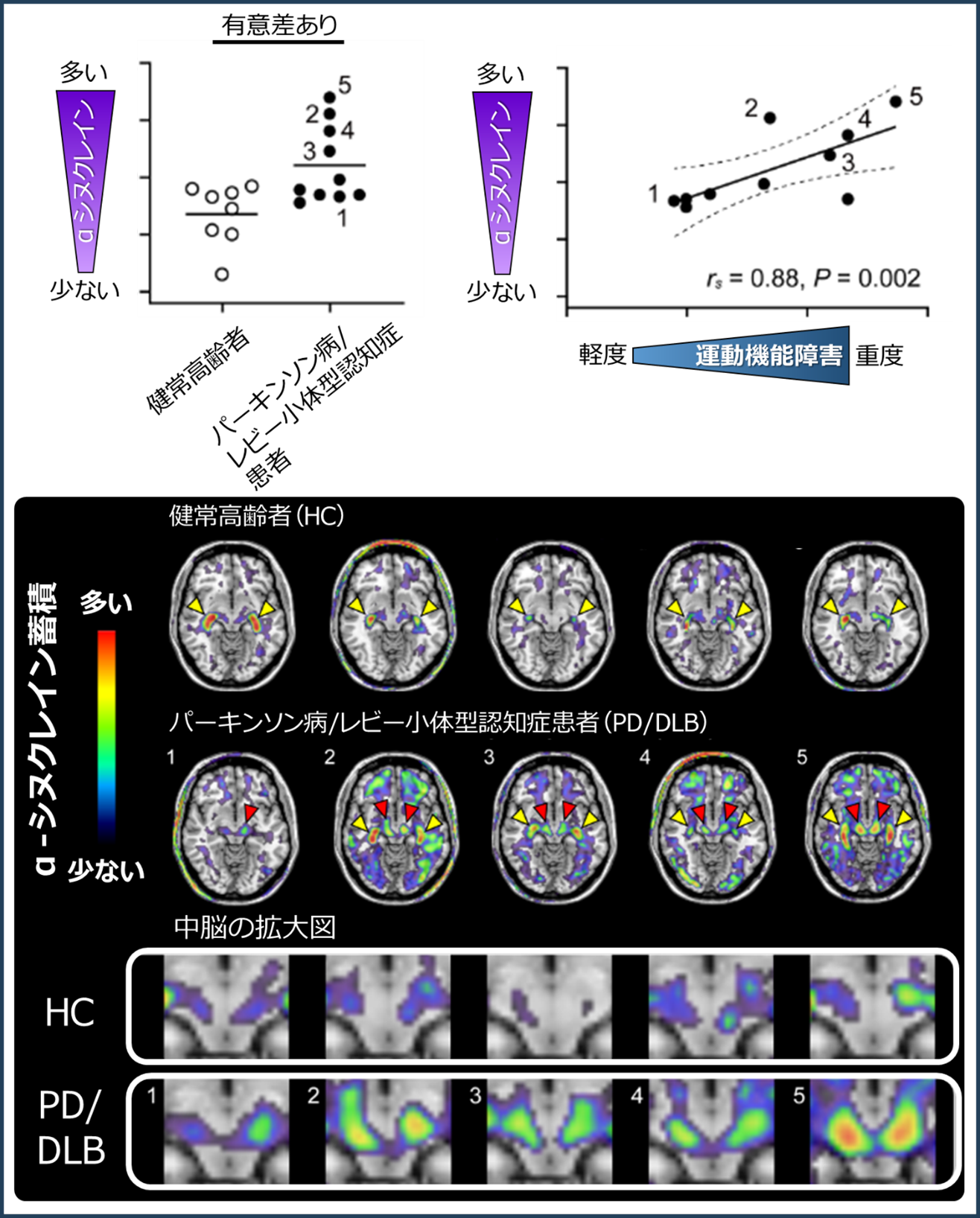
図2 中脳における健常高齢者と患者のPET薬剤集積量の比較
患者ではα-シヌクレインの沈着を反映してPET薬剤の集積が増加していた。また、運動機能障害が重症であるほどPET薬剤の高い集積が見られた。下段は代表的な健常高齢者とパーキンソン病/レビー小体型認知症患者の画像を示し、左上の数字が上段グラフのものと対応する。
今後の展開
本研究で18F-C05-05を用いたPETにより、パーキンソン病やレビー小体型認知症のモデル動物、ひいては患者の脳内におけるαシヌクレイン病変を捉えられたことは、病気が生じるメカニズムを明らかにする上で大きな進展をもたらすと見込まれます。モデル動物では、αシヌクレイン沈着や病変の拡大を引き起こす因子を明らかにするのに役立ちます。患者では中脳におけるαシヌクレイン沈着と運動症状の密接な関連性が捉えられたことから、αシヌクレイン病態がどのようにして神経機能障害を引き起こし、運動症状をもたらすのかを明らかにする研究が、顕著な進展を遂げると期待されます。
また、αシヌクレイン病変は神経細胞死に関連していることから、αシヌクレイン病変の形成を抑える治療薬は、疾患の発症や進行を抑止する根本的な手段をもたらすと考えられます。治療薬を開発する際に、疾患モデル動物とヒトで共通して利用可能で、生体脳の病変ミクロイメージングにも活用できるC05-05は、基礎と臨床を切れ目なくつなぐ役割を担えると見込まれます(図3)。海外でも本PET薬剤を用いた臨床評価が進んでおり、パーキンソン病およびレビー小体型認知症の治療の切り札となりうる抗αシヌクレイン療法の実現へ向けて、本研究の成果が大きく貢献することが期待されます。
18F-C05-05は脳内の滞留性が高い(持続的に脳組織内に高い濃度が維持されるので、他のタンパク質病変の脳内沈着量よりも総量が少ないαシヌクレイン病変に対しても留まることができ、画像を得ることができる)ため、パーキンソン病やレビー小体型認知症におけるαシヌクレイン病変を検出する場合に有利になると考えられます。これに対して、先行して臨床で評価された18F-SPAL-T-06は、バックグラウンドが非常に低い(ノイズとなる情報が非常に少ない)という特徴を活かし、多系統萎縮症のαシヌクレイン病変を高いコントラストで検出可能です。このような使い分けを行いながら、双方の利点を持つ次世代のPET薬剤開発により、超早期診断や介入による予防法の開発につながることが期待できます。
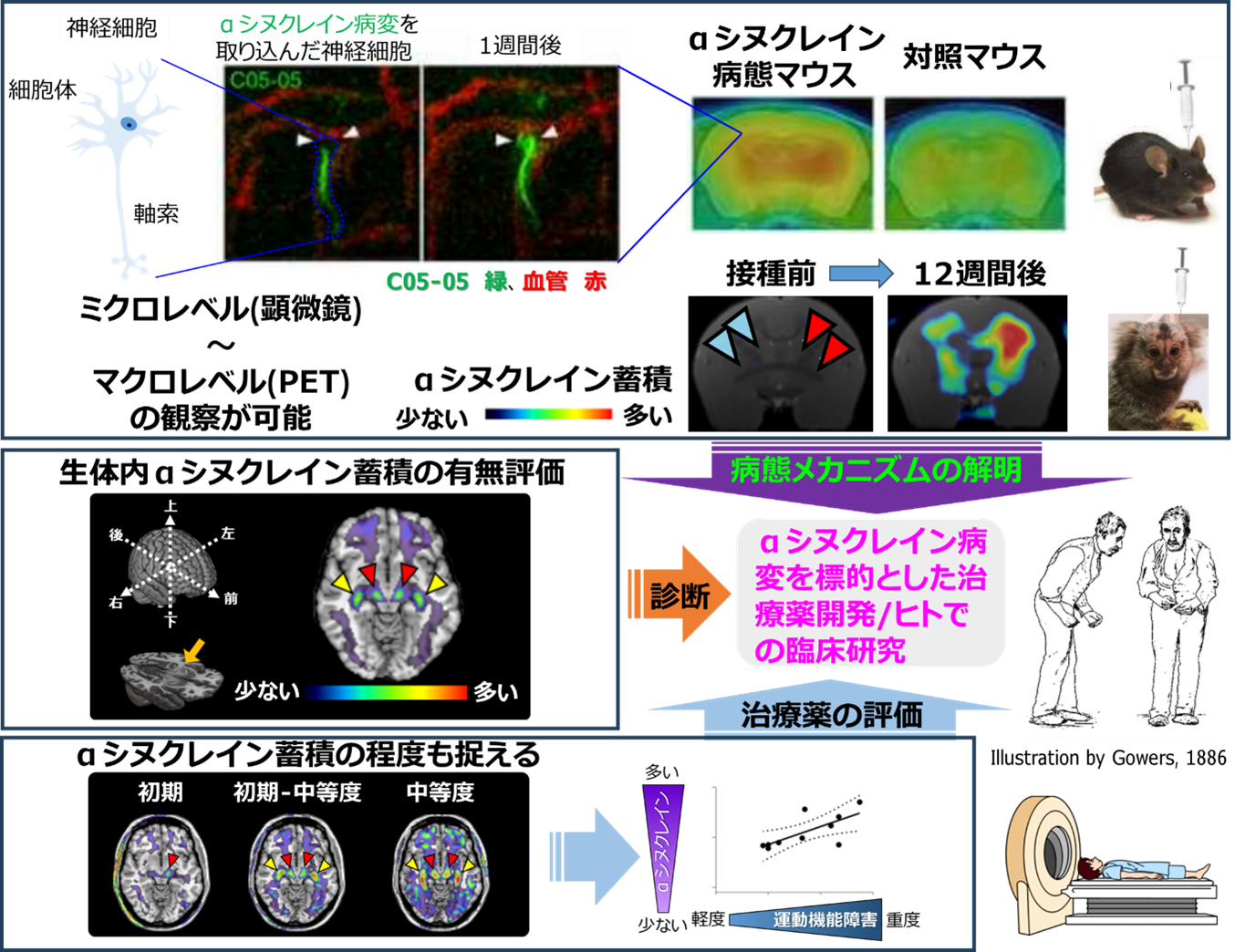
図3 今後の展開
上段はモデル動物における脳神経細胞のミクロイメージングからマクロイメージングを示す。αシヌクレイン線維(誤って折りたたまれたαシヌクレインタンパク質が線維のように集まったもの。これが鋳型となり、増えて集まったものが凝集体)を接種したマウス(病態伝播動物モデル)では、脳表面において二光子レーザー蛍光顕微鏡10)を用いて神経細胞を1週間前後、頭蓋骨に作成した観察窓から同じ部位を観察し、神経細胞の軸索に集積していたC05-05が細胞体まで広がっていることが確認できた(白矢頭)。αシヌクレイン病態伝播モデルマーモセットでは水色矢頭には比較のためにαシヌクレイン線維を含まない生理食塩水を、赤色矢頭にはαシヌクレイン線維を接種した。接種前のPET画像に比べて、接種12週間後には生理食塩水を接種した側まで伝播していることが確認された。中段、下段はヒトでのデータを示す。今後の展開として、18F-C05-05を用いて動物モデルでミクロレベルの病態メカニズムの検討や治療薬候補の評価を行い、有望な結果を得たのちにヒトを対象とした臨床研究や診断を行うことができると期待される。
このプレスリリースは『Neuron』のオンライン版に掲載される「Endo H, Ono M, et al. Imaging α-synuclein pathologies in animal models and patients with Parkinson’s and related diseases. (邦題:パーキンソン病とその関連疾患患者、および動物モデルにおけるαシヌクレイン病変イメージング)」に基づいて作成されています。
用語解説
1)パーキンソン病
50〜65歳に発症する方が多く、手足の震えや体のこわばりなどのパーキンソン症状が出現する病気です。加齢とともに発病率が増加すると報告されています。厚生労働省による「令和2年(2020)患者調査」では、継続的に医療を受けているアルツハイマー病6)の患者数は、推定79万4000人で、パーキンソン病の患者数は、推定28万9000人とされています。
2)レビー小体型認知症
アルツハイマー病6)に次いで多い神経変性型認知症で、物忘れのみならず、手足の震えや体のこわばりなどのパーキンソン症状や幻視を伴うことが特徴です。
3)αシヌクレイン
パーキンソン病、レビー小体型認知症、多系統萎縮症などの患者において、脳内に沈着することが知られています。脳内の神経細胞やグリア細胞の障害を引き起こすことにより、認知障害、運動障害などの様々な症状を発症します。
4)PET
Positron Emission Tomographyの略称。日本語では、陽電子断層撮影法と呼びます。身体の中の生体分子の動きを外から見ることができる技術の一種です。特定の放射性同位元素を結合したPET薬剤を患者に投与し、PET薬剤より放射される陽電子に起因するガンマ線を検出することによって、体内の生体分子の局在や量などを測定できます。
5)18F-C05-05
αシヌクレイン病変に強く結合する放射性薬剤で、18Fというラジオアイソトープで標識されています。この薬剤を静脈注射してPET検査を行うことにより、脳内のαシヌクレイン病変を画像化することが可能になります。(国際特許出願 PCT/JP2020/002607)
6)アルツハイマー病
認知症の原因として最も多い病気です。脳内に異常なタウタンパク質7)やアミロイドβタンパク質が蓄積して、進行性に物忘れなどが目立つ認知機能障害が出現します。
7)タウタンパク質
細胞内の骨格形成や物質輸送に関与しているタンパク質の一種です。アルツハイマー型認知症をはじめとする様々な神経変性疾患において、タウが異常にリン酸化して脳内に蓄積することが知られています。QSTは、脳内に蓄積したタウ病変に対して選択的に結合する薬剤を開発し、臨床応用を行ってきました。
8)中脳
脳の中でも重要な機能が集中している脳幹の一部です。運動機能、感覚機能、自律神経機能などに関わる様々な神経回路が存在しています。中脳にある黒質には大脳基底核9)へつながる細胞が多く存在し、パーキンソン病は黒質の神経細胞が障害されることがわかっています。
9) 大脳基底核
脳の表面(大脳皮質)と脳幹部などを結ぶ神経細胞が集まる脳部位です。運動の調節にかかわるほか、認知機能や感情、動機付けなど様々な機能を担っています。
10)二光子レーザー蛍光顕微鏡
近赤外線の超短パルスレーザーを用いることで、生体内部(数百μmの深さまで)の蛍光強度(蛍光分子の濃度)を3次元的に観察できる顕微鏡です。
論文情報
タイトル:Imaging α-synuclein pathologies in animal models and patients with Parkinson’s and related diseases
著者 :Hironobu Endo1,19*, Maiko Ono2,19, Yuhei Takado2, Kiwamu Matsuoka1,3, Manami Takahashi4, Kenji Tagai1,5, Yuko Kataoka1, Kosei Hirata1,6, Keisuke Takahata1,7, Chie Seki1, Naomi Kokubo1, Masayuki Fujinaga8, Wakana Mori8, Yuji Nagai1, Koki Mimura1,9, Katsushi Kumata8, Tatsuya Kikuchi8, Aki Shimozawa10, Sushil K. Mishra11, Yoshiki Yamaguchi12, Hiroshi Shimizu13, Akiyoshi Kakita13, Hiroyuki Takuwa1,4, Hitoshi Shinotoh1,14, Hitoshi Shimada1,15, Yasuyuki Kimura1,16, Masanori Ichise1, Tetsuya Suhara17, Takafumi Minamimoto1, Naruhiko Sahara1, Kazunori Kawamura8, Ming-Rong Zhang8, Masato Hasegawa10, Makoto Higuchi1, 18
著者所属:
1 Advanced Neuroimaging Center, Institute for Quantum Medical Science, National Institutes for Quantum Science and Technology, Chiba 263-8555, Japan.
2 Institute for Quantum Life Science, National Institutes for Quantum Science and Technology, Chiba 263-8555, Japan.
3 Department of Psychiatry, Nara Medical University, Nara 634-8522, Japan.
4 Quantum Neuromapping and Neuromodulation Team, Institute for Quantum Life Science, National Institutes for Quantum Science and Technology, Chiba 263-8555, Japan.
5 Department of Psychiatry, The Jikei University School of Medicine, Tokyo 105-8461, Japan
6 Department of Neurology and Neurological Science, Tokyo Medical and Dental University, Tokyo 113-8510, Japan
7 Department of Psychiatry, Keio University School of Medicine, Tokyo 160-0016, Japan
8 Department of Advanced Nuclear Medicine Sciences, Institute for Quantum Medical Science, National Institutes for Quantum Science and Technology, Chiba 263-8555, Japan.
9 Research Center for Medical and Health Data Science, The Institute of Statistical Mathematics, Tokyo, 190-8562, Japan.
10 Department of Dementia and Higher Brain Function, Tokyo Metropolitan Institute of Medical Science, Tokyo 156-8506, Japan.
11 Department of BioMolecular Sciences, The University of Mississippi, Mississippi 38677, United States.
12 Division of Structural Glycobiology, Institute of Molecular Biomembrane and Glycobiology, Tohoku Medical and Pharmaceutical University, Miyagi 981-8558, Japan.
13 Department of Pathology, Brain Research Institute, Niigata University, Niigata 951-8585, Japan.
14 Neurology Clinic Chiba, Chiba 260-0045, Japan.
15 Department of Functional Neurology & Neurosurgery, Center for Integrated Human Brain Science, Brain Research Institute, Niigata University, Niigata 951-8585, Japan
16 Department of Clinical and Experimental Neuroimaging, Center for Development of Advanced Medicine for Dementia, National Center for Geriatrics and Gerontology, Aichi 474-8511, Japan.
17 National Institutes for Quantum Science and Technology, Chiba 263-8555, Japan.
18 Department of Neuroetiology and Diagnostic Science, Osaka Metropolitan University Graduate School of Medicine, Osaka 545-8585, Japan.
19 These authors contributed equally to this work.
DOI: 10.1016/j.neuron.2024.05.006
