 2025年6月9日
2025年6月9日
国立研究開発法人量子科学技術研究開発機構(QST)
ポイント
- 中高齢以降に発症するうつ病や双極性障害などの気分障害(1)が、認知症の前兆として現れる可能性が指摘されていますが、その背景となる病態メカニズムはほとんど解明されていませんでした。
- 本研究では、認知症の原因物質の一つとして知られるタウタンパク質(2)(以下、タウ)の脳内沈着を、QST独自の技術で可視化し、中高齢発症の気分障害患者では、認知機能が正常な段階でタウ病変が出現していることを明らかにしました。
- 本成果により、中高齢発症の気分障害で認知症と共通する病変が検出可能となり、今後は病態に基づく客観的診断と根本的な治療の開発が進展することが期待されます。
概要
国立研究開発法人量子科学技術研究開発機構(理事長 小安重夫、以下「QST」)量子医科学研究所脳機能イメージング研究センターの黒瀬心協力研究員(主所属:慶應義塾大学医学部精神・神経科学教室)と高畑圭輔主任研究員らは、慶應義塾大学医学部精神・神経科学教室、国立精神・神経医療研究センター、東京科学大精神科(精神行動医科学分野)の協力を受けて、中高齢発症の気分障害(うつ病、双極性障害)の患者の脳内に蓄積するタウ病変をポジトロン断層撮影(PET)(3)により可視化し、タウ病変が気分障害の発症に関連している可能性があることを明らかにしました。
中高齢発症の気分障害は、社会的孤立や介護負担の増加と関連しており、高齢化が進む現代において深刻な社会的課題となっています。さらに近年の疫学研究からは、中高齢発症の気分障害が認知症の前段階として現れる可能性が指摘されています。認知症の多くは、タウやアミロイドβなどの異常タンパク質が脳に蓄積し神経細胞死が起こることで進行すると考えられていますが、これらの異常タンパク質が中高齢において気分障害の発症にどう関わるかは、これまで十分に解明されていませんでした。加えて、従来の研究は主にうつ病に焦点を当てており、双極性障害に関する検討はほとんど行われていませんでした。
そこで本研究では、QSTが開発した、様々な認知症や関連疾患におけるタウ病変を鋭敏に捉えることができる世界で唯一のPETイメージング薬剤18F-PM-PBB3 (florzolotau(18F) ) を用い、40歳以降で発症したうつ病および双極性障害の方を対象にPET検査を実施しました。その結果、同年代の健常者と比較して、中高齢発症の気分障害の患者は、タウ病変を有している確率が約4.8倍高いことが明らかになりました。さらに、国立精神・神経医療研究センターのブレインバンクのデータを用いた検討により、40歳以降にうつ状態または躁状態を初発した患者ではタウ病変を持つ割合が高いことが確認されました。また、うつ状態や躁状態が認知機能障害の発症に平均して約7年先行していることが明らかとなりました。これらにより、中高齢発症の気分障害の中に、認知症の原因タンパク質の一つであるタウ病変が認知症発症前から既に蓄積していることを生体で確認するとともに、死後脳データからも裏付けがなされました。
今回の研究成果は、本技術が中高齢発症の気分障害の方に対する認知症の早期診断に役立つという可能性を示しています。アルツハイマー病(4)ではアミロイドβやタウの病変を標的とした診断・治療の開発が進んでいるのに対して、中高齢発症の気分障害の診療ではPET検査を用いてアミロイドβやタウ病変の有無を調べることはされてきませんでした。今回の研究成果は、中高齢発症の気分障害に対する診療において、分子イメージングを用いた客観的なバイオマーカーに基づく診断・治療の必要性を示す重要な知見といえます。
本研究の成果は認知症分野において極めて注目度が高い国際的な学術誌の一つである『Alzheimer's & Dementia: The Journal of the Alzheimer's Association』のオンライン版に、2025年6月9日(月)20:00(日本時間)に掲載されました。
研究開発の背景
未曾有の高齢化社会を迎える我が国では、中高齢者に発症する気分障害(うつ病や双極性障害)が年々増加しており、介護者、家族、社会全体に身体的、心理的、社会的、経済的影響を与えることから大きな問題となっています。中高齢発症の気分障害は、年齢や環境変化に伴う心理的ストレスが原因とされることもありますが、最近の疫学研究や神経画像研究により、一部の例が実は認知症の「はじまり」であることが示され、国内外で注目されています。
認知症の多くはアミロイドβやタウなどの異常タンパク質が脳内に蓄積することで引き起こされることが知られており、「神経変性疾患」と総称されています。さらには、認知症で最も多いとされるアルツハイマー病ではアミロイドβに対して作用する根本治療薬が開発され、早期診断・治療の重要性が指摘されています。
一方、中高齢発症の気分障害においては、精神症状が現れた段階で背景に神経変性疾患が潜んでいるかどうかを判断する方法は限られていました。過去の死後脳を用いた研究では、中高齢発症の気分障害の背景にアミロイドβやタウの蓄積があると報告されてきたものの、MRIや脳波など一般的な診療で用いられる検査では、生前にアミロイドβやタウの蓄積を調べることができなかったためです。結果として治療が対症療法に留まり、アミロイドβ病理やタウ病理の進展が見過ごされてしまうリスクが存在していました。特に、認知機能が保たれている段階での気分障害では、患者も医療者もアミロイドβやタウ蓄積を含む神経変性疾患を想定しにくく、診断の遅れや不適切な治療方針につながることが問題視されてきました。
こうした背景から、QSTでは中高齢発症のうつ病患者の脳内で異常タンパク質が蓄積することを世界に先駆けて明らかにしました(2020年7月プレスリリース)。しかしながら、この研究には双極性障害患者は含まれておらず、中高齢発症の気分障害全体における脳内タウ蓄積の実態は不明のままでした。また、この研究にはQSTで最初に開発したタウPET薬剤11C-PBB3が用いられており、個々の患者におけるタウ病変の分布を詳細に判定することは困難でした。
このような背景のもと、本研究では中高齢発症の気分障害の発症にどのようなタウ病変が関係するかを明らかにすることを目的として、11C-PBB3を改良したタウPET薬剤18F-PM-PBB3 (florzolotau(18F) )を用いて中高齢発症の気分障害の患者における脳内タウ病変の頻度や分布を調べました。さらに、国立精神・神経医療研究センターのブレインバンクに保存されている死後脳データ用いて中高齢にうつ状態または躁状態を初発した患者にタウ病変がみられる頻度を解析しました。
研究の手法と主な成果
本研究では、40歳以降に気分障害を発症した(中高齢発症の気分障害)患者52名と同年代の健常47名を対象に、タウPET・アミロイドPETを行い、様々なタウ病変の頻度・分布・症状との関連について検討しました。
その結果、中高齢発症の気分障害患者群では、PETでタウ病変ありと判定される割合が50%と、健常高齢者の14.8%と比べて有意に高く、タウ病変の沈着に影響を与える要因を補正するため、年齢・性別・全般的な認知機能(Mini-Mental State Examinationスコア)を統計的に調整するとその頻度は約4.8倍でした(図1)。また、アミロイドPETの結果から、アミロイドβの蓄積についても、中高齢発症の気分障害患者では健常者より頻度が高いことがわかりました。これにより、中高齢発症の気分障害の一部には、健常加齢では説明できないレベルの異常タンパク質の蓄積が存在することが示唆され、認知症の前駆段階の可能性が考えられます。
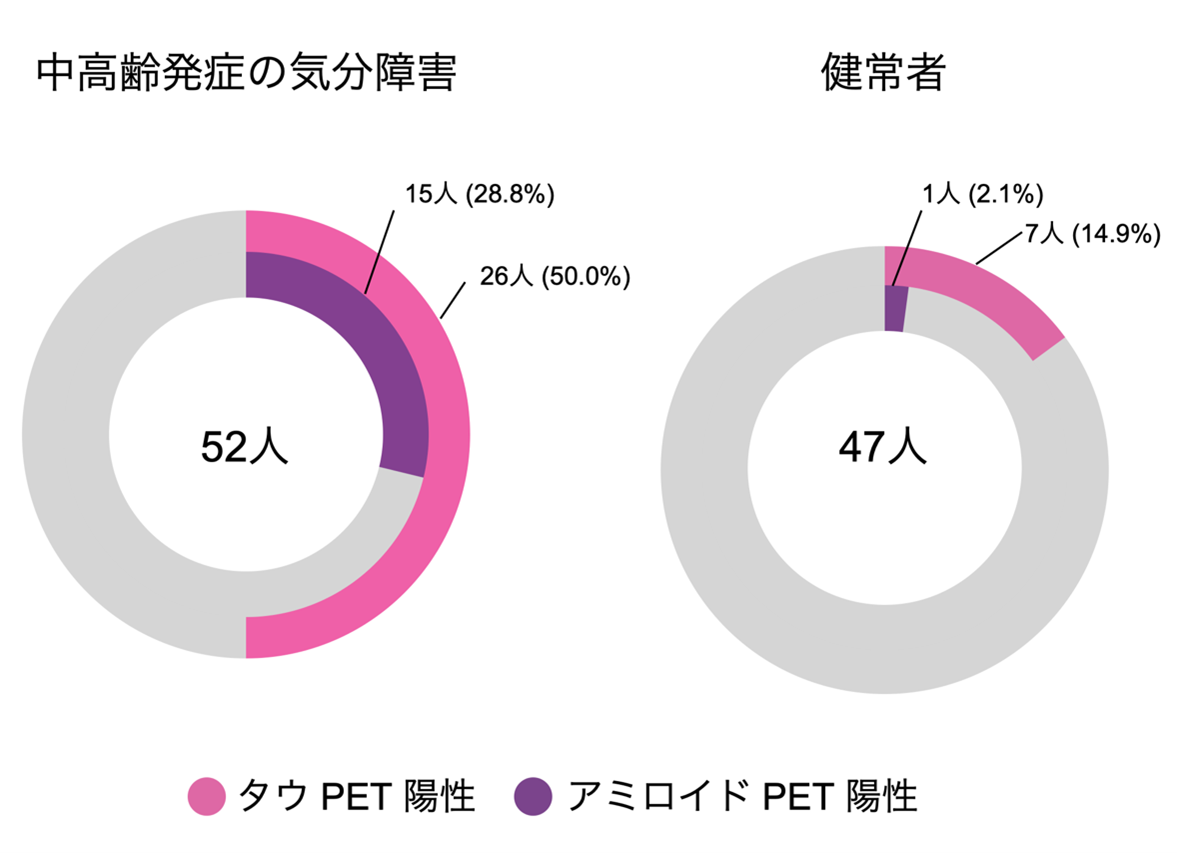
図1 タウ・アミロイドPET陽性の割合
中高齢発症の気分障害患者52人と健常ボランティア47人で、アミロイド・タウPET陽性の割合を比較しました。ピンク色がタウPET陽性、紫色がアミロイドPET陽性になります。中高齢発症の気分障害では、50%がタウPET陽性、28.8%がアミロイドPET陽性なのに対して、健常者では14.9%がタウPET陽性、2.1%がアミロイドPET陽性でした。統計学的な検定では、年齢、性別、認知機能検査の結果で調整すると、タウPETが陽性となる頻度は、気分障害の患者さんは健常者の方と比べて約4.8倍であることが明らかになりました。
タウ病変の分布の結果からは、アミロイドβの蓄積が認められない非アルツハイマー病型のケースでも、様々な分布様式をもつタウ病変が観察され、気分障害に関与していることが示唆されました(図2)。 これまでの研究は主にアルツハイマー病型のタウ病変を気分障害で調べたものがほとんどでしたが、18F-PM-PBB3(florzolotau(18F))を用いた本研究は、中高齢発症の気分障害患者において非アルツハイマー病型である前頭側頭型認知症(5)を含む多彩な神経変性疾患のタウ病変がみられることを世界で初めて示しました。
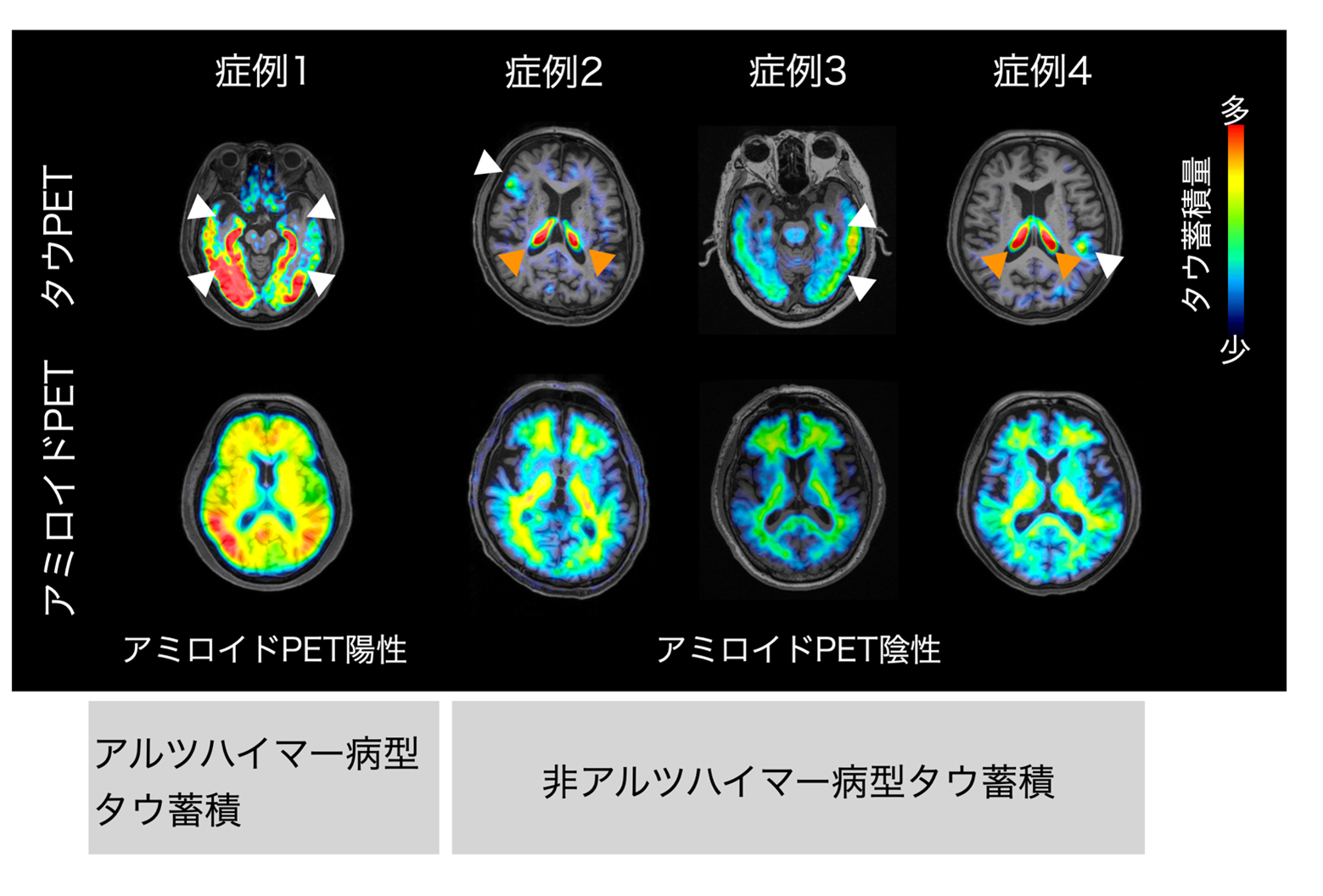
図2 中高齢発症の気分障害にみられる多様なタウ病態
代表的な中高齢発症の気分障害のflorzolotau(18F) PET画像を示します。上段がタウPET画像、下段がアミロイドPET画像です。アミロイドPET陽性の場合(症例1)はアルツハイマー病型のタウ蓄積、アミロイドPET陰性の場合(症例2, 3, 4)は非アルツハイマー病型のタウ蓄積と考えられます。アルツハイマー病型(症例1)では内側側頭葉を中心に脳全体にタウ蓄積が広がっているのがわかります。また、非アルツハイマー病型では、前頭葉(症例2)、側頭葉(症例3)、頭頂葉(症例4)と様々な領域にタウ蓄積が観察され、非アルツハイマー病の多様なタウ病変が観察されました。このことから、アルツハイマー病だけでなく、非アルツハイマー病型を含む多様な神経変性疾患が中高齢発症の気分障害の背景にあることが明らかにされました。
色のついているところがタウ病変のある部位であり、タウの量は図中のスケールバーの通り少ない(青色)→多い(赤色)で示されます。白矢印は病的な集積、オレンジ色矢印は健常者にもみられる生理的な集積を表しています。
さらに、精神病症状(妄想・幻覚など)を有する症例では、前頭葉や線条体などの脳領域でタウ蓄積量が増加する傾向が示されました(図3)。精神病症状は気分障害の重症例で出現することが知られていますが、本研究によりタウ病変が症状の重症度に関与していることが示唆されました。
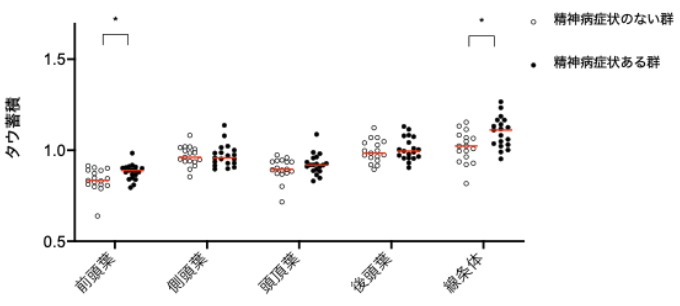
図3 精神病症状(幻覚・妄想)とタウ病変
アミロイドβPET陰性の中高齢発症の気分障害間で、精神病症状(幻覚・妄想)の有無でタウ病変の差を調べると、精神病症状のある群では前頭葉や線条体でタウ蓄積量が多い傾向が認められました。このことから、精神病症状がみられる重症の気分障害患者では、より非アルツハイマー病型のタウ病変が多いことが示唆されました。なお、アルツハイマー病型のタウ病変ではこのような傾向はありませんでした。
さらに本研究では、国立精神・神経医療研究センターのブレインバンクに保管された208例の剖検脳を解析し、40歳以降にうつ状態や躁状態を呈した例とそうでない例との間で神経病理学的な所見を比較しました。その結果、ブレインバンクデータ208例中、40歳以降にうつ状態または躁状態が初発した21例では、57.1%がタウ病変を持っていたのに対して、その他の例では28.2%であり、両者に有意な差が認められました。これらの21例には、アルツハイマー病、進行性核上性麻痺、大脳皮質基底核変性症、嗜銀顆粒性認知症など(6)、様々なタウ病変が含まれていました。気分症状が現れてから認知症が出現するまでには平均7年のタイムラグがあり、早期介入の重要性が示されました。
今後の展開
認知症で最も頻度が高いアルツハイマー病では、アミロイドβやタウの病変を標的とした診断・治療の開発が進んでいます。一方で、中高齢発症の気分障害の診断においては、通常の検査でアミロイドβやタウの病変を調べることはされてきませんでした。
本研究では、中高齢発症の気分障害がアルツハイマー病をはじめとした認知症の前駆状態である可能性をPETと死後脳を用いた解析で明らかにしました。この成果により、アミロイドβやタウの病変の可視化による、客観的な早期診断を行い治療介入するという、新しい中高齢発症の気分障害の診断・治療戦略の開発が期待されます(図4)。
2023年にアルツハイマー病に対するアミロイドβを標的とした疾患修飾薬が承認され、長らく「不治の病」とされた認知症の治療は大きく転換期を迎えました。その背景には認知症の発症に関わる脳内の異常タンパク質を検出する各種バイオマーカーが開発され、診断や創薬における有用性が実証されたことがあります。この戦略に必要となるタウを標的とした診断・治療の開発のため、現在、QSTではAPRINOIA社と共同で米国、台湾、日本などにおいて18F-PM-PBB3 (florzolotau(18F))の診断薬としての承認を得るための第1相および第2相臨床試験を進めています。
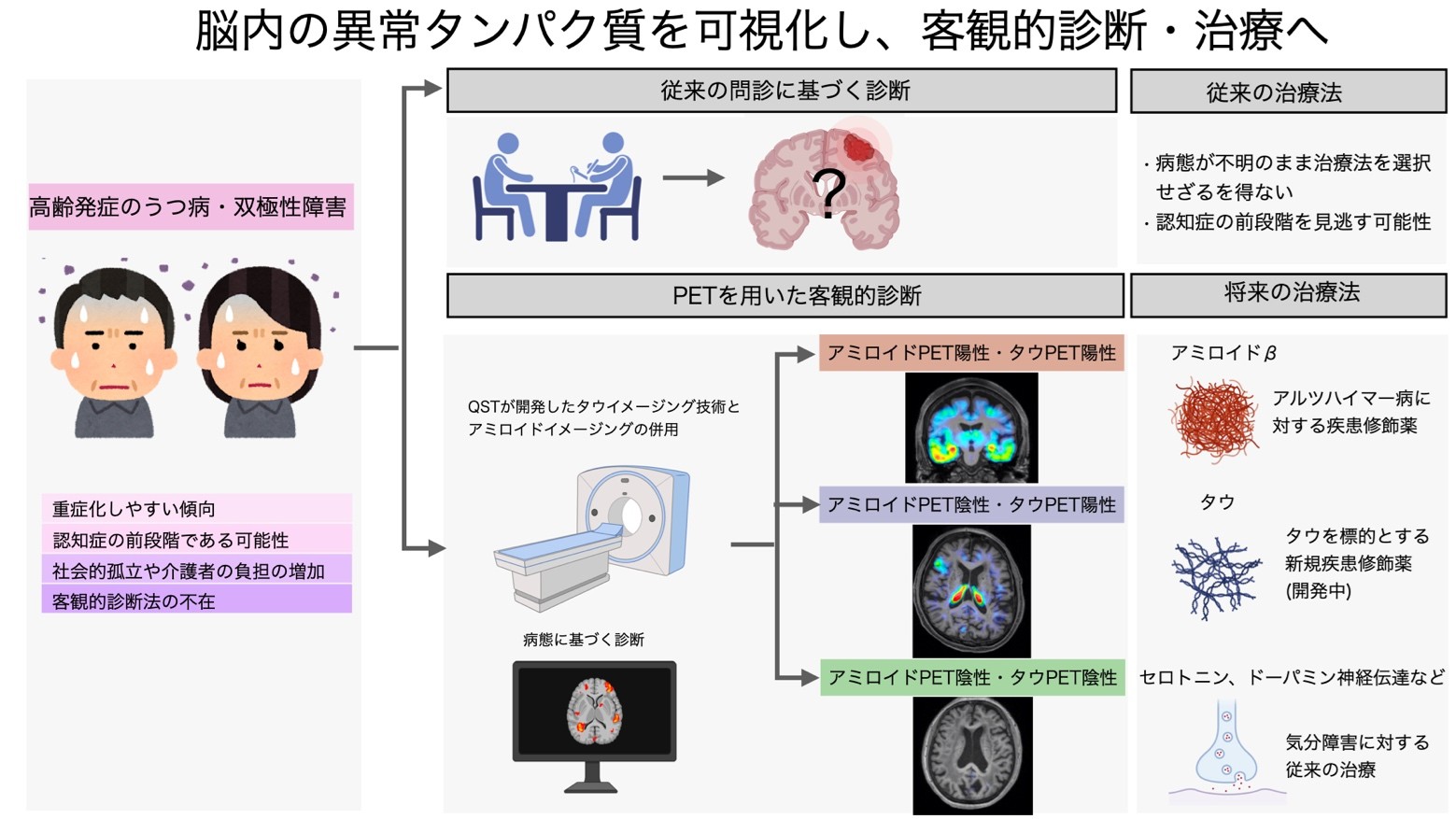
図4 中高齢発症の気分障害におけるタウ病態に基づいた新規診断・治療戦略
このプレスリリースは『Alzheimer's & Dementia: The Journal of the Alzheimer's Association』のオンライン版に掲載される「Kurose S, et al. Diverse tau pathologies in late-life mood disorders revealed by PET and autopsy assays(邦題:PET・死後脳で明らかにされた老年期気分障害における多様なタウ病理)」に基づいて作成されています。
謝辞
本研究は、科学技術振興機構(JST) ムーンショット型研究開発事業「臓器連関の包括的理解に基づく認知症関連疾患の克服に向けて」(JPMJMS2024))、日本医療研究開発機構(AMED)脳神経科学統合プログラム(中核拠点)「脳データ統合プラットフォームの開発と活用による脳機能と疾患病態の解明」、脳神経科学統合プログラム(個別重点研究課題)「AMPA受容体PETイメージングに基づいた認知症病態回路の解明」、AMEDムーンショット型研究開発事業「グリア病態からセノインフラメーションへ発展する概念に基づく認知症発症機序の早期検出と制御」などの支援を受けて実施されました。
用語解説
若年で発症する気分障害と中高齢で発症する気分障害では、臨床的な特徴が異なることが知られています。特に中高齢発症の気分障害では認知症発症のリスクであることが示唆されていました。
神経系細胞の骨格を形成する微小管に結合するタンパク質。細胞内の骨格形成と物質輸送に関与しています。アルツハイマー型認知症をはじめとするさまざまな精神神経疾患において、タウが異常にリン酸化して細胞内に蓄積することが知られています。
ポジトロン断層撮影(Positron Emission Tomography)の略称。身体の中の生体分子の動きを生きたままの状態で外から見ることができる技術の一種です。特定の放射性同位元素で標識したPET薬剤を患者に投与し、PET薬剤より放射される陽電子に起因するガンマ線を検出することによって、体深部に存在する生体内物質の局在や量などを三次元的に測定することができます。
アルツハイマー病は認知症の原因として最も多い病気です。脳内に異常タウタンパクやアミロイドが蓄積して、進行性に物忘れなどが目立つ認知機能障害が出現します。
前頭側頭型認知症は、脳の前頭葉や側頭葉の萎縮によって起こる認知症の一種で、行動や言語の障害が主な症状として現れます。
(6) 進行性核上性麻痺、大脳皮質基底核変性症、ピック病など
非アルツハイマー病型のタウオパチーの代表的な疾患。前頭側頭型認知症の一部の背景疾患と知られています。florzolotau(18F)以外のタウPET薬では検出が困難です。
論文情報
タイトル:
Diverse tau pathologies in late-life mood disorders revealed by PET and autopsy ssays
著者名:
Shin Kurose1,2 3,4, Sho Moriguchi1,2, Manabu Kubota1,5, Kenji Tagai1, Yuki Momota1, Masanori Ichihashi1,6, Yasunori Sano2, Hironobu Endo1, Kosei Hirata1, Yuko Kataoka1, Ryoji Goto1, Yuki Mashima2, Yasuharu Yamamoto1,2, Hisaomi Suzuki4, Shinichiro Nakajima2, Masashi Mizutani3, Terunori Sano3, Kazunori Kawamura7, Ming-RongZhang7, Harutsugu Tatebe1, Takahiko Tokuda1, Mitsumoto Onaya4, Masaru Mimura2, Naruhiko Sahara1,8, Hidehiko Takahashi6, Hiroyuki Uchida2, Masaki Takao3, Jeffrey H Meyer9, Makoto Higuchi1,Keisuke Takahata1,2,*
*Correspondence
所属:
- Advanced Neuroimaging Center, Institute for Quantum Medical Science, National Institutes for Quantum Science and Technology, Chiba, Japan
- Department of Neuropsychiatry, Keio University School of Medicine, Tokyo, Japan
- Department of Clinical Laboratory, National Center of Neurology and Psychiatry, Tokyo, Japan
- Department of Psychiatry, National Hospital Organization Shimofusa Psychiatric Medical Center, Chiba, Japan
- Department of Psychiatry, Kyoto University Graduate School of Medicine, Kyoto, Japan
- Department of Psychiatry and Behavioral Sciences, Institute of Science Tokyo, Tokyo, Japan
- Department of Advanced Nuclear Medicine Sciences, Institute for Quantum Medical Science, Quantum Life and Medical Science Directorate, National Institutes for Quantum Science and Technology, Chiba, Japan
- Department of Neuroscience and Pathobiology, Research Institute of Environmental Medicine, Nagoya University, Aichi, Japan
- Centre for Addiction and Mental Health and University of Toronto, Toronto, Ontario, Canada
DOI: 10.1002/alz.70195
