Hsp90阻害剤17-AAGが放射線照射時に
特異的にがん細胞の増殖を抑制するメカニズムを解明
放射線治療効果が飛躍的に向上する可能性
概要
放射線医学総合研究所(米倉義晴理事長)重粒子医科学センター粒子線生物研究グループ(岡安隆一グループリーダー)の野口実穂研究員らは、Hsp90(熱ショックタンパク質群の1つ)のシャペロン機能*1の阻害剤である17-AAGが、放射線照射時において正常細胞を区別し、特異的にがん細胞を死滅させるメカニズムの解明に成功しました。
17-AAGは、単独でも抗腫瘍効果を持ち、放射線照射や他の化学療法との組み合わせによってさらに高い抗腫瘍効果が得られることが報告されている薬剤ですが、その分子機構的なメカニズムについては明らかにされていないことが多く、今後の課題とされていました。
野口らは、放射線による細胞死の主な原因であるDNAの二重鎖切断に焦点をあて、17-AAGがその修復にどのような影響を与えるかについて研究を進めてきました。この結果、17-AAGは二重鎖切断の修復に関わるタンパク質を分解に導くことで、放射線照射により作られた二重鎖切断の修復を阻害し、細胞死を引き起こすことを発見しました。この作用はがん細胞に特異的であり、17-AAGががん細胞の致死に大きく影響していることが判明しました。今回の研究は、重粒子線治療をはじめとする放射線治療において、相乗的に治療効果を向上させることに繋がるものとして期待されます。
背景
重粒子線がん治療をはじめとする放射線治療は、人に優しい非侵襲的な治療法として大きく期待されています。ここでは、正常細胞とがん細胞を正しく区別し、がん細胞のみを選択的に攻撃する治療法の確立が重要な課題です。その照射精度の向上を図る研究とあわせて、照射効果を増幅する薬剤の開発が強く望まれています。こうした研究開発には、がん細胞の修復メカニズムを分子レベルで解明することが不可欠になっています。放射線医学総合研究所は、平成18年4月より開始された第2期中期計画において、重粒子医科学センター内に粒子線生物研究グループを立ち上げ、粒子線治療を支える主要な基礎研究としてこうした研究課題に取組んでいます。
研究手法と結果
研究には、ヒト前立腺がん細胞株とヒト肺扁平上皮がん細胞株を用い、100nM(ナノモル)の17-AAGを37℃で24時間処理を施しました。ここでのDNA二重鎖切断の検出は、定電圧電気泳動法*2によって行いました。
これらに、20Gy(グレイ)のX線を照射し、37℃で6時間まで修復させました。
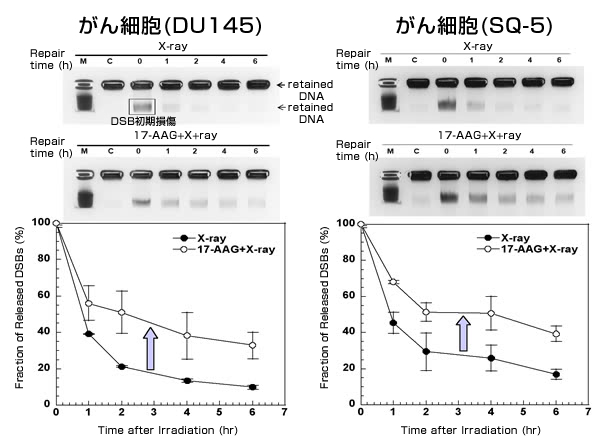
図1.DNA二重鎖切断の検出と20GyのX線照射後6時間の修復度
薬品で修復阻害があると、カーブは上に行く。
ヒト前立腺がん細胞、ヒト肺扁平上皮がん細胞ともに、
17-AAG処理を施すとDNA二重鎖切断の修復が大きく阻害されている。
さらにウェスタンブロット法*3を用いて、DNA二重鎖切断の修復に関わるタンパク質であるDNA-PKcs、Ku80、Ku70、Rad51、BRCA2の発現解析を行いました。
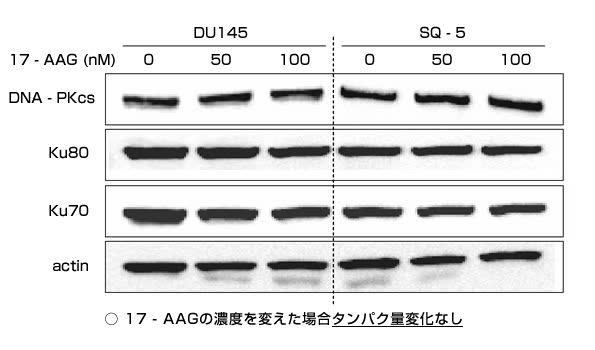
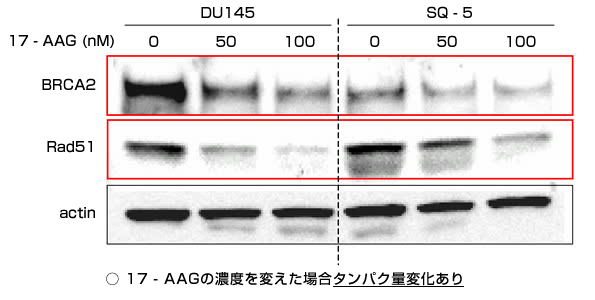
(図2)DNA二重鎖切断の修復に関わるタンパク質である
DNA-PKcs、Ku80、Ku70、Rad51、BRCA2の発現解析
修復タンパクのうち、Rad51およびそれと深くかかわるBRCA2が
大きく影響を受ける。
こうした結果を踏まえ、免疫染色法*4によって、X線2Gy照射後のRad51の修復を解析しました。
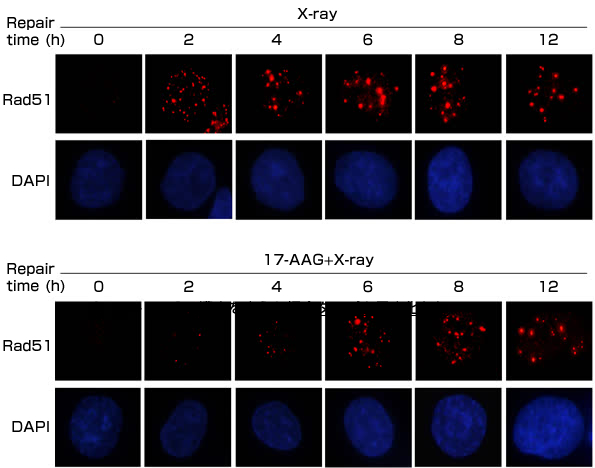
(図3)免疫染色法によるX線2Gy照射後のRad51修復解析
17-AAG導入により、明らかにRad51という
修復キータンパクの形成が非常に遅れる。
(DAPIで細胞核を染めたものには変化が見られていない)
この結果、放射線照射後の二重鎖切断の修復は、17-AAG処理によってヒト前立腺がん細胞、ヒト肺扁平上皮がん細胞ともに阻害されました。ヒト前立腺がん細胞では、放射線照射後2時間で2.4倍、6時間で3.3倍、ヒト肺扁平上皮がん細胞では2時間で1.7倍、6時間で2.3倍の修復阻害が見られました。
それとは対照的に、ヒト正常細胞では放射線増感も修復阻害もほとんど起こらないことが示されています。(Biochemical and Biophysical Research communications誌上の論文参照)
また、17-AAG処理によって、DNA修復に関与するタンパクであるRad51の出現度数が17-AAG濃度・投与時間に依存して減少することが明らかになりました。さらに、放射線照射後のRad51による修復も阻害され、ヒト前立腺がん細胞において、X線照射のみでは照射後2時間でRad51の出現度数が最大になりましたが、17-AAG処理群では2時間では出現が認められず、修復が大きく抑制されていることが明らかとなりました。一連の研究により、17-AAGは二重鎖切断の修復に関わるタンパク質を分解に導くことで、放射線照射により作られた二重鎖切断の修復を阻害し、細胞死を引き起こすことを発見しました。こうした作用はがん細胞に特異的であり、17-AAGががん細胞の致死に大きく影響していることが判明しました。
今後の展開
今回の成果は、放射線治療と化学療法の併用による、さらに効果的な治療法を開発するための基礎研究として注目されます。
今後は、細胞レベルでの研究と動物を用いた研究を進め、特に、重粒子線治療との併用療法の可能性を追求し、臨床応用に向けた研究開発に注力していきます。
用語解説
*1)シャペロン機能
新たに合成されたタンパク質の折りたたみや凝集、細胞の中で生じた変性タンパク質の再生などの機能。Hsp90などの熱ショックタンパク質は分子シャペロンとも呼ばれ、このようなタンパク質を介添え(シャペロン)する役割を持つ。
*2)定電圧電気泳動法
細胞をゲルに閉じ込め細胞膜、タンパク質を酵素処理によって分解し、一定電圧下で泳動させる。放射線により切断された(二重鎖切断)DNAはゲルから流れ、分子量の大きさにより異なる距離に泳動される。それぞれのバンドの濃さを検出・定量することにより、二重鎖切断DNAの量を定量する方法である。
*3)ウェスタンブロット法
細胞からタンパク質を抽出し、電気泳動によって分離したタンパク質を膜に転写し、任意のタンパク質に対する抗体でそのタンパク質の存在を検出する手法である。
*4)免疫染色法
抗体を用いて、細胞(組織)中の抗原を検出する手法である。今回は二次抗体に蛍光抗体を用いて可視化し、蛍光顕微鏡で観察した。ウェスタンブロット法と異なり、個々の細胞内においてタンパク質の局在を知ることができる。
本件の問い合わせ先
独立行政法人 放射線医学総合研究所 広報室
Tel:043-206-3026
Fax:043-206-4062
E-mail:info@nirs.go.jp
