放医研、7T(テスラ)超高磁場MRIを用いて
投与薬物およびその代謝物を一挙に視覚化することに成功
マウス生体での抗がん剤体内動態追跡に適用
概要
放射線医学総合研究所(米倉義晴理事長)分子イメージング研究センター先端生体計測研究グループ計測システム開発チーム(池平博夫チームリーダー)は、2005年度に放射線医学総合研究所で開発完了した7T(テスラ)超高磁場実験動物用MRI装置*1を用い、マウス生体内での抗がん剤5-FU*2の動態を追跡して投与薬物およびその代謝物を一挙に視覚化することに成功した。
MRIは、代謝物追跡を含めた薬物体内動態の直接視覚化法としては、スペクトロスコピーによる代謝物確認とその量的把握や時間経過といった多くの情報が得られるという利点を備えている一方、分子イメージング技術の中で、放射性薬剤を用いるポジトロン断層撮影法(PET)等に比べ感度が圧倒的に低いという弱点を持っている。現状では1mmol/kg以下の濃度での化合物分布の視覚化は大変困難であり、MRIの高磁場化が求められている。
金沢らは、実験腫瘍を皮下移植したマウスに抗がん剤5-FUを経口投与し、7T超高磁場実験動物用MRI装置によるMRS/MRI実験*3を行った。この結果、5-FUとその代謝生成物の時間経過を示す画像など、これまでのPETを始めとするイメージング技術では得がたい画像情報を取得することに成功した。
今回のマウス生体における抗がん剤5-FUおよび抗腫瘍効果を持つその代謝生成物の動態の視覚化は、薬剤開発においてきわめて有用な情報をもたらす技術として期待されるとともに、今後の人体用高磁場MRI装置の技術開発にも大きく寄与するものである。
本成果は、この程、米国シアトルにおいて開催されたInternational Society for Magnetic Resonance in Medicine(ISMRM)において発表された。
研究の背景と目的
放射線医学総合研究所はPETやMRIをはじめとする豊富な画像診断技術の蓄積をもとに、昨年11月分子イメージング研究センターを立ち上げ、疾病の機構解明や薬剤の挙動研究を進めるための生体計測システムについても、先進的な研究・開発に注力している。こうした中、放医研は2005年度、世界初の7T・400mmボア・自己シールド型でかつ冷媒補充不要の7T超高磁場実験動物用MRIシステムを開発し、スペクトロスコピー、fMRI等、超高磁場を利用した計測研究に取り組んでいる。生体内のタンパク質の動きや、生体に投与した薬剤の代謝といった生体分子イメージングが注目を集める中、水素(1H)以外の原子核を対象としたMRI(多核種MRI)は、生体系など複雑で分子計測が困難な系でも、観測したい原子核を選択することにより、1H以外の原子からの情報を選択的に観測でき、また、1Hに比して生体構成物質由来の背景信号に妨害されずに計測できるという原理的に優れた特徴を備えており、その特性は特に高磁場装置で生かされる。本研究は、最終的には人体用高磁場MRI装置の開発が望まれるなかで、動物用高磁場MRIとしても、動物の生体内での薬剤の動態を追跡して短時間に視覚化するなど、薬剤開発などで実質的な有用性があることを確認する実証的な研究開発を目的としている。今回は体内に殆ど存在しない19Fに着眼し、フッ素を含む抗がん剤(5-FU)を対象として体内での代謝過程画像描出を試みたものである。
研究手法と成果
今回の研究は腫瘍を皮下移植したマウスに抗がん剤5-FUを経口投与し、ケタミン-キシラジンによる麻酔下で19F検出コイル中に固定し、7T超高磁場実験動物用MRI装置で撮像を行った。
1H画像撮像後、全身からの19Fスペクトル(図1)を得、投与物質(5-FU)および代謝生成物(Fnuc*4およびFUPAとFBAL)の19F共鳴周波数*5を決定、得られた化合物毎の画像を高速撮像法の一つであるFast Spin Echo(FSE)*6を発展させた周波数選択同時画像法*7で撮像した。
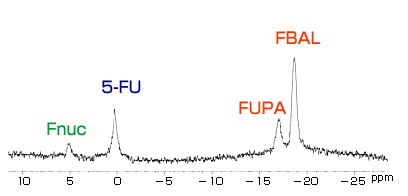
(図1)5-FUを経口投与したマウスの19F全身スペクトル
ここでは5-FUを化学シフト基準に設定してある
Fnucは5-FUからの有効代謝物。FUPAとFBALは5-FUの分解生成物で主に肝臓でできる。

(図2)複数周波数選択同時画像法で得た5-FU(上段)と
代謝生成物FBAL(下段)体内分布の時間経過(冠状断面)
19Fは投影画像(スライスなし)である
5-FU投与後、時間とともに、5-FUが代謝されFBALが肝臓で生成し、
腎臓を経て膀胱に集まる様子がわかる。
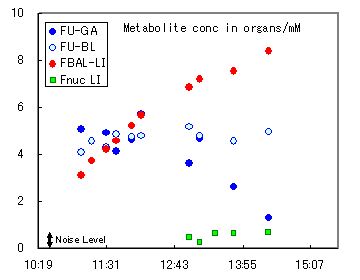
(図3)臓器ごとの物質の濃度の変化の傾向
図2の画像強度から得た5-FUとその代謝生成物の濃度の概算値(mmol/kg)
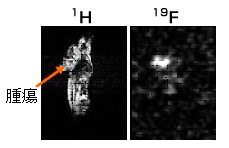
(図4)Fnuc信号選択画像法で得た腫瘍の位置での有効代謝生成物Fnucの生成
この腫瘍位置でのFnucの濃度はほぼ0.1mmol/kg程度であった。
なお、肝臓位置でのFnuc生成も認められるが非常に弱い(矢状断面)
19Fは投影画像(スライスなし)である
図1に5-FU投与マウス全身から得た19F-NMRスペクトル、図2は複数周波数選択同時画像で5-FU(上段)と代謝生成物FBAL(下段)の時間経過を、図3に画像信号強度から概算した臓器毎の概算濃度を示す。
図4は別のマウスであるが腫瘍の位置でのFnuc生成が描出されている。Fnucが低濃度であるために測定時間は図1の4倍の20分であり、他の化合物の同時測定は行っていないが、濃度0.1mmol/kg程度の有効代謝生成物を画像化できた。
本研究では、高磁場MRIを用いた動物実験において、薬剤開発過程で不可欠な指標である薬物の体内動態を一挙に視覚化できることを明らかにした。
なお、この実験ではマウスを対象としながら大動物用の勾配と中動物用の検出コイルを用いた点で最適条件ではなかったが、ハードウェアの整備を行うことで、測定時間の短縮は可能である。
今後の展望
今回のような高速撮像法を用いても、本来の体内濃度はさらに低濃度であるはずの薬物の動態追跡にはまだ十分とはいえない。今後、さらに装置の高感度化に取り組み改善を図る。その上で、他の分子種やフッ素系以外の多核種、分子を用いた広範な生体内での薬剤動態の追跡、画像化を行い、人体用高磁場MRIシステムの実現に向けた試験データの蓄積を図る。
用語解説
*1)7T超高磁場実験動物用MRI装置:
2002年度~2005年度の独法成果活用事業により、放射線医学総合研究所が(株)神戸製鋼所と共同開発した横型超伝導磁石型MRI。7T、内径400mm、自己シールド型、ゼロボイルオフ(超伝導維持用液体ヘリウムの蒸発なし)型のMRIは世界初である。
*2)5-FU:
ウラシルの5の位置の水素をフッ素で置換した薬物。抗腫瘍効果が確認され、臨床利用されている抗がん剤。投与後に生体内で代謝生成したヌクレオシドあるいはヌクレオチド体(Fnuc)が抗腫瘍効果を持つと考えられている。(腫瘍位置で抗がん有効代謝物であるFnucに変化することが必要条件である。)
*3)NMR,MRI,MRS:
水素(1H)、炭素(13C)、フッ素(19F)などの原子核には核スピンという小磁石の性質があり、これらを磁石の中におくと核スピンはそれぞれの原子核に固有の周波数で歳差運動を行う。この性質を利用して核磁気共鳴(NMR)スペクトル測定ができる。NMRスペクトルでは、同じ原子核でもppm単位(1/106)で細かくみると化合物ごとに異なる周波数で共鳴が起きることがわかっており、このため、NMRは化合物同定や分子構造決定に利用されている。水の1H NMRに位置情報を付け加えたものが医療用画像として使われるMRIである。また、生体内の化合物のNMRスペクトルを、対象が生きたまま測定する方法をMRSとよぶ。本研究で用いた方法は、MRSをさらに発展させ、特定のNMRスペクトル線を画像化する(そのスペクトル線の元となる化合物の分布を画像にする)もので、MRSIとも呼ばれる。
*4)Fnuc:
5-FUの同化生成物であるヌクレオチド・ヌクレオシド体の略称
*5)19F共鳴周波数:
NMR(MRI)観測可能な核スピンの共鳴周波数は原子核ごとに異なり、7Tでは1Hが300MHz、19Fが282MHz、13Cが75MHzなどである。ただし、この文中では化学シフトを含めた(ppmまでの)周波数を意味する。
*6)Fast Spin Echo(FSE):
MRIの高速撮像法の一種で、通常のスピンエコー法に比べて数倍以上の早さで撮像できる。高磁場での測定に強いという特徴がある。本研究では低濃度化合物の画像化にあたり、高速撮像法を用いることで一定時間に信号積算を行ってより高い信号強度を得た。
*7)周波数選択同時画像:
測定対象の化合物の共鳴周波数を選択的に励起し、その化合物のみを画像化するのが周波数選択画像であるが、複数化合物の共鳴周波数を交互に励起することによって、化合物毎に対応した複数画像を同時に得る方法。代謝が早いときに特に有効である。(これは金沢らが9.4Tで実現していた手法である。)
本件の問い合わせ先
独立行政法人 放射線医学総合研究所 広報室
Tel:043-206-3026
Fax:043-206-4062
E-mail:info@nirs.go.jp
