概要
独立行政法人放射線医学総合研究所(理事長:米倉 義晴、以下、放医研)分子イメージング研究センター 分子病態イメージング研究グループの長谷川 純崇研究員、Winn Aung研究員らは、アスベスト暴露の量と時間に依存してフェリチンH鎖タンパク質*1が発現誘導され、がんの発生に関与していることを解明しました。
中皮腫発がんの主な原因であるアスベストについては、大きな社会問題となっています。こうした中、放医研では分子イメージング研究の一環として悪性中皮腫*2の早期診断法の開発に繋がる研究に取組んでいます。
今回、長谷川、Aungらはアスベスト暴露によって発現誘導されるフェリチンH鎖タンパク質に着目し、同タンパク質がヒトの中皮腫細胞形成にどのような機能を果たしているかについて、さまざまな実験によって検証しました。この結果、フェリチンH鎖タンパク質が、生体の正常機能であるアポトーシス*3(細胞死)を阻害し、細胞のがん化を促進する可能性があること、またがん化した中皮腫細胞で過剰発現していることを見出しました。今後、フェリチンH鎖タンパク質や、このタンパク質が鉄代謝に深く関与していることから、鉄(Fe)の代謝経路を分子標的とした分子イメージング研究*4を進捗させることにより、悪性中皮腫の早期診断法に繋がることが期待されます。
この成果は、雑誌「Carcinogenesis」vol.28 no.9に掲載され、本年10月、横浜市で開催された日本癌学会で発表されました。
背景
平成17年6月以来、我が国ではアスベストによる悪性中皮腫の発症が大きな社会問題となっています。悪性中皮腫は極めて稀ながんですが、予後が不良で、3年生存率が約12.7%と報告されています。治療が困難である原因のひとつは、この腫瘍を早期に発見する方法がほとんど見出されていないことにあります。多くの患者は、自覚症状が出た後に医師の診察を受け、その時点では既に治療が困難あるいは不可能になっている場合が少なくありません。ただし、早期に発見できれば比較的簡便な外科手術や化学療法、放射線治療によっても根治は可能であると思われ、現段階での現実的な対策としては早期発見方法を開発し、膨大な数にのぼるアスベスト暴露群から効率的に早期の中皮腫患者を発見していくシステムの構築が重要であると思われます。こうした中、放医研の長谷川らは、中皮腫イメージングに応用可能な特異的分子の探索を分子腫瘍学の立場から進めてきました。
研究手法と結果
長谷川らの研究実験は、次のような方法で行われました。
ヒト中皮細胞にクリソタイル*5(Chrysotile)とクロシドライト*6(Crocidolite)の2種のアスベスト(0~10マイクログラム/cm2)を段階的に暴露させ、フェリチンH鎖タンパク質が発現誘導されることを見出しました。特に発がん性の最も高いとされるクロシドライトの方が、顕著に発現誘導することが確認されました。
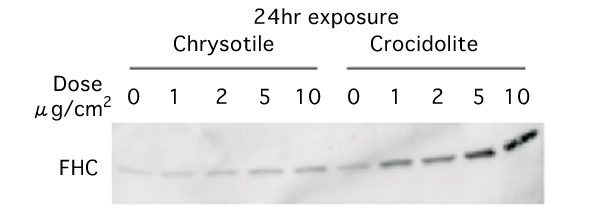
(図1)2種類のアスベストによるフェリチンH鎖タンパク質(FHC)の発現誘導
アスベスト暴露24時間後にタンパク質量を調べた。暴露した量が多くなるにつれバンドが濃くなっており、フェリチンH鎖タンパク質が増加しているのがわかる。特にクロシドライト暴露群の方がその増加が顕著であった。
同様に、ヒト中皮細胞にフェリチンH鎖タンパク質発現誘導効果が顕著であったクロシドライト(5マイクログラム/cm2)を暴露させ、0から48時間にわたって観察した結果、時間の経過に伴ってフェリチンH鎖タンパク質が発現してくることを確認しました。
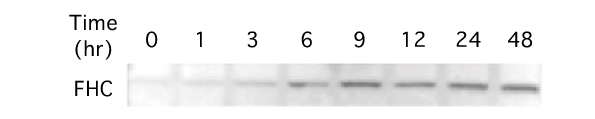
(図2)クロシドライトアスベストによる時間依存的なフェリチンH鎖タンパク質(FHC)の増加
暴露9時間後までは時間が経るにしたがってバンドが濃くなりタンパク量が増えているのがわかる。9時間以降は増加したままであった。
さらに、クロシドライト(5および10マイクログラム/cm2)を鉄のキレート剤であるDFO*7で処理し鉄含有量を減少させた後、暴露させた結果、キレート処理を行わない群と比較して明らかにフェチリンH鎖タンパク質の誘発が抑制されることが判明しました。こうした結果から、フェリチンH鎖タンパク質の発現誘導にはクロシドライトに含まれる鉄が関与していることが確認されました。

(図3)フェリチンH鎖(FHC)タンパク質の増加における鉄の影響
鉄キレート剤(DFO)で処理するとタンパク質の増加が抑制されている。
次いで、フェリチンH鎖タンパク質が生体の正常機能であるアポトーシス(細胞死)を阻害し、細胞のがん化を導く機序について検証するため、次のような実験を行いました。
ヒトの中皮細胞とフェリチンH鎖タンパク質が過剰に発現している細胞にクロシドライトを6~24マイクログラム/cm2暴露させ、過酸化水素の発生量を比較しました。過酸化水素はアポトーシスを誘発することが知られています。フェリチンH鎖タンパク質が過剰に発現している細胞では、コントロール群と比べ、過酸化水素発生量が減少しており、アポトーシスに対して抵抗性になっていることが確認されました。
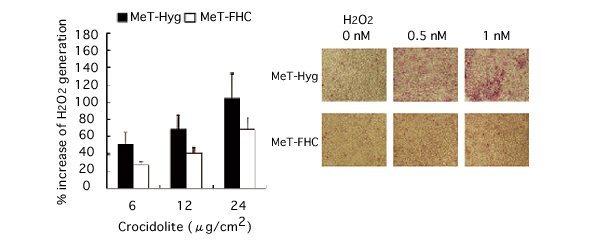
(図4)フェリチンH鎖タンパク質過剰発現細胞(MeT-FHC)とヒト中皮細胞コントロール群(MeT-Hyg)でのアスベスト暴露時の過酸化水素(H2O2)の生成量(左図)とアポトーシスの変化(右図)
フェリチンH鎖タンパク質が過剰に発現している細胞(左図、白柱)では、コントロール群(左図、黒柱)に比べてアスベスト暴露時の過酸化水素生成量が抑制されている。また、アポトーシスを起こしている細胞(右図で赤く染まっている細胞、上がコントロール群で下がフェリチンH鎖タンパク質過剰発現細胞)が少なくなっている。
更に、がん化したヒト中皮腫細胞の一部でもフェリチンH鎖タンパク質が過剰に発現していることを見出しました。この細胞でも、アスベスト暴露により産出される過酸化水素の量が抑制され、アポトーシスに対して抵抗性になっていることが確認されました。
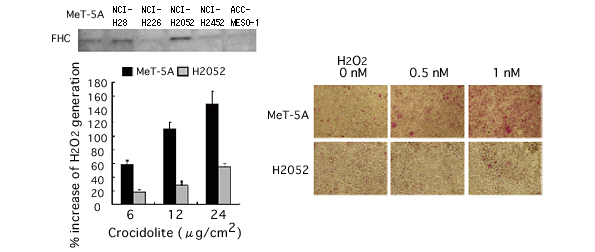
(図5)フェリチンH鎖過剰発現ヒト中皮腫細胞の過酸化水素生成量とアポトーシス抵抗性
フェリチンH鎖タンパク質が過剰に発現しているヒト中皮腫細胞(NCI-H2052、左上)は中皮細胞(MeT-5A)に比べてアスベスト暴露時の過酸化水素生成量が抑制され(左下)、アポトーシスが起こっている細胞数も少なくなっているのがわかる(右図)。
本研究の成果と今後の展望
今回の成果は、これまで確認されていなかったアスベスト暴露に起因する中皮腫発がん経路の一部を明らかにするものとして注目されます。フェリチンH鎖タンパク質を標的とした分子イメージング研究や、同タンパク質が鉄代謝に深く関与していることから、鉄(Fe)の代謝経路を標的とした分子イメージング研究を進捗させることにより、PET診断施設を活用した悪性中皮腫の早期診断法に繋がることが期待されます。
用語解説
*1)フェリチンH鎖タンパク質
フェリチンは生体内で鉄を貯蔵するタンパク質で、H鎖とL鎖の2種類のタイプがある。H鎖の方が重要とされている。
*2)悪性中皮腫
肺を包む「胸膜」肝臓や胃などの臓器を覆う「腹膜」、心臓を包む「心膜」の表面に存在する中皮細胞に発生するがんを悪性中皮腫という。稀ながんと言われてきたが、近年アスベストの暴露が発症に大きく関係していることが明らかにされ、労災に指定されている。
*3)アポトーシス
細胞死の一つの形で、役割を終えた細胞を排除する時に生じる。生体の正常機能であり、形態的には核の凝縮・DNAの断片化・細胞の縮小などが見られる。
*4)分子イメージング研究
生体内で起こるさまざまな生命現象を外部から分子レベルで捉えて画像化することであり、生命の統合的理解を深める新しいライフサイエンス研究分野。PETによる腫瘍の診断もその一分野である。
*5)クリソタイル
アスベストの一種で白石綿とも呼ばれる。産業的に多く使われている。
*6)クロシドライト
アスベストの一種で青石綿とも呼ばれる。鉄の含有量が多く発がん性が高いと言われている。
*7)DFO
鉄のキレート剤でDeferoxamineが正式名称。
本件の問い合わせ先
独立行政法人 放射線医学総合研究所 広報室
Tel:043-206-3026
Fax:043-206-4062
E-mail:info@nirs.go.jp
