“見える抗癌剤”の開発に成功
分子イメージングの技術により抗癌剤の脳内への移行を
MRIで画像化、同時に治療効果までも判定へ
独立行政法人放射線医学総合研究所(理事長:米倉義晴以下、放医研)分子イメージング研究センター※1(菅野巖センター長)計測システム開発チーム(青木伊知男チームリーダー)らのグループは、抗癌剤ロムスチン※2と造影剤ニトロキシル※3と結合させた新しい「見える抗癌剤SLENU」を開発し、MRI(磁気共鳴画像)でこの抗癌剤が脳内に運搬される様子を画像化することに世界で初めて成功しました。
これまで多くの抗癌剤では、腫瘍の縮小などを指標にその効果の判定を行っていますが、抗癌剤そのものが投与後に体内でどこに運ばれるか、どの程度効果を発揮しているかを直接的に確かめることができませんでした。また、脳には「脳血液関門※4」があるため薬剤が入りにくく、脳腫瘍では抗癌剤が十分にその効果を発揮することができませんでした。
今回の研究では、抗癌剤と造影剤を結合させた新しい薬剤(造影抗癌剤)を開発し、投与した薬剤がマウスの脳内に到達する様子をMRIで画像化することに成功しました。これにより、まず新しく開発した造影抗癌剤が脳内に到達可能であることを証明すると共に、体内のどこに、どのくらいの濃度で運ばれているかを確認することが可能になりました。またこの薬剤は、癌細胞が障害を受けたときに変化するレドックスやフリーラジカル※5を検出する機能を持っており、抗癌剤としての役割と同時に、その治療効果を画像として判定する事が可能です。よってこの「治療効果判定剤」としての機能を利用すれば、例えば放射線によって脳腫瘍を治療する過程において、その効果を画像として判定できる可能性を持ち合わせています。
この研究は、抗癌剤と造影剤を結合させ、脳内に移行する様子を画像化した世界で初となる研究成果です。撮影には、現在医療現場で広く使用されているMRIを用いるので、CT撮影などに用いる放射線の照射は不要です。今後、本研究によって開発した造影抗癌剤の脳腫瘍への治療効果や安全性を詳細に解析することによって臨床応用を図り、薬剤の分布や治療効果をモニターしながら進める画期的な化学治療である「イメージガイド治療」の実現に迫るとともに、重粒子線治療※6をはじめとする放射線との併用により、より安全で効果的な新世代の脳腫瘍治療法の確立につながるものと期待されます。
本研究成果は、青木チームリーダーの他、放医研分子イメージング研究センターのジフコ・ジェレブ研究員、ルミアナ・バカロバ主任研究員、同重粒子医科学研究センター・放射線効果修飾研究チームの安西和紀チームリーダー、松本謙一郎主任研究員、および放医研が研究協力の覚書きを締結しているトラキア大学(ブルガリア)のベセリナ・ガジェバ教授らの研究グループによる組織横断的な研究成果です。
また本研究成果は、その化学的特性に関する内容が、英国王立化学学会の科学雑誌『Chemical Communications』の1月7日号に掲載され、また生物医学応用に関する内容が、米国化学学会の科学雑誌『Molecular Pharmaceutics』に近日中に掲載される予定です。また、本研究は、ネイチャーマテリアル・アジア2009年1月30日号で、注目される研究成果として取り上げられ、英国王立化学学会の『Chemical Biology』でも重要な成果として紹介されています。
1.背景
脳にできた腫瘍(脳腫瘍)は、その複雑な構造のため治療が難しい病気として知られています。さらに、脳には脳血液関門というバリヤーがあり、血液から脳に必要な栄養素のみを選別して取り込み、脳に害となる重金属や化学物質は取り込まないようにする特別な構造があります。しかし、脳に腫瘍ができた場合、このバリヤーは治療に必要な抗癌剤の運搬を妨げてしまい、治療効果を落とします。また、どの程度の抗癌剤を投与すればよいかを、個々の症例に応じて調節すべきですが、腫瘍に到達した抗癌剤の濃度や抗腫瘍効果を確認する手段がありませんでした。現在は腫瘍の縮小などによって治療効果を判定していますが、治療を行って腫瘍が縮小するまでには大きなタイムラグがあり、また大きさの変化では癌細胞の活性など質的な変化までは知ることができません。もしも、脳内に到達する抗癌剤が画像で見え、さらに治療効果が詳細に確認できれば、抗癌剤投与量の調整など患者の状態に応じた抗癌剤の投与が決定でき、より効果的な治療の実現に繋がります。さらに、必要に応じて放射線治療等との併用など幅広い選択が可能になります。
2.研究手法と成果
研究グループは、脳に到達する抗癌剤の分布を可視化するために、まず脳腫瘍用の抗癌剤ロムスチンと造影剤ニトロキシルを化学的に結合させ、新しい「造影抗癌剤SLENU」を開発しました(図1)。次に、この造影抗癌剤をマウスに投与し、それが脳内に移行していく過程を7テスラ高磁場MRI※7で連続的に画像化することにより、この薬剤が脳に移行可能である事を証明すると共に、脳内の分布や濃度を把握することが可能であることを明らかにしました。複数の化合物を結合した場合、その特性が失われることが多くありますが、今回開発された造影抗癌剤は、脳血液関門を通過するという性質を維持したまま、画像化が可能になった点が注目を集めています。加えて、この新しい造影抗癌剤は電子スピン共鳴イメージング(EPRまたはESR)※8でも撮影が可能であることを確認し、体内のレドックスやフリーラジカルを可視化できる可能性を示しました。組織内の酸素濃度の異常によるレドックスの変化や、細胞の傷害へと繋がるフリーラジカル量の変化は、主要組織の病態を示す重要な指標で、例えば腫瘍の性状診断や治療の効果判定に利用できます。新しい造影抗癌剤は、レドックスの量的変化を反映して信号強度が変化する性質も併せ持つため、例えば、放射線治療を併用して、効果があった部位を確認する手段にも利用できます。
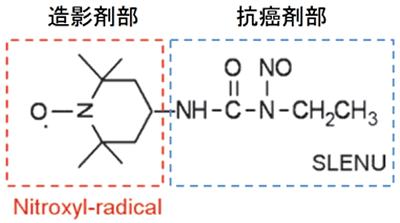
(図1)抗癌剤と造影剤を結合した新しい「造影抗癌剤SLENU」の合成
抗癌剤ロムスチンと造影剤ニトロキシルを、双方の特性を失うことなく、結合させることに成功した。
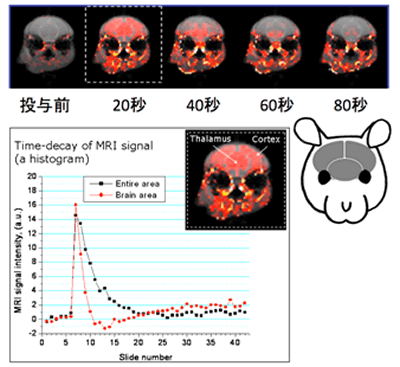
(図2)投与された造影抗癌剤がマウスの脳内に移行する様子を示すMR画像
マウスの脳の断層画像で、赤色の部分が投与した造影抗癌剤を示す信号上昇部分。
3.今後の展開
今後、本研究によって開発された造影抗癌剤について脳腫瘍への治療効果や毒性などの安全性を詳細に解析することによって、医療現場で利用可能となることが期待されます。合成に使用した素材であるロムスチンは既に欧米で認可されている抗癌剤であり、また造影剤であるニトロキシルについても顕著な毒性は確認されない事から、毒性面では大きな問題は生じないと考えられます。
この新しい造影抗癌剤は、化学療法の治療効果判定に加え、放射線治療の効果判定をも可能である事から、将来は、放射線治療と化学治療を同時に実施し、MRIで効果を確認しながら、照射量や投与量を高精度に調節するという新しい治療法を切り拓く可能性があります。個々の患者の症状や状態に応じた「テーラーメード治療」、画像を確認しながら治療する「イメージガイド治療」、そして「放射線・化学薬剤同時治療」など、より安全で効果的な新世代治療法の確立につながるものと期待されます。
本研究は“生体内で起こる様々な生命現象を外部から分子レベルで捉えて画像化する”分子イメージングの技術を応用したものであり、放医研分子イメージング研究センターでは今後も臨床応用を目指した革新的なイメージング技術の開発に取り組んでいきます。
用語解説
※1 分子イメージング研究センター
平成17年度に放医研に創立された分子イメージング研究を行っている研究センター。腫瘍や精神疾患に関する基礎研究や臨床研究のほか、分子プローブの開発や放射薬剤製造技術開発、PET開発やMRIの計測技術開発など、分子イメージングの基礎研究から疾患診断の臨床研究まで幅広い研究を行う世界屈指の分子イメージング研究拠点。文部科学省が推進する「分子イメージング研究プログラム」の「PET疾患診断研究拠点」として選定を受けている。
※2 ロムスチン
Lomustine(別名CCNU、米国での商品名CeeNU)。ストレプトゾトシンのグループに属する抗癌剤で、脂溶性が高いため脳血液関門を通過し、脳内に到達する。国内では未認可。
※3 ニトロキシル(正式名称:ニトロキシル・ラジカル)
ニトロキシル化合物(別名:ニトロキシド基を含む化合物)。古くは電子スピン共鳴法(ESRまたはEPR)を用いて、遊離基(フリーラジカル)を研究するために使用されてきた。MRIでも検出可能であり、近年、レドックス(※5参照)を検出する方法として再び注目されている。
※4 血液脳関門(または脳血液関門。略称BBB)
血行と脳の間に存在し,特定の物質だけを選択的に通過させる機能的な障壁。毛細血管内皮またはグリア性の膜が関門を構成すると考えられ、ブドウ糖・アルコール・酸素は血液脳関門を通過しやすく、また脂溶性物質や小さい分子は通過しやすい傾向があるが、その機構は未解明の点が多い。
※5 レドックス、フリーラジカル
酸化還元反応(酸素と結合する反応と酸素と分離する反応)をレドックス(ReductionとOxidationからの造語)という。不対電子(電子対を成さない単独で存在する比較的不安定な電子)をもつ分子または原子団をフリーラジカル(古い言葉では遊離基)という。生体ではレドックスとフリーラジカルは密接な関連があり、組織の酸化と還元(レドックス)の状態が乱れると、フリーラジカルが過剰に産生されて様々な疾患に結びつくとされる。
※6 重粒子線治療
放医研が推進する革新的な癌の放射線治療法。従来行われてきた電磁波による癌治療ではなく、粒子(炭素イオン)を光速近くまで加速して癌に照射し治療を行う。線量集中性と癌細胞の殺傷能力に優れ、高い治療成績を誇る。平成20年度には治療患者が4000名を超え、一部の癌の治療法については平成15年度から厚生労働省より先進医療の承認を得ている。
※7 7テスラ高磁場MRI
放医研が(株)JASTECおよび(株)KOBELCOと共同開発した実験用の高磁場MRI。1テスラは10000ガウス。より高い磁場ほど強い信号が検出できるが、安定した画像を得るためには高度な技術力が必要となるため、通常の医療では3テスラ以下のMRIが使用される。マウスに使用した場合、75ミクロン程度の分解能で生体の断層画像を得ることができる。
※8 電子スピン共鳴イメージング
電子スピン共鳴法(ESR:electron spin resonance)あるいは電子常磁性共鳴法(EPR:electron paramagnetic resonance)と呼ばれる。マイクロ波による電子スピンの共鳴を用いた手法で、通常は静磁場中の対象に8-300GHzの周波数帯でマイクロ波を照射することで、電子にエネルギーを吸収させる。生体を計測すると水による誘電損失が生じるため、小動物のイメージングでは300-1500MHz程度の低い周波数を使用する事が多い。フリーラジカルの同定や定量を行うことができる。
問い合わせ先
国立研究開発法人 放射線医学総合研究所 広報課
Tel:043-206-3026
Fax:043-206-4062
E-mail:05;nfo@nirs.go.jp
