概要
独立行政法人放射線医学総合研究所(理事長:米倉義晴;以下、放医研)分子イメージング研究センター分子神経イメージング研究グループ(須原哲也グループリーダー)分子生態研究チームの季斌(きひん)主任研究員らは、神経細胞とともに機能する脳内の主要細胞であるグリア細胞が活動する際に増加する末梢性べンゾジアゼピン受容体(以下、PBR)*1と呼ばれるタンパク質が、グリア細胞の中で発現するとともに、その発現パターンにもとづいて神経を保護するグリア細胞と、反対に攻撃するグリア細胞を識別できることを明らかにしました。この識別法によりアルツハイマー病をはじめとする様々な脳病態モデルマウスで、グリア細胞の役割を評価できることが分かりました。
本研究は、放医研が開発したポジトロン断層撮影(PET)*2用トレーサー薬剤*3と特異的抗体*4を活用して得られた成果で、認知症など高齢化社会が直面する神経疾患の診断および治療法開発に大きく貢献することが期待されます。
本成果は雑誌「Journal of Neuroscience」2008年11月19日号に掲載されました。
背景と目的
グリア細胞は、脳内で機能維持に関わる重要な細胞で、認知症やパーキンソン病など様々な脳病態に反応して活性化することが知られています。放医研では、活性化グリア細胞で増加するPBRという受容体タンパク質に結合する放射性トレーサー[18F]フロロエチル(FE-)DAA1106を開発し、PETを活用してグリア細胞活性化の生体イメージングを実施してきました。このイメージングをもとに、グリア細胞が認知症モデルマウスの病態に強く関わることや、グリア細胞の働きを抑えると認知症の特定病変が抑制されることをこれまで明らかにしてきました(2007年1月29日付、放医研プレス発表)。しかし、疾患における活性化グリア細胞は、損傷を受けた神経細胞を守ることもあれば攻撃することもあり、その役割は単純ではありません。そこで、季主任研究員らはPETトレーサー[18F]FE-DAA1106に加えて、独自に開発したPBRの特異的な抗体を用いて、可視化することができたPBRの発現パターンを細胞レベルで解析し、PBRがグリア細胞の「防御的」や「攻撃的」の役割を見分けるバイオマーカーとなりうるか検討しました。
研究手法と結果
(1)ミクログリアやアストロサイトの発現パターンが異なる
グリア細胞には、ミクログリアやアストロサイトなどの亜種が存在します。アルツハイマー病の発症の2大原因となっているアミロイドβとタウタンパク質*5の脳内蓄積をそれぞれモデル化して状況を観察しました。その結果、2種のマウスでは両方ともグリア細胞は活性化するものの、アミロイドβ蓄積モデルでは主にアストロサイトでPBRが発現し、タウタンパク質蓄積モデルでは主にミクログリアでPBRが発現しました。アミロイドβ蓄積モデルでは、グリア細胞が病変除去や神経修復に関わり神経損傷が軽度であるのに対し、タウタンパク質蓄積モデルでは、グリア細胞活性化が神経傷害を促進して顕著な神経死と脳萎縮に至ることが知られています。このため、神経細胞が、グリア細胞で保護・修復される場合には、アストロサイト主体にPBRが発現し、神経細胞がグリア細胞で攻撃・破壊される場合はミクログリアで主体的にPBRが発現することが分かりました。
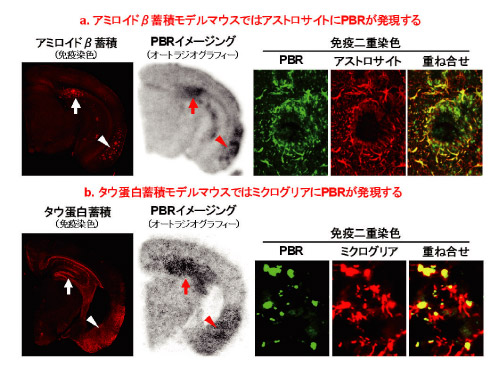
図1 アルツハイマー病モデルマウスにおけるPBR発現パターン
半脳切片を見ると、2種類のモデルのどちらも海馬(矢印)と嗅内野(矢印)で病変蓄積に反応してPBRの増加を認めるが、免疫二重染色で解析するとPBRを発現するグリア細胞のタイプが2つのモデルで異なることが分かります。
(2)神経修復が起こる時期のPBRの増加をPETで可視化
神経細胞が、非可逆的に傷害されて死滅するカイニン酸を投与したモデルラットではPBRが主にミクログリアで増加しました。しかし、神経修復が起こり神経死に至らない神経線維損傷モデルマウスでPBRは主にアストロサイトで増加することが分かり、認知症モデルマウスで示されたPBRの発現パターンとグリア細胞の役割との関係が認知症以外の神経病態モデルにも当てはまることが判明しました。さらに、神経線維損傷モデルマウスでは、神経修復が起こる時期にPBRの増加をPETにより生きたまま画像化し観察することができました。
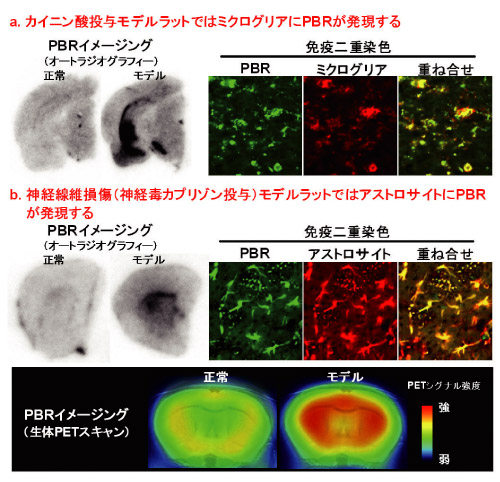
図2 認知症以外の神経病態モデルにおけるPBRの発現パターンとPET画像
(3)PBRを発現するアストロサイトが神経を保護
今回の研究で用いたモデル動物のほとんどで、アストロサイトにおけるPBRの発現増加がGDNF*6と呼ばれる神経栄養因子の産生増加と相関していることが明らかとなり、PBRを発現するアストロサイトが神経保護に働くことを支持する証拠を得ることができました。
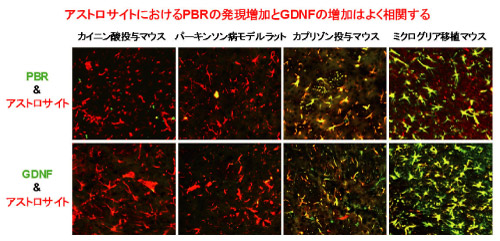
図3 様々なモデルのアストロサイトにおけるPBRとGDNFの発現
免疫二重染色で解析すると、PBRやGDNFを発現するアストロサイトは黄色く染まり、発現が乏しいアストロサイトは赤く染まり発現の様子がよく分かるようになります。
今後の展望
グリア細胞が、神経を保護する「善玉」として機能するか、それとも神経を攻撃する「悪玉」として機能するかを客観的に識別する分子マーカーが、この研究で初めて捉えることができました。今回同定した分子マーカーのPBRは、PETの計測で動物モデルのみならずヒトでも生体で可視化でき、神経疾患の病態解明から診断・治療評価に至る幅広い疾患研究分野に貢献すると期待できます。アルツハイマー病の2大病理変化に対するグリア細胞の反応パターンが異なるという所見は特に重要で、同疾患に対してグリア細胞の全般的活性を高めたり抑えたりする治療よりもむしろ、グリア細胞の特定の機能を制御する治療の方が効果的であると推察できます。同様に、様々な神経疾患モデルを用いてグリア細胞を標的とした治療法開発を行う際には、グリア細胞活性化を全般的に抑制すべきか、促進すべきか、あるいは特定機能のみを制御すべきかといった治療方針を決めるためにこのPBRは、バイオマーカーとして大きな意義をもちます。また、PBRを指標として分別した「善玉」と「悪玉」のグリア細胞のそれぞれで、PBR以外にいかなる分子が増えているかを明らかにすることができると、その分子を制御することで「悪玉」グリア細胞を「善玉」グリア細胞に変換する治療も将来的に可能となります。さらに、PBR自体が、グリア細胞の「善悪」の性格付けに関わっている可能性もあるため、PBRの機能制御による神経疾患治療という新たな可能性を見だすことにもなります。
用語解説
*1)末梢性ベンゾジアゼピン受容体(peripheral benzodiazepine receptor; PBR)
脳内のグリア細胞が活性化した際に発現が増加する機能性タンパク質です。グリア細胞は、様々な神経疾患で活性化するので、PBRの増加が病態の指標となります。放医研では、早くからこのPBRに着目し、PBRの分布や発現の変化を生体で画像化する方法の開発を行ってきました。
*2)PET
ポジトロン断層撮影(positron emission tomography)の略称で、生体の生理機能や病的変化を画像化する有力な手段です。また、最近ではマウスのような小動物の生体イメージングを可能にする高分解能PETが開発されています。
*3)トレーサー薬剤
PETによる生体イメージングは、放射性アイソトープで標識された薬剤を生体に投与し、PET装置により放射線を検出することで実現します。この時に投与する薬剤が、トレーサー薬剤(あるいは分子プローブ)と呼ばれ、薬剤の分布・結合特性により生体の特定の分子や事象を画像化することが可能です。
*4)特異的抗体
免疫担当細胞が産生する抗体の中には、特定の生体分子に特異的に結合するタイプのものが存在します。このような特異的抗体を精製して免疫染色と呼ばれる解析技術に利用することで、生体分子の分布を細胞レベルで詳しく調べることができます。
*5)アミロイドβとタウタンパク質
アルツハイマー病は、アミロイドβと呼ばれるペプチドとタウと呼ばれるタンパク質が線維状の塊を形成し、それぞれ老人斑と神経原線維変化と呼ばれる脳病変を形成することを病理学的な特徴としています。アミロイドβとタウタンパク質はどちらもアルツハイマー病の発症メカニズムに密接な関わりを持つと考えられます。
*6)GDNF (glial cell-derived neurotrophic factor)
グリア細胞が産生する分子で、神経栄養因子と呼ばれるタンパク質の一種。神経細胞の成長・機能維持・修復などを調節する役割を担っています。
問い合わせ先
独立行政法人 放射線医学総合研究所 広報課
Tel:043-206-3026
Fax:043-206-4062
E-mail:info@nirs.go.jp
