-核酸医薬として抗腫瘍効果を確認-
独立行政法人 放射線医学総合研究所(理事長:米倉 義晴)
分子イメージング研究センター※1
佐賀 恒夫 グループリーダー、
辻 厚至 主任研究員
成果の概要
アスベストが主要原因である悪性中皮腫※2は、有効な医薬品の開発が強く望まれている疾患の1つです。放医研では、2005年から早期診断法の開発に着手しており、これまでに、中皮腫モデルマウスにおいて、中皮腫を特異的にPETで画像化するなどの成果をあげてきました。
これまで困難であった、悪性中皮腫(肉腫型)の診断・治療を可能にするために、ヒト悪性中皮腫の培養細胞を用いた研究を行いました。細胞増殖抑制を指標にして、8,589遺伝子のsiRNA※3をスクリーニングすることにより、COPA遺伝子※4のsiRNAの細胞増殖抑制効果が高いことを世界で初めて発見しました。このsiRNAを中皮腫モデルマウスに投与する治療実験を行ったところ、腫瘍の増大を有意に抑制させることに成功しました。さらに、この治療実験に用いた中皮腫を詳しく解析したところ、siRNAの投与によって中皮腫に細胞死が誘導されていることが判明しました。
今後、COPA遺伝子を標的とすることにより、悪性中皮腫(肉腫型)の診断法と治療法の両方で新しい展開が期待できます。
この成果は、ライフサイエンス分野のゲノムに関する解析結果を掲載するアメリカの著名な専門科学誌『Genomics』4月号に平成22年3月29日に掲載されました。
研究の背景と目的
悪性中皮腫は、アスベストばく露が主要原因で発生する腫瘍であり、2005年6月に公表されたクボタショック※5以来、今後の患者の増大が懸念されるなど大きな社会問題のひとつとなっています。外科療法、内科療法、放射線療法を組み合わせた最新の治療が行われていますが、未だに非常に予後の悪い腫瘍です。悪性中皮腫の多くは進行がんとして見つかるため、内科療法の治療効果が、予後に大きく影響します。しかしながら、現在使用されている治療薬の効果は十分でなく、新たな治療薬の開発が切望されています。悪性中皮腫の3種類ある病理組織型(上皮型、肉腫型、二相型)の中でも、肉腫型は、有効な診断・治療法がなく非常に予後が劣悪で、その治療薬の標的となる分子も知られていません。放医研では、2005年から早期診断法の開発に着手しており、これまでに、中皮腫モデルマウスにおいて、中皮腫を特異的にPETで画像化するなどの成果をあげてきました。肉腫型の悪性中皮腫の有効的な診断・治療法を確立するため、本研究では、肉腫型の悪性中皮腫の診断・治療薬の標的となる分子の探索を行いました。
研究手法と結果
これまで、この分野では、主に悪性中皮腫に発現しているRNAやタンパク質の探索が行われてきました。放射線医学総合研究所では新たな診断・治療標的分子の探索方法として、siRNA※3を用いた機能スクリーニングに取組ました。siRNAは、それ自身が治療薬になる可能性があり、標的となるRNAに結合し分解を誘導することで、特定の遺伝子の発現を抑えることができます。
まず、ヒト遺伝子のうち、機能との関連づけがされている8,589遺伝子に対するsiRNAライブラリーを作製しました。そして、それぞれの遺伝子に対するsiRNAを悪性中皮腫の培養細胞に投与し、遺伝子の発現を抑制して、悪性中皮腫細胞の細胞増殖抑制を指標に効果のあるsiRNAを選別しました(図1)。
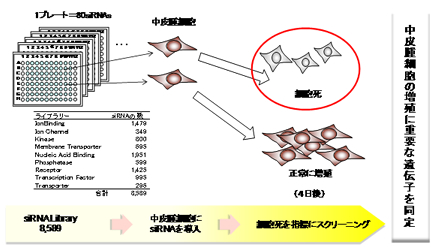
図1 悪性中皮腫の細胞増殖を抑制する遺伝子の探索
その結果、383遺伝子に対するsiRNAが、中皮腫肉腫型細胞の生存率を半分以下できることを見出しました。このうちの39遺伝子が、特に中皮腫細胞の生存に重要であることがわかりました。この39遺伝子の中から、遺伝子機能に関する情報をもとに選定した7遺伝子の発現を抑えることで、中皮腫肉腫型細胞に細胞死が誘導されることがわかりました(図2)。また、この中のCOPA遺伝子は、中皮腫肉腫型細胞で高く発現し、正常中皮細胞や他の腫瘍では、ほとんど発現しないことがわかりました(図3)。さらに、中皮腫モデルマウスにおける治療実験から、COPA遺伝子に対するsiRNAに増殖抑制効果があることを確認しました(図4、5)。
つまり、中皮腫肉腫型細胞に特有に発現するCOPA遺伝子を発見し、モデルマウスによる治療実験で、COPA遺伝子に対するsiRNAに増殖抑制効果(中皮腫肉腫型細胞に細胞死が誘導される)があることを確認しました。
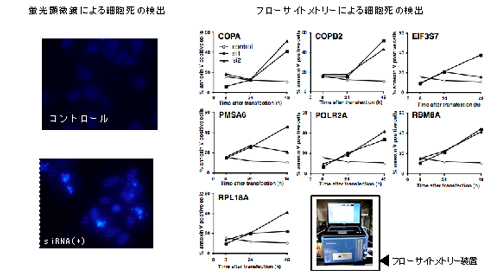
図2 細胞死の解析
核染色をした細胞を蛍光顕微鏡で観察したところ、正常細胞(左上図)と比べsiRNAを導入した細胞は細胞死による核凝集が起きていることがわかった(左下図)。また、フローサイトメートリーによりsiRNA導入後細胞死が進むことがわかった(右グラフ)。
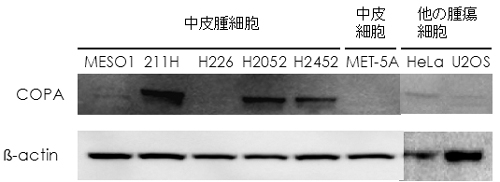
図3 COPAタンパク質の発現
COPAタンパク質は正常中皮細胞や他の腫瘍ではほとんど発現しておらず、肉腫型を含む中皮腫細胞に特異的に発現している。これまで上皮型で特異的に発現しているタンパク質は知られていたが、肉腫型で特異的に高発現するタンパク質は報告されていなかった。
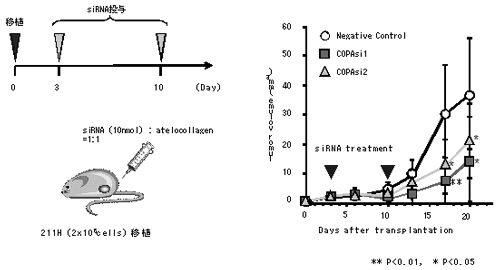
図4 COPA siRNAの腫瘍増殖抑制効果
肉腫型中皮腫細胞を移植したマウスにCOPA遺伝子に対するsiRNAを投与したところ、中皮腫細胞の増殖を抑えることができた。
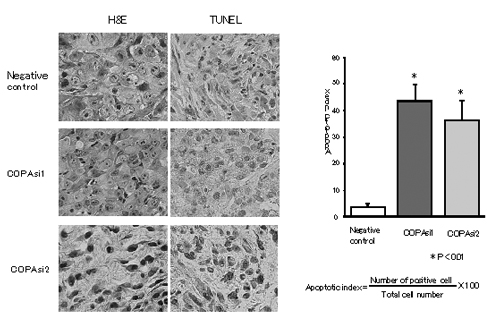
図5 腫瘍モデルでの細胞死の検出
図4で示した治療効果実験のうち、COPA遺伝子に対するsiRNA投与2日後の細胞死を検出した。左図はH&E法、TUNEL法で染色したもの。細胞死を茶色に染色するTUNEL法により、siRNAを投与後に細胞死が起きていることがわかった。
本研究の成果と今後の展開
COPA遺伝子は、悪性中皮腫の肉腫型に高発現していることから、これの診断・治療薬の標的分子として期待されます。今回COPA遺伝子に対する2種類のsiRNAが腫瘍モデルマウスにおいても増殖抑制効果があることが判明しており、生体内で分解を受けやすいsiRNAを効果的に悪性中皮腫に運搬することができるドラッグデリバリーシステム※6と組み合わせることができれば、核酸治療薬として使われることが期待されます。また、COPA遺伝子を標的とした低分子化合物を探索することで、効果の高い分子標的治療薬の開発も期待されます。
今後、臨床研究を経て、臨床現場で実用化されれば、多くの患者さんの予後のQOL改善に大きく貢献することが期待されます。また、アジアなどの国々では、日本に遅れてアスベストの使用を禁止したため、数年のタイムラグを置いて日本と同じように患者が発生することが懸念されます。本研究のような悪性中皮腫の新しい治療薬開発につながる研究は、これらの国々への貢献という意味でもたいへん意義深い研究成果と言えます。
用語解説
※1 分子イメージング
生体内で起こるさまざまな生命現象を外部から分子レベルで捉えて画像化することであり、生命の統合的理解を深める新しいライフサイエンス研究分野。
体の中の現象を、分子レベルで、しかも対象が生きたままの状態で調べることができる。がん細胞の状態や特徴を生きたまま調べることができるため、がんができる仕組みの解明や早期発見を可能とする新しい診断法や画期的な治療法を確立するための手段として期待されている。放射線医学総合研究所(放医研)分子イメージング研究センターは、文部科学省委託事業分子イメージング研究プログラムのPET疾患診断研究拠点として研究活動を行っている。
※2 中皮腫(悪性中皮腫)
肺を包む「胸膜」、肝臓や胃などの臓器を覆う「腹膜」、心臓を包む「心膜」の表面に存在する中皮細胞に由来する腫瘍を悪性中皮腫という。稀ながんと言われてきたが、アスベストの使用禁止措置が遅れたため、患者さんが増加しており、労災にも指定されている。非常に予後の悪いがんで5年後生存率は10%以下であると言われる。
※3 siRNA(small interfering RNA)
低分子二本鎖RNAで、標的となるRNAに結合し分解を誘導することで、特定の遺伝子の発現を抑えることができる。ライフサイエンス分野で、遺伝子の機能解析によく使われるだけでなく、核酸医薬として臨床応用も期待されている。なお、RNA(ribonucleic acid;リボ核酸)とは、DNA(deoxyribonucleic acid)と同様に核酸の一種であり、生体内で遺伝子情報の伝達、アミノ酸の運搬、タンパク質の合成など様々な働きをしている。
※4 COPA遺伝子
酵母からほ乳類まで広く遺伝子配列が保存されているタンパク質で、ゴルジ体から小胞体へのタンパク質の逆輸送およびゴルジ体内のタンパク質の輸送を担っている複合体のサブユニットのひとつ。COPAタンパク質の一部である25アミノ酸は、生理活性ペプチドの一種であり、消化管ホルモンとして働くと考えられている。
※5 クボタショック
大手機械メーカー・クボタから公表されたアスベスト(石綿)による健康被害のこと。同社の旧工場の従業員および工場周辺住民がアスベストによって中皮腫等の関連疾病の被害を受けた。
※6 ドラッグデリバリーシステム(drug delivery system;DDS)
薬剤の体内動態を制御するシステム全般のこと。血中の薬剤濃度を制御することや特定の部位に効率よく薬剤を運搬することなどが可能である。効果の増強や副作用の低減が期待できる。
問い合わせ先
国立研究開発法人 放射線医学総合研究所 企画部 広報課
Tel:043-206-3026
Fax:043-206-4062
E-mail: info@nirs.go.jp
