平成23年5月16日
独立行政法人 放射線医学総合研究所(理事長:米倉 義晴)
重粒子医科学センター 次世代重粒子治療研究プログラム
崔(サイ)星(セイ)主任研究員
本研究成果のポイント
がんの術後再発、転移、放射線や化学療法の抵抗性と深く関わっているとされるがん幹細胞※1を、重粒子線※2がより強く殺傷することにより増殖が抑制されることを解明し、このことにより重粒子線治療が高いがん治療効果をもたらすことを世界で初めて明らかにした。
独立行政法人放射線医学総合研究所(以下「放医研」)重粒子医科学センター※3(センター長 鎌田 正)・次世代重粒子治療研究プログラムの崔星主任研究員らは、X線照射に比べ重粒子線(炭素線)照射が、がんの手術後の再発、転移、放射線や化学療法の抵抗性と深く関わっているとされるがん幹細胞※2を、より強く殺傷することを解明し、このことが重粒子線がん治療における高い治癒率をもたらす重要なメカニズムの一つであることを世界で初めて明らかにしました。
今回の研究では、細胞レベルにおいて同じ生物効果を持つ線量※4でも重粒子線はX線に比べ2.1-2.3倍強く大腸がんのがん幹細胞を殺傷することを明らかにしました。さらに、動物に移植したがん幹細胞を含んだ大腸がん細胞に対し、同じ生物効果を持つ線量でも重粒子線はX線に比べ、3.1-3.3倍高い増殖抑制能力を有し、がん幹細胞マーカー※5の発現を抑制することを見いだしました。今後、がん幹細胞マーカーを用い、がん幹細胞を標的とした重粒子線治療を行うことによりがん治療成績の更なる向上につながる可能性があります。
本研究は、放医研と千葉大学大学院医学研究院との共同研究による成果で、2011年5月15日号の米国がん学会誌Cancer Researchに掲載されます(会員向けのオンライン版では3月31日に掲載済み)。
研究の背景と目的
大腸がんは、ここ数十年以来、食生活の欧米化に伴い、罹患数が急増し、2001年には大腸がんの罹患数は毎年10万人を超え、2009年の大腸がん(結腸と直腸のがんの和)による死亡数は男性で3位、女性で1位となっています。大腸がんは部位により、結腸がん、直腸がん等に分けられ、再発病巣に対する治療方針は外科的切除が第一に選択されるものの、切除不能なものが多いことが特徴です。直腸がん術後再発例が難治性である理由の一つとして、がん幹細胞が中心的に関わっている可能性があり、X線による治療や抗がん剤治療では効果があまり期待できません。しかし、放医研では直腸がん術後再発例に対し、300例近い重粒子線を用いたがん治療を行っており、良好な治療成績が得られています。
放医研重粒子医科学センターでは、大腸がん術後再発の治療などの重粒子線がん治療の成功例から、なぜ重粒子線がX線による治療に比べて有効か等を生物学的に解明し、さらに有効な放射線治療法を提案すべく基礎研究にも取り組んでいます。すでに、重粒子線で破壊されたDNAは修復されにくいこと、酸素濃度の低い部分でも殺傷力があることなどがわかっていますが、今回の研究では、手術後の再発、がんの転移、放射線療法や化学療法の抵抗性と深く関わっているとされるがん幹細胞に着目し、重粒子線がん治療のメカニズムを解明しました。
研究手法と結果
本研究では、ヒト大腸がん由来細胞※6を用い、重粒子線とX線の照射によるがん幹細胞とそれ以外のがん細胞における細胞致死効果の違いと重粒子線とX線の照射効果の差によるがん細胞増殖への影響を様々な手法を用いて解析しました。
同じ生物効果をもたらす線量※4のX線や重粒子線を照射した後、3種類のがん幹細胞マーカー(CD133、CD44、ESA)について、その割合を解析したところ、X線を照射したものの方が重粒子線を照射したものに比べ、幹細胞マーカーの割合が大きいことを見いだしました(図1A)。これはがん幹細胞のX線と重粒子線に対する抵抗性の違いによるものと考えました。がん幹細胞はX線に対し抵抗性を示すため、X線は主にがん幹細胞以外のがん細胞を殺傷し、その結果、がん幹細胞の割合が増加したと考えられます。一方、重粒子線はがん幹細胞もそれ以外のがん細胞も同時に殺傷しているために、がん幹細胞の割合がほとんど変わらなかったものと考えられます。実際、CD133を持たない非がん幹細胞集団(CD133-)はX線と重粒子線に対し共に抵抗性が低く、同じような感受性を示しましたが、CD133を持つがん幹細胞集団(CD133+)に対しては、同じ生物効果をもたらす線量※4を照射した場合、重粒子線はX線に比べ2.1-2.3倍強くがん幹細胞を殺傷していることが認められました(図1B)。CD44とESAのマーカーを持たない非がん幹細胞集団(CD44-/ESA-)とCD44とESAを持つがん幹細胞集団(CD44+/ESA+)との間でも同じような傾向が見られました。
細胞レベルにおいて、がん幹細胞への重粒子線の影響が確認できたので、次に動物組織内でのがん幹細胞への影響と効果を調べました。実験としては、ヌードマウスの下肢にがん幹細胞を含む腫瘍を移植後、X線あるいは重粒子線を照射し、非照射群と合わせて腫瘍増殖遅延曲線を求めました。腫瘍増殖遅延曲線から、X線に対する重粒子線の腫瘍抑制能力は3.1~3.3倍高い値となりました(図2)。照射1カ月後に腫瘍を観察すると、重粒子線15Gyを照射したものはX線30Gy照射のものに比べがん細胞がより多く破壊され、繊維化、空洞化が顕著であり、血管新生も乏しくなりました。また、腫瘍病理標本から前述の3種類のがん幹細胞マーカーの発現を解析したところ、重粒子線15Gy照射では発現が抑制されているのに対し、X線30Gy照射ではむしろ増強されることがわかりました(図3)。なお、重粒子線30Gyの時はほぼ消失していました。
以上より、ヒト大腸がん細胞において、重粒子線はX線照射に比べ、術後再発、転移、放射線や化学療法の抵抗性と深く関わっているとされるがん幹細胞をより強く殺傷することがわかりました。
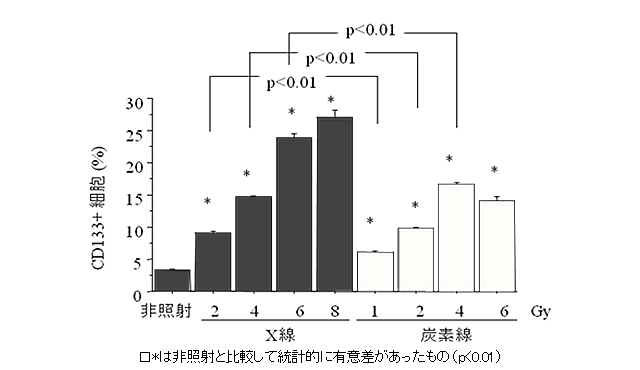
図1A.X線・重粒子線照射48時間後のCD133が検出される細胞の割合変化は、同じ生物学的効果をもたらす線量において、重粒子線照射したものに比べ、X線照射をしたものの方が多かった。CD44、ESAにおいても同様の結果が得られた。有意差検定は、X線2Gyと重粒子線1Gy、X線4Gyと重粒子線2Gy、X線8Gyと重粒子線4Gyの間で行った。
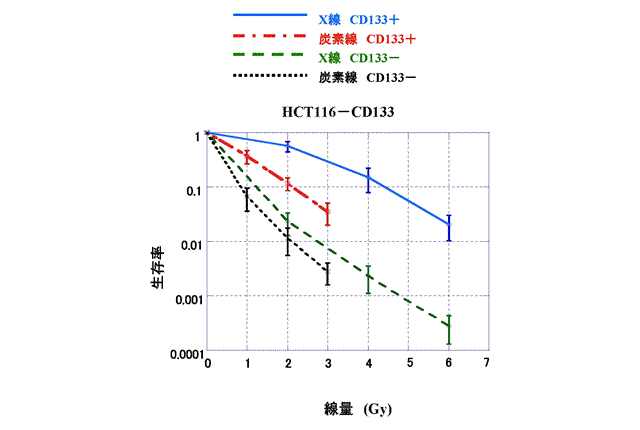
図1B.横軸は照射した線量を、縦軸は照射直後の細胞の生存率を示す。HCT116細胞(ヒト大腸がん由来細胞の一種)から分離収集した非がん幹細胞CD133-細胞集団はX線(緑:破線)や重粒子線(黒:点線)に対し共に感受性を示し、X線、重粒子線照射に共に抵抗性が低く、差があまりみられなかった。がん幹細胞CD133+細胞集団はX線、重粒子線照射に共に抵抗性を示したが、10%細胞生存率(縦軸の生存率が0.1の時の値)におけるX線の効果(青:実線)に対する重粒子線(赤:一点鎖線)の効果は2.1-2.3倍も高かった。
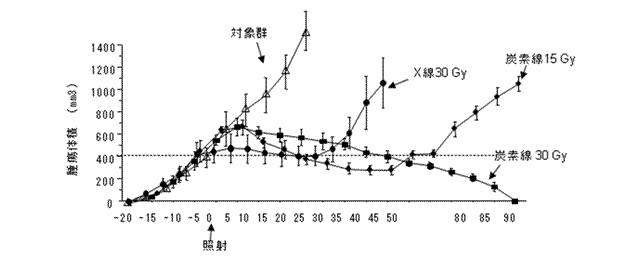
図2 ヌードマウス移植腫瘍に対し、線量を変えて照射した。縦軸は腫瘍体積(mm3)を、横軸は日数を示す。同じ線量で重粒子線はX線照射に比べ3.1-3.3倍高い腫瘍抑制効果が得られた。
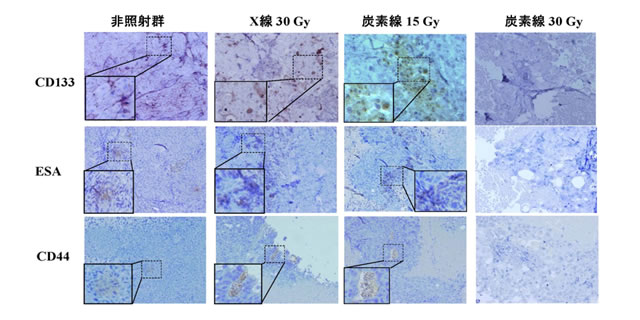
図3 HCT116細胞(ヒト大腸がん由来細胞の一種)をヌードマウスに移植したものに放射線を照射後、1カ月経たものを腫瘍病理標本とし、免疫組織学染色法解析を行った。がん幹細胞マーカーを発現している細胞は茶色に染まっている。いくつかの視野で統計をとったところCD133、ESA、CD44のいずれのがん幹細胞マーカーの発現も重粒子線照射15Gyの場合は抑制されているが、X線照射30Gyの場合は促進されていた。特にCD133はこの図でも見てわかるように顕著である。一方、重粒子線30Gyの時はほぼ消失していた。
本研究成果と今後の展望
重粒子線の大腸がんに対する強い腫瘍増殖抑制や高い治癒率が得られる重要なメカニズムとして、X線照射に比べ重粒子線はより強くがん幹細胞を殺傷することを世界で初めて明らかにしました。がん幹細胞を選択し、かつ重粒子線で残さず照射することにより、がんの治療効果や治療効率を高めることが期待できます。このように重粒子線を用いたがん幹細胞の根絶を目的とした基礎的研究は、重粒子線治療でも十分な効果が得られていない膵臓がんなど難治性がんについて、がん幹細胞のイメージングによりそこへ線量を集中させるなど、治療成績向上のための新しい治療法開発に役立つ可能性があります。これらに関して、現在、放医研において研究を進めているところです。
用語解説
※1 がん幹細胞
がん幹細胞(がんかんさいぼう)は、がん細胞のうち幹細胞としての性質を持った細胞。具体的には分裂して自分と同じ細胞を作り出す自己複製能やいろいろな細胞に分化できる多分化能を持つ。がんの再発、転移、放射線や化学療法抵抗性に深く関わっているとされ、がんを根治できるか否かを決定する要因と考えられている。実験上ではがん幹細胞は表面マーカーによりがん幹細胞を多く含むと考えられる集団を同定したものが多いため、最近は、がん幹細胞様細胞と呼ばれることが多い。
※2 重粒子線
ヘリウム以上の元素をイオン化し、それを加速器で高速に加速して作られる放射線の一種。放射線医学総合研究所では炭素イオンを加速して重粒子線(炭素線)としている。このプレスリリースでは、「重粒子線」は「炭素線」を示す。
※3 重粒子医科学センター
放射線医学総合研究所の5つの研究センターの1つで、主に、炭素イオンを加速器で高速に加速して作られる重粒子線によるがん治療および関連の研究開発などを行っている部署である。重粒子線による最先端の放射線治療を主導する研究機関として、治療法のさらなる高度化と全国的な普及を目指した研究開発に取り組んでいる。当センターで行っている重粒子線がん治療は、厚生労働省の先進医療として承認され、平成6年の治療開始以来、登録患者数は5887名(平成23年2月現在)であり、年々増加している。本成果は、重粒子線がん治療を推進するために必要な基礎生物学などの研究成果の一つとして得られたものである。
※4 同じ生物効果をもたらす線量
放射線の影響は、物理的には吸収したエネルギーで示されること(吸収線量)が多いが、放射線の種類によって、生物に与える影響は大きく変わるので、それを踏まえて線量を用いた。一般的に10%生存率を基準とし、本研究で使った大腸がん細胞に関しては、重粒子線の線量効果はX線の大体1.6-1.7倍の線量効果に相当する。今回は、目安としてX線2Gyあたり重粒子線1Gyの線量と比較検討している。この比率を示すものとしては生物学的効果比(RBE:Relative Biological Effectiveness)があり、着目している放射線と基準となる放射線が同じ生物効果を与えるのに必要とする吸収線量の割合として示され、基準放射線には、通常X線が用いられる。
※5 がん幹細胞マーカー
がん幹細胞を識別するためのマーカー。細胞膜表面に発現する抗原である表面マーカーであることが多い。CD133等は多くの腫瘍のがん幹細胞マーカーとして知られている。がん種によって表面マーカーが異なるが、今まで、大腸がん、膵臓がん、肝がん、前立腺がん、脳腫瘍など多くの固形腫瘍でそれぞれ特異的ながん幹細胞マーカーの存在が確認されている。
※6 ヒト大腸がん由来細胞
今回は、HCT116、SW480細胞の2種類の大腸がん細胞を使用した。それらからがん幹細胞マーカーであるCD133、CD44、ESA蛍光抗体を用い、それぞれのがん幹細胞を同定・分離・収集した。細胞レベルでは自己複製能がなければできない細胞の塊を形成する能力(コロニー形成能、スフェロイド形成能)が有意に高く、個体レベルでは免疫不全マウスに移植し腫瘍形成能が有意に高いことから、CD133+細胞集団やCD44+/ESA+細胞集団ががん幹細胞性質を持っていることを確認している(図4)。
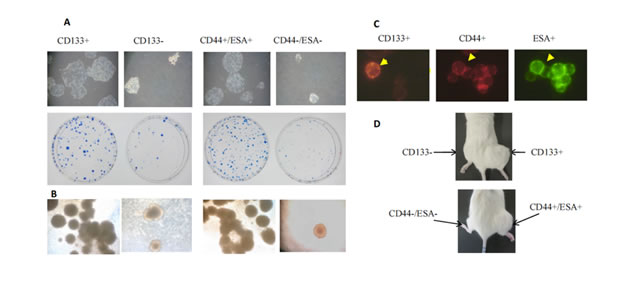
図4 HCT116細胞(ヒト大腸がん由来細胞の一種)由来のCD133+やCD44+/ESA+細胞集団はCD133-やESACD44-/ESA-細胞集団に比べ、(A)コロニー形成能(平板での塊の個数)、(B)スフェロイド形成能(細胞の丸い塊の個数)、(C)はがん幹細胞マーカー陽性の細胞の代表例を示したものである。CD133抗体とCD44抗体はフィコエリトリン(PE)という赤の蛍光色素、ESA抗体はフルオレセインイソチオシアネート(FITC)という緑の蛍光色素で細胞表面が標識されている。(D)免疫不全マウスに移植し腫瘍形成能が有意に高いことが確認された。これは、CD133+やCD44+/ESA+細胞集団ががん幹細胞性質を有することを意味する。
プレスリリースのお問い合わせ
ご意見やご質問は下記の連絡先までお問い合わせください。
独立行政法人 放射線医学総合研究所 企画部 広報課
Tel:043-206-3026
Fax:043-206-4062
E-mail:info@nirs.go.jp
