世界初、ナノインプリンティング技術を駆使し、生体内腫瘍の特徴を再現する新しい3次元がん細胞培養に成功
平成23年5月24日
独立行政法人 放射線医学総合研究所(理事長:米倉 義晴)
国立大学法人 福井大学
分子イメージング研究センター分子病態イメージング研究プログラム
吉井幸恵 研究員
本研究成果のポイント
- ナノインプリンティング表面加工プレートを作成し、簡便・均一・再現性の高い三次元(3D)がん培養を実現
- がんの治療抵抗性・転移再発に関わる病態(細胞遊走・細胞間接着・低酸素)の再現に成功
- 低酸素イメージングプローブ開発、新規抗がん剤開発、がん病態研究に有用な技術
独立行政法人放射線医学総合研究所(以下、放医研)分子イメージング研究センター分子病態イメージング研究プログラム(佐賀恒夫プログラムリーダー)の吉井幸恵研究員は、ナノインプリンティング※1表面加工プレート(Nano culture plate)を用いてがん治療を妨げるいくつかの特徴を再現する3Dがん培養法※2の開発に世界で初めて成功しました。これまでのがん研究では、培養器底面の平面上で培養した2D培養がん細胞を用いており、立体構造を持つ生体内の腫瘍組織と多くの点で性質が異なることが問題となっていました。この解決法として、3Dがん細胞塊(スフェロイド)の培養が検討されてきましたが、煩雑性、不均一性、低再現性等の問題がありました。本法は、簡便に・均一で・再現性よく3Dがん細胞を培養できることに加え、がんの治療抵抗性や転移・再発に関わる現象(がんの細胞遊走※3・高増殖能・細胞間接着※4・低酸素領域※5形成)を培養系において再現できる点で画期的な技術です。このため、本培養法を用いがん分子イメージング※6・治療に対する薬剤開発を行うことで、難治性がん※7の治療効果を飛躍的に高めることが可能になると期待されます。
本研究は、福井大、Scivax(サイヴァクス)株式会社、早稲田大、米国テキサス大との共同研究であり、文部科学省「分子イメージング研究戦略推進プログラム」及び日本学術振興会「科研費若手研究(B)(課題番号21791176)」の一環として行われたものです。本成果は、生体材料・ナノテクノロジーの研究分野で世界的権威のある「Biomaterials」誌オンライン版に2011年5月26日頃に掲載予定です。
研究の背景と目的
がんは、日本人の死亡原因の第1位を占める疾患で、その病態解明やより効果的な診断法・治療法の開発が求められています。従来のがん研究は、一般に、がん細胞を培養器底面の平面上で培養する2D培養がん細胞を用いてきました。しかしながら、2D培養がん細胞は、立体構造を持つ生体内腫瘍と多くの点で異なることが指摘されており、がんを研究する上で問題となっていました。これに対し近年、立体構造を有する3Dがん細胞塊(スフェロイド)は、2D培養がん細胞よりも生体内腫瘍と近い性質を有し、がんの医学生物学研究や抗がん剤開発の上で有用なモデルとなるのではないかと考えられてきました。
しかしながら、既存の3Dがん細胞培養法では、作成過程が煩雑である、細胞生存率や再現性が低くなる、外来の接着物質(細胞外マトリックス※8)等が必要になるなどの様々な問題があり、がん培養モデルとしての応用は困難な状況でした。特に、抗がん剤開発における薬剤スクリーニング※9には、簡便、均一、高再現性の3Dがん細胞培養モデルが求められています。
そこで、我々は、Scivax株式会社と共同で、この問題を克服する新しい概念の3Dがん細胞培養法(以下、新培養法)を開発しました。ナノインプリンティングによって表面加工を施した培養器を用いる本法は、簡便、均一、高再現性の3Dがん培養モデルを形成できるほか、がんの細胞遊走・高い増殖能・細胞間接着・低酸素領域形成といったがんの治療抵抗性や転移・再発に関わる性質を培養系で再現することができるので、がん研究において非常に画期的な技術です。以下に、その研究手法と結果の詳細をお示しいたします。
研究手法と結果
新しい3Dがん細胞培養プレートによる簡便な培養
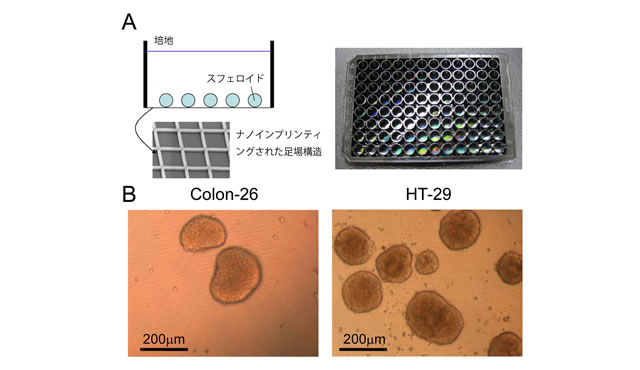
今回の研究では、がん細胞がスフェロイドを形成する最適な格子幅等を検討した結果から、ナノサイズの凹凸の格子構造を底面に持つ培養プレート(ナノインプリンティング表面加工プレート;Nano culture plate、以下NCP、図1A)を作成するとともに、様々ながん細胞を本培養プレート上に播種し、通常細胞培養に用いられる培地で1週間培養するだけで、簡便にスフェロイドを形成できることを確認しました。(図1B)
図1 A:使用したNano culture plate(NCP)。透明シート上にナノインプリンティングによりナノサイズ(ライン幅500nm、ライン深度1μm、格子幅2μm)の凹凸の格子構造を表面加工し、これを底面に使用。左は格子構造の拡大図とスフェロイドとの関係、右はNCPの全体像(128mm×85 mm)、B:新培養法による典型的なスフェロイド。(大腸がん細胞株Colon-26、ヒト結腸腺がん由来細胞株HT-29;スフェロイドの直径は200μm-300μmに達する)。
がんの細胞遊走・細胞間接着によるスフェロイド形成
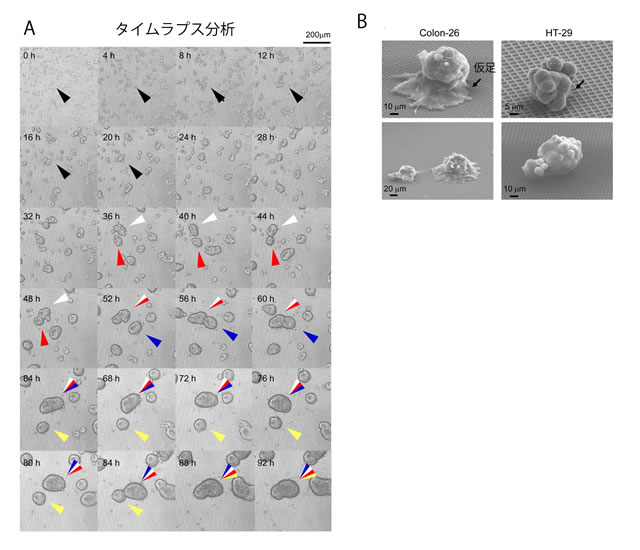
新培養法におけるがん細胞の挙動をタイムラプス分析※10で詳細に観察した結果、がん細胞は、自発的に遊走し、互いに接着を繰り返すことで、スフェロイドを形成していました(図2A)。また、走査型電子顕微鏡による観察では、がん細胞が、培養器底面の格子構造を足場として仮足を伸ばし、底面に付着し遊走していることがわかりました(図2B)。こうしたがん細胞の遊走行動や細胞間接着は、既存の3Dがん細胞培養法では、形成・観察が困難な現象でした。
図2 A:新培養法のよる細胞挙動のタイムラプス分析(4時間ごと、4.5日間の解析、HT-29細胞)、B:スフェロイド構造の走査型電子顕微鏡観察、仮足を伸ばし底面の格子構造に接着している様子が観察できる。
高増殖能・高生存率を保った高再現性の3Dがん細胞培養を実現
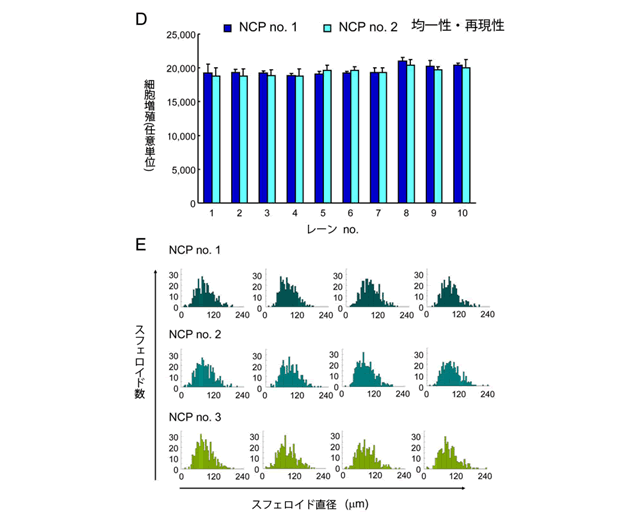
新培養法では、細胞が2Dがん細胞培養とほぼ同等の速度で増殖していました(図3AB)。また、培養細胞は、既存法と比較して高い細胞生存率を維持していました(図3C)。また、従来の培養法では、不均一性、低再現性が問題とされてきましたが、本培養法では、抗がん剤のスクリーニングを行う際に必要となる均一性・再現性を有していることが確認されました(図3DE)。これは、培養器の均質な足場構造によるものと考えられます。
図3-1 A:新培養法による細胞の増殖2種類のがん細胞において、2D培養と比較しても遜色ない増殖を示している。B:培養時の形態培養7日後において、新培養法では3Dスフェロイドを形成している一方、2D培養では、細胞密度が高まりそれ以上増殖できない状態になっている。C:各培養法による死んだ細胞の割合(死細胞率)少ない方が生存率が高い。比較として2Dの培養の他に、特徴のある低接着性プレート2種類(A,B)を用いて既存3D培養を行った。2D培養と比較してもほとんど同じ生存率を示すが、既存3D培養と比較すると新培養法の方が生存率が高い。*=P<0.05で有意差がある。†=有意差なし。
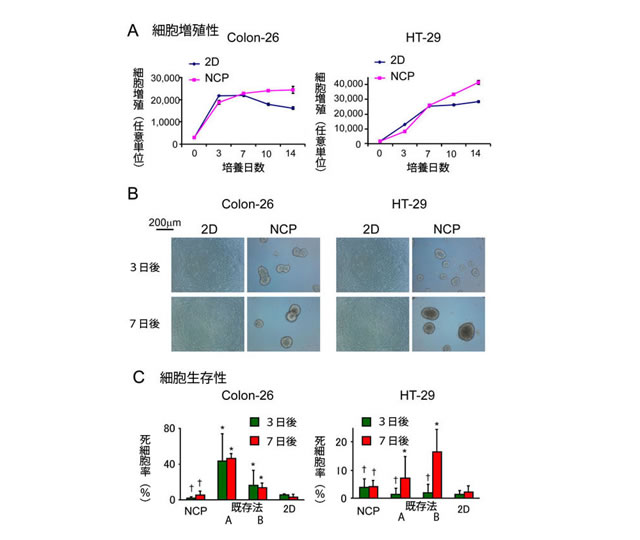
図3-2 D:新培養法による細胞数の均一性・再現性各サンプル間の培養後5日後の細胞増殖において有意差は見られなかった。E:新培養法によるスフェロイド直径の均一性・再現性各サンプル間のスフェロイド直径の頻度を示すグラフ各サンプル間のスフェロイド数、スフェロイド直径の分布に有意差は見られなかった。
スフェロイドの詳細な構造・低酸素領域形成
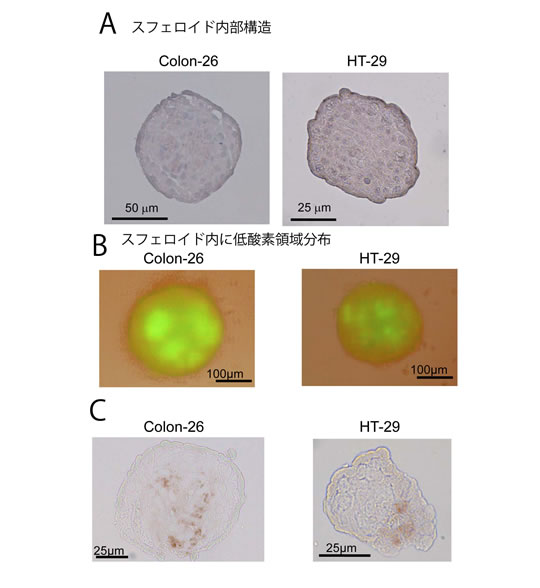
新培養法によるがん細胞スフェロイドの内部構造を凍結切片の染色により観察したところ、スフェロイド内部は細胞が密に集合していることが観察されました(図4A)。また、その中心部には低酸素領域が形成されていることが明らかとなり(図4BC)、新培養法は、腫瘍の低酸素領域の研究に有用であることが示されました。さらに、このスフェロイドの遺伝子発現をDNAマイクロアレイ法※11によって検討した結果、腫瘍の悪性化と関わる様々な遺伝子群の発現が上昇していることが明らかとなり、このスフェロイドは、生体内腫瘍と同様に、低酸素状態に応答していることがわかりました。
図4 A:新培養によるがん細胞スフェロイドの内部構造スフェロイドの凍結切片をヘマトキシリン-エオジン染色したもので、細胞一つ一つが着色されている。内部には、空隙が存在せず、細胞が密に詰まっていることがわかる。B:スフェロイド内部の低酸素領域形成(1)緑色の部分はスフェロイド内部における低酸素応答因子(HIF-1)が活性化しているところ。HIF-GFP reporter遺伝子導入がん細胞を用いて常酸素条件下でスフェロイドを形成したものを使用。C:スフェロイド内部の低酸素領域形成(2)色の濃い部分が低酸素領域。低酸素マーカーpimoniDazolがスフェロイド内部に集積している様子がわかる。サイズはBの半分以下であり小さなスフェロイド内部でも低酸素領域が形成されているのがわかる。
本研究成果と今後の展望
本研究により、ナノインプリンティング技術を駆使した培養器を用いることで、簡便で、均一性と再現性に優れた新しい3Dがん細胞培養法を開発することに初めて成功しました。本技術は、既存の3D培養法では再現できなかったがんの細胞遊走・増殖・細胞間接着・低酸素領域形成といった性質を再現することを可能にしました。こうした性質は、がんの治療抵抗性や転移・再発に関わる現象であるため、本培養法を用いがん分子イメージング・治療に対する薬剤開発を行うことで、難治性がんの治療効果を飛躍的に高めることが可能になると期待されます。特に、本モデルは、腫瘍内低酸素領域を模倣するモデルであることから、低酸素イメージングプローブの開発・評価に有用であると考えられます。こうしたことから、今後放医研では、本培養法を用いた様々ながんにおけるハイスループット・ハイコンテント薬剤スクリーニング※9を行い、より効果の高いがん診断薬・治療薬の開発を目指します。
用語解説
※1 ナノインプリンティング
ナノスケールの超微細構造を物質表面に加工する技術。ナノインプリンティングは,まず金型を作製し,それを用いてプレス成形するなどの方法で行われ、工業分野の他、医療分野においても、次世代の技術として期待されている。本研究ではナノインプリンティングを用いることにより均質な格子構造を作成することができ、細胞に対しては均質な足場構造を提供できる。
※2 3Dがん培養モデル
従来がん研究で用いられていた平面上の2D培養法に比較して、立体的な多細胞体構造のがん細胞を培養したもの。生体内の立体構造を持つ腫瘍本来の性質を調べるのに適するとして、がん研究・薬剤開発のスクリーニング等の分野で近年注目されている。
※3 細胞遊走
一般的には細胞が走性を示すことをいう。がん細胞の場合は、腫瘍塊から離れて走性を示すことで、血管に入り全身に広がる。そのため、転移の原因となる。
※4 細胞間接着
細胞が別の細胞にくっつくこと。がん細胞の場合は、遊走している細胞が組織や臓器の細胞にくっつくことでその組織や臓器において増殖を開始する。そのため、転移の原因となる。
※5 低酸素領域
酸素が乏しい領域。生体内の腫瘍組織では、がん細胞が活発に増殖するため、血管新生が追い付かず、しばしば低酸素状態が生じることが知られている。また、低酸素下におかれたがん細胞は、化学治療・放射線治療に対し抵抗性を持つため、しばしばがんの転移・再発の原因となることが知られている。
※6 がん分子イメージング
がんの有する様々な特徴を外部から分子レベルで捉えて画像化する手法。がん診断・がんの病態解明・治療効果予測など、医療分野において様々な応用が期待されている。放射線医学総合研究所分子イメージング研究センターは、文部科学省委託事業「分子イメージング研究戦略推進プログラム」の一環として、低酸素がんに対する分子イメージングプローブの研究開発・評価に取り組んでいる。
※7 難治性がん
治療に反応しないあるいは抵抗性を示すがん。多くの難治性がんでは、低酸素環境に適応応答していることが知られ、この低酸素適応応答が難治性の原因の一つとなっていると考えられている。
※8 細胞外マトリックス
生体内において、細胞外に存在する生体由来物質の総称。細胞接着や増殖に関係する物質が含まれる。既存の3Dがん細胞培養法の中でよく用いられている方法の一つに、培養器底面を細胞外マトリックスでコートし、その上で3Dがん細胞スフェロイドを形成させる方法がある。
※9 薬剤スクリーニング
疾患に対する標的薬剤の発見プロセス。薬剤スクリーニングでは多くの場合、最初のステップとしてハイスループットスクリーニングが行われる。これは、膨大な化学物質ライブラリーを用いて薬効試験を行い、その過程で薬効の乏しい薬剤をふるいにかけ、有効薬剤を選択する。また、近年、蛍光顕微鏡等の画像解析技術を組み合わせ、多元的に、薬剤が細胞に及ぼす影響を解析するハイコンテントスクリーニングも新薬発見プロセスを飛躍的に向上させる方法として期待されている。
※10 タイムラプス分析
経時的に顕微鏡下にある細胞の挙動を観察する分析手法。
※11 DNAマイクロアレイ法
ゲノム中のすべての遺伝子の発現量を一度に解析できる手法。
プレスリリースのお問い合わせ
ご意見やご質問は下記の連絡先までお問い合わせください。
独立行政法人 放射線医学総合研究所 企画部 広報課
Tel:043-206-3026
Fax:043-206-4062
E-mail:info@nirs.go.jp
