2014年1月3日
独立行政法人放射線医学総合研究所
本研究成果のポイント
- iPS細胞※1形成が数百の点突然変異※2を伴うことを証明。
- iPS細胞とES細胞※3のゲノム点突然変異の頻度比較に成功。-ES細胞の変異の数は、iPS細胞の1/10-1/20倍
- iPS細胞ゲノム突然変異発生タイミングの特定。-体細胞からiPS細胞への転換初期に多くの点突然変異が生じる
独立行政法人放射線医学総合研究所(以下、放医研)研究基盤センターの杉浦真由美元主任研究員(現奈良女子大学)、笠間康次主任技術員、荒木良子室長、安倍真澄特別上席研究員らの研究チームは、iPS細胞ゲノムに観察される点突然変異は、iPS化の過程の極初期に起きたものであることを発見しました。これまでは、点突然変異のほとんどがiPS化する前の細胞に既に存在していたと考えられていましたが、これを覆す結果です。この成果は、米国科学雑誌「Stem Cell Reports」オンライン版に2014年1月3日2時(日本時間)に掲載される予定です。
iPS細胞ゲノム(1細胞で約30億塩基対)には数百から1000か所程度の点突然変異が存在することが既に報告されていましたが、これらの多くは、作成に用いた細胞に既に存在していたものという報告が続いていました。
研究グループは「iPS化が点突然変異を伴うのか?」という観点で、同じマウス系統からiPS細胞、及び同じ性質を有する幹細胞(ES細胞)を樹立し、最新の高速DNA塩基配列決定装置を用いて詳細な解析を行いました。世界で初めてES細胞における点突然変異の数を明らかにした結果、iPS細胞は、ES細胞に比べ点突然変異の数が多いこと、更に、iPS細胞に見られた変異の質もES細胞のものと異なることが明らかになりました。加えて、iPS細胞の細胞集団を1細胞毎に解析し、変異の履歴を追跡することにより、多くの点突然変異がiPS化の転換初期に生じていることも明らかにしました。
本成果は、iPS細胞に生じる突然変異の発生メカニズムを理解する上で極めて重要な発見です。
研究の背景と目的
2006年に山中伸弥京都大学教授らが開発したiPS細胞(induced Pluripotent Stem Cells、人工多能性幹細胞)は、皮膚等の患者由来の細胞にいくつかの遺伝子を導入することにより作ることができる幹細胞であり、再生医療や創薬研究への大きな貢献が期待されています。
しかし、iPS細胞には未解明の部分も多く、安全性の検証は簡単ではありません。その原因のひとつがゲノムに生じる突然変異です。これまでも、iPS細胞のゲノム解析が報告されていますが、調べられた全ての細胞株で、多少の差はあるものの、ゲノム全体で数百から1,000か所にも上る点突然変異の存在が示唆されています(樹立法による違いは見られていません)。そのうち数か所はたんぱく質の構造に関連する部位であったため、移植後のがん化などへの関与が懸念されています。そのため、現在では、実際に使用可能なiPS細胞の選別において、ゲノムの塩基配列解析が必要な検査項目と考えられています。しかし、検査だけでは明らかにリスクの高いiPS細胞を排除することはできても、安全性を保証することは容易なことではありません。そのため、突然変異の数は可能な限り抑えられる必要があります。
現在、これらの数百から1,000個にも及ぶ点突然変異がいつ発生したものか、という点が議論されています。点突然変異が1)iPS細胞作成前の元の細胞集団の一部に存在していたものなのか、それとも2)iPS細胞を形成する過程で生じたものなのか、という問いは、本細胞の医学利用という観点からはもちろん、iPS化メカニズムの解明という観点からも極めて重要な問題です。(図1)
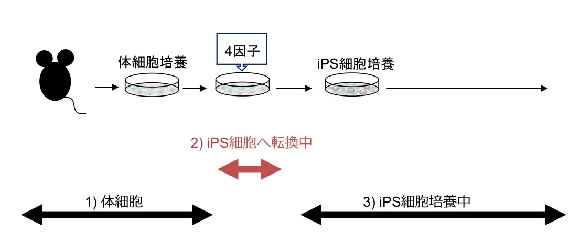
図1 点突然変異はいつ起こるのか?
研究手法と結果
ES細胞は、あらゆる点でiPS細胞の参考にされる細胞です。ES細胞は、受精卵からほんの少し発生が進んだ初期胚から作製します。そのため、ES細胞ゲノムの突然変異を解析する場合、父親、母親のゲノムを比較対照にする必要があるため、これまで報告がありませんでした。そこで、研究チームは、マウスiPS細胞の点突然変異の量と質を、ES細胞のそれらと比較することにしました。変異は、細胞を培養するだけで蓄積してしまうことを想定し、詳細な変異解析を実現するために、次のような注意深い準備を行いました。例えば、iPS細胞とES細胞を同じ系統のマウスから樹立する、両者の培養期間をそろえる、培養液の組成も一致させる、などです。ゲノムの配列の解析は、特定の領域のみでなく、なるべく広く調べるため、最新の大規模シーケンシング技術を用いて全ゲノムシーケンシング(以下WGS)を試み、マウスの全ゲノム約30億塩基対のうち、50-60%という広い領域を解析しました。その結果、検出された点突然変異の数は、iPS細胞(6株)で215~574か所、ES細胞(4株)で13~37か所であり、iPS細胞にはES細胞の10-20倍の点突然変異が存在することが示されました(図2)
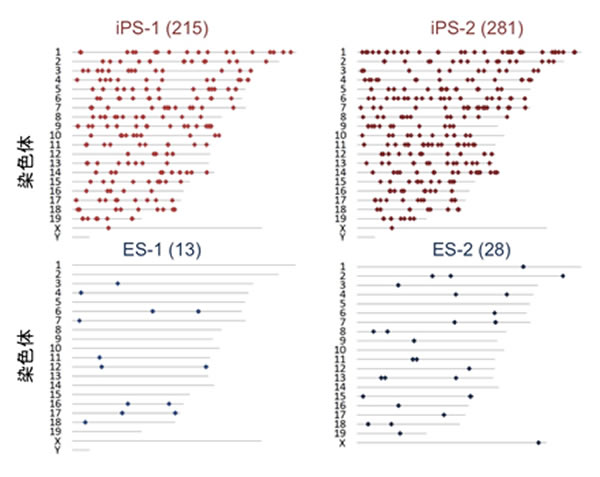
図2 検出された点突然変異の染色体毎の分布
上段はiPS細胞、下段はES細胞
(括弧内は検出された突然変異の総数)
続いて、それらの変異がiPS細胞を作製するときに用いた元の細胞の集団の一部に既に存在していたかどうか、元の細胞のゲノムの該当部位を調べましたが、ここに変異が存在していた証拠は見つかりませんでした。更に興味深いことに、iPS細胞集団に検出された変異は、ES細胞集団や、一般的に知られている細胞変異とは異なる特徴的な塩基置換のパターン※4を示しました。これらの結果は、ES細胞樹立には無いステップ、つまり、iPS細胞への転換に伴って点突然変異が生じていることを強く示していました。しかしながら、従来のアプローチや技術ではiPS細胞への転換時に生じた突然変異と、元の細胞に既に存在していた突然変異を正確に見分けることは極めて困難でした。そこで研究チームは、iPS細胞コロニー内に不均一性(異なる変異を有する細胞が存在すること)が生じているのではないかと考えました。まず、iPS細胞コロニーからゲノムを調製し、WGSの結果得られた点突然変異の存在頻度を解析したところ、この頻度が異なっていることが確認できました。ゲノムはひとつの細胞の中に父親由来と母親由来の合計2セットあり、同じ位置に同じ変異が両方のゲノムで生じることは確率的に無視できるので、コロニー内の全ての細胞に変異が存在する場合は、存在頻度50%となりますが、これに加え、25%、あるいはそれ以下の頻度で存在する点突然変異を多数見つけました。このような50%未満の頻度を示すものは、iPS化の前には存在しなかったもの、iPS化直後に生じたものと考えられます(図3)。
更に、ひとつのiPS細胞コロニー内の不均一性を確認する為に、コロニーを構成する細胞をひとつひとつばらばらにして、1細胞由来の細胞集団とし、それらのゲノムに存在する変異を調べてみました。もし、変異が元の細胞ゲノムにすでに存在していたものであれば、1個1個の細胞全てが同じ変異を有するはずです。しかし、結果は異なりました。その異なるパターンを解析すると、細胞により、変異の組み合わせのパターンがいくつかに分類できることが分かりました。この結果は、iPS細胞転換初期に多数の変異が生じることに加え、その変異が入った順番という変異の歴史をも教えてくれました(図3)。
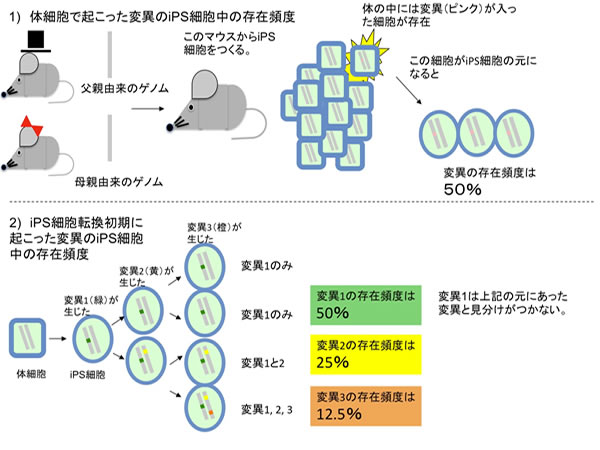
図3 iPS細胞集団中の変異の存在頻度の考察
本研究成果と今後の展望
本研究成果は、世界で初めて、iPS細胞とES細胞の突然変異の頻度の比較に成功し、また、iPS細胞「転換過程」においても突然変異が生じた痕跡を捉えたものです。今後は、我々が観察した現象が、より多くのiPS細胞樹立方法において確認される必要があります。そして、「何故iPS化の過程で突然変異が生じるのか」という問題を解くことが重要になります。iPS化で生じる突然変異が、ゲノム状態がリセット(初期化)され、様々な細胞に分化する能力を得るのに不可避な反応であるかも興味深い重要な問題です。このような問題が解決できれば、突然変異を抑えるiPS細胞樹立法の確立に大きく近づくことができ、より安全な再生医療の実現が可能となります。
なお、本研究の一部はJST戦略的創造研究推進事業個人型研究「さきがけ」、及び科学研究費助成事業の基盤研究Bの支援を受けました。
用語解説
※1 iPS細胞(人工多能性幹細胞)
皮膚等の既に分化した細胞に数種類の遺伝子を導入することなどによって分化多能性(様々な細胞に分化する能力)を誘導した細胞のこと。なお、幹細胞とは、自分自身を増やす自己複製能力と、ほかの細胞に分化(成長)する能力を持つ、ほかの細胞の元となる特別な細胞。iPS細胞は、再生医療への応用や薬剤開発等への利用が期待されています。
※2 点突然変異
ゲノムDNAの構成因子である塩基が、なんらかの理由で他の塩基に置き換わってしまう現象。
変異がたんぱく質を生むゲノム部位に生じると、そのたんぱく質の機能が損なわれたり、逆に、機能が異常に促進されたりすることがあり、それが原因で細胞が正常の状態から逸脱して増殖する、つまり、がん化を起こす場合があることが知られています。例えば、有名ながん遺伝子のひとつRASは、細胞増殖に必要なたんぱく質ですが、通常生体内では、状況により活性型と不活性型に使い分けられています。しかし、多くのがんの解析から、ある部位のゲノムの点突然変異により、グリシンがバリンなどの他のアミノ酸に置換した場合、常時活性型となり、細胞が異常増殖するようになることが知られています。
※3 ES細胞
ES(Embryonic Stem:胚性幹)細胞は、初期胚(受精してから数日間の受精卵)から樹立され、分化多能性を維持したまま半永久的に増殖させることができると言われている細胞です。これまで多くの再生医療関連の基礎研究がこの細胞を用いて行われていますが、免疫拒絶の問題やヒトの初期胚を用いた場合の倫理的問題があります。
※4 塩基置換のパターン
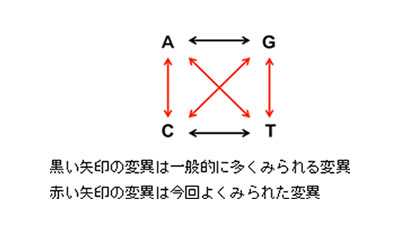 ゲノムDNAを構成するA,C,G,Tと表記される塩基は、その構造から、大きくプリン塩基(A,G)とピリミジン塩基(C,T)の2つに分類されています。一般的な突然変異は、プリン同士、ピリミジン同士の置換の方が、プリンがピリミジン、ピリミジンがプリン、に置換するより多いといわれています。今回、iPS細胞に見られた変異は、プリンがピリミジン、ピリミジンがプリンに変わるような変異が多く、一方で、ES細胞では、一般的に見られる変異パターンが多い、という結果になりました。
ゲノムDNAを構成するA,C,G,Tと表記される塩基は、その構造から、大きくプリン塩基(A,G)とピリミジン塩基(C,T)の2つに分類されています。一般的な突然変異は、プリン同士、ピリミジン同士の置換の方が、プリンがピリミジン、ピリミジンがプリン、に置換するより多いといわれています。今回、iPS細胞に見られた変異は、プリンがピリミジン、ピリミジンがプリンに変わるような変異が多く、一方で、ES細胞では、一般的に見られる変異パターンが多い、という結果になりました。
プレスリリースのお問い合わせ
ご意見やご質問は下記の連絡先までお問い合わせください。
独立行政法人 放射線医学総合研究所 企画部 広報課
Tel:043-206-3026
Fax:043-206-4062
E-mail:info@nirs.go.jp
