2013年5月24日10時
独立行政法人 放射線医学総合研究所(理事長:米倉 義晴)
分子イメージング研究センター分子病態イメージング研究プログラム
青木伊知男チームリーダー・齋藤茂芳客員協力研究員
本研究成果のポイント
- 細胞や組織の機能を可視化する機能性造影剤※1と高磁場MRI※2を使った分子イメージング※3により、放射線をがん細胞に照射してから24時間後には照射の効果を確認することに成功した。
- 本技術は「細胞周期の停止」を可視化する手法である。
- 放射線がん治療では、治療効果の確認に数週間以上を要するが、本手法は、超早期に効果を確認するための要素技術となりうる。
独立行政法人放射線医学総合研究所(理事長:米倉義晴、以下、放医研)分子イメージング研究センター分子病態イメージング研究プログラムの青木伊知男チームリーダー、齋藤茂芳博士研究員(客員協力研究員、現・大阪大学)らは、がん細胞に放射線を照射してから24時間後に、その効果の有無が画像として確認できる手法を世界で初めて開発し、マウスの大腸がんモデルを用いて証明しました。
放射線がん治療は拡大しつつありますが、その効果の確認には、数週間以上に及ぶ腫瘍体積の変化の観察が必要です。放射線治療の効果がないとわかった時には、いわゆる「手遅れ」になりかねないため、早急な効果の確認が望まれていますが、これまで、放射線によるがん細胞照射から24時間後の腫瘍では、体内で細胞・分子レベルの変化を画像化することが不可能とされてきました。しかし、本研究では、高い解像度を持つ高磁場MRIと特殊な機能性造影剤を用いて、マウスの大腸がんモデルの腫瘍による造影剤の取り込み量の変化を、照射後24時間後に画像化することに成功しました。また細胞内への造影剤の取り込み量の低下が、細胞周期の停止※4を反映することも発見し、この原理により、放射線がん治療後の超早期に、治療効果の有無や治療効果範囲の確認が可能になります。万が一、治療効果が無かった場合でも迅速に他の治療手段にバトンタッチすることにより「手遅れを無くす」ことが期待できます。現時点での成果は前臨床研究レベルですが、今後、より効率的な送達法や安全性の検証により、臨床への応用も期待されます。本研究は、2013年5月21日、主要な国際的学術誌の一つ、米国のCancer Research誌のオンライン版に掲載されました。
研究の背景と目的
放射線によるがん治療は他の治療法と比較して苦痛が少ないという特徴があることから、2009年の時点で約22万人(JASTRO2009年構造調査結果、継続を含む)と幅広く利用され、増加の傾向にあります。その一方で放射線がん治療は、がんの種類やがん内部の状況、がんの周辺の環境が多様であるため、同じ条件で照射しても、同じ効果が得られるとは限らないという難点があります。そのため、治療にあたり、効果をMRIやCTなどで確認する必要があります。現在、その治療効果の確認は、腫瘍の体積の変化を照射後から数週間~数か月かけて経過観察する方法が主流ですが、治療効果がないと分かった時には長期の観察期間中に、転移など、病状が悪化することで、代替手段が失われる状態、いわゆる「手遅れ」の状態に直結することがあります。
そこで、次世代の分子イメージング手法の開発とその応用研究に取り組んでいる放医研分子イメージング研究センターでは、放射線がん治療の効果を迅速に画像として確認する方法を開発することを目的として、顕微鏡に近い100μm以下も検出可能な優れた解像度を持つ7テスラの高磁場MRIと機能性造影剤の一つであるマンガン造影剤※5を組み合わせた研究を行いました。その結果、がん治療の翌日に効果の有無が確認できる方法を発見しました。
本研究は、放医研の青木伊知男チームリーダー、齋藤茂芳博士研究員(現:大阪大学)、長谷川純崇主任研究員、関田愛子、バカロバ・ルミアナ主任研究員、古川高子チームリーダー、佐賀恒夫プログラムリーダーおよび大阪大学大学院医学系研究科・放射線技術科学専攻の村瀬研也教授らとの共同研究の成果です。
なお本研究は、高磁場MRIの定量的撮像に関して、内閣府が主導する最先端研究開発支援プログラム(代表・片岡一則・東京大学大学院工学研究科・医学研究科)の支援を受けました。また、マンガン造影剤の開発と応用に関して、独立行政法人日本学術振興会の科学研究費補助金(基盤研究(B):24300167)によって支援を受けました。
研究手法と結果
(1)試験管内での細胞実験
まず、試験管内での実験として、放射線照射を行った細胞の変化を調べました。
大腸がんの細胞の塊を2つに分け、片方には20GyのX線を1回照射し、もう一方には照射しません(非照射)でした(通常、固形がんの放射線治療では合計50Gy程度が分割して照射されます)。照射24時間後に、マンガン造影剤を両方の細胞に混ぜ、30分間培養した後に、造影剤を洗い流しました。その結果、放射線を照射した細胞では、非照射と比べて造影剤の取り込み量が低下し、MRIの信号が低下することが判明しました(図1)。この照射24時間後の細胞を詳しく調べると、この時点で細胞は死んでいませんでした。しかも、細胞死へとつながるアポトーシス※6という変化すら、この段階ではわずかしか起きておらず、アポトーシスが本格的に起こる前の状態であることがわかりました。一方、細胞分裂の過程を示す「細胞周期」を調べると、大半の細胞が、放射線によるDNAの損傷で、細胞分裂が生じる前後のG2/M期と呼ばれる段階にとどまっていることが分かりました。この現象は細胞レベルでは、既に知られていますが、この変化を生体のままでMRIにより観測できれば、放射線照射の翌日の細胞の活動や細胞周期を利用した診断技術につながる可能性があります。
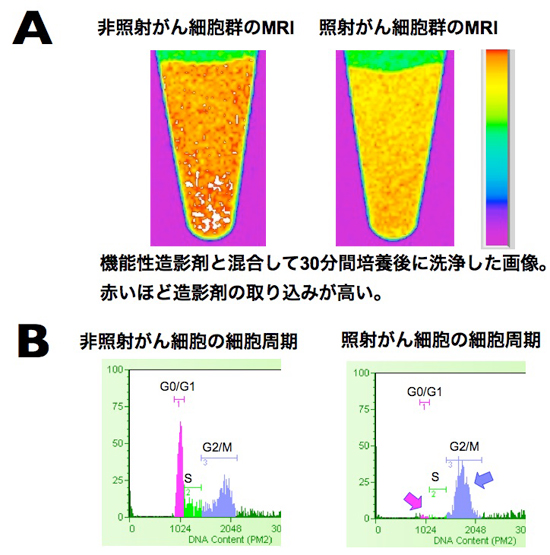
図1 A:がん細胞の塊のMRI。左が放射線照射を行わない細胞、右が放射線照射を行った細胞。放射線照射の24時間後に、機能性造影剤であるマンガン造影剤と一緒に30分間培養し、その後、細胞外の造影剤を取り除くために洗浄した。信号の強度を色で示しているが、活動しているがん細胞の数に比例して造影剤が取り込まれる量も増える。造影剤が多くなれば、紫⇒青⇒緑⇒黄⇒赤と変化していく。放射線がん治療を想定した照射を行った細胞群では、照射を行わない細胞に比べて、がん細胞の活動が停止しているため、黄色い部分が多く造影剤の取り込みが低下していることが画像として捉えられた。
B:上記と同様の方法で放射線を照射したがん細胞について、細胞周期を解析した結果。左が放射線照射を行わない細胞、右が放射線照射を行った細胞。放射線照射を行った細胞では、G0/G1期にある細胞が大きく減少し(紫の矢印)、G2/M期で細胞活動が停止した細胞が増加しており(青の矢印)、細胞周期が著しく変化したことを示す。
(2)個体レベルでの動物実験
動物実験委員会の承認後、マウスの体の中でも同じ現象が検出できるかを調べました。同一個体のマウスの臀部皮下の2か所に、大腸がんの細胞を移植した腫瘍モデルを作製し、片方の腫瘍に対して20GyのX線を1回照射し、もう一方には照射しません(非照射)でした。照射24時間後に、マンガン造影剤をマウスの尾静脈から投与し、照射および非照射の2か所のがん組織を同時にMRIで撮影しました。その結果、放射線照射を行ったがん組織では、非照射と比べて造影剤の取り込みが低下した様子を、マウスを全く傷つけず、生きたままの状態で画像化できました(図2)。
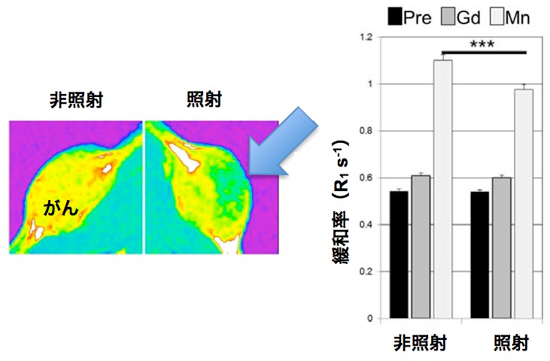
図2 左図:マウスに皮下移植した大腸がんを拡大したMRI画像を示す。左が放射線照射を行わないがん組織、右が放射線照射を行ったがん組織。照射の24時間後に、マンガン造影剤を投与して撮影した。照射を行った組織では、非照射に比べて信号の強度が黄色⇒緑色へと低下し(矢印)、腫瘍への造影剤の取り込みが低下している様子が、画像化された。
右図:MRIによって、造影剤の取り込みを示す「緩和率」という数値で比較したもの。造影剤の投与前(Pre):(黒棒線)や機能性を持たない従来型の造影剤(Gd:Gd-DTPA):(灰色棒線)では、照射の有無による取り込みの差は見られないが、機能性マンガン造影剤(Mn):(白棒線)では、照射の有無により、取り込みの低下が、統計学的に有意な差(p<0.001)として示された。
このMRI信号の変化が、細胞周期の停止を反映していることを確認するために、撮影後にがん組織を、細胞増殖を示す染色法(免疫組織化学的染色法※7)を用いて顕微鏡で調べたところ、放射線照射を行ったがんでは、活発に細胞分裂をしている細胞が減少していることが示されました。一方、細胞死の過程であるアポトーシスはほとんど観察されず、また血管の破綻や出血も生じていないことも示されたことから、MRI信号の変化は、放射線照射による細胞周期の停止を反映したものであることが示唆されました。
本研究成果と今後の展望
本研究により、放射線がん治療の照射24時間後に照射の効果が確認できる基盤技術が構築されました。また、照射による細胞死やその過程となるアポトーシスも生じていない超早期の段階において、細胞周期の停止(細胞活動性)を反映する生体の画像の取得に成功した世界で初めての成果でもあります。
また、機能性造影剤の細胞への取り込みは、画像を作成する段階で数値化できるので、細胞が取り込んだ量がどのくらい変化したかを、生体を傷つけずに評価・比較することが可能となりました。この造影剤の定量化技術は、現在、数週間以上もかかる放射線がん治療の効果の有無を超早期に判断する際の指標になると考えられます。将来、さらに高い解像度での計測が可能になれば、腫瘍内部での治療効果の有無を詳細に分析することも可能になると思われます。
本技術における画像化は、全国で六千台以上普及した臨床用MRIを使用しても実施できるため、将来的にはヒトを対象に計測することも可能と思われます。しかし機能性造影剤を臨床に応用するには、いくつかの開発と検証が必要になります。一つは、マンガン造影剤を腫瘍部位にのみ、送り届ける技術の開発です。本研究で使用した機能性造影剤と同じ成分の薬剤は、国内で経口用MRI造影剤として認可されており(ボースデルTM)、また海外でも、マンガン錯体を用いたMRI造影剤(Mn-DPDP、テスラスキャンTM)として承認されています。しかし、本研究では、コントラストを高めるために通常より高い濃度の造影剤を使用しました。体に全く害を与えず今回と同じような画像を得るためには、高濃度の造影剤を投与するのではなく、効率よく造影剤の成分を腫瘍患部に送り届ける方法を開発する必要があります。そのため、今後、造影剤の濃度を、より正確かつ高感度に計測する画像化技術や多様な種類や条件におけるがんでの検証が必要になると考えられます。
本研究成果は、今後、X線、ガンマ線、重粒子線を体外から照射する治療法や、小線源を用いて体内から照射する治療(内照射療法)など多様な放射線がん治療のみならず、がんの化学治療や物理的治療法の早期の治療評価へも幅広く、応用が期待できます。とりわけ、最近、ナノ粒子を活用した薬剤送達技術※8による体に優しいがん治療を、生体イメージングと融合させる「セラノスティクス※9」と呼ばれる新しい手法が注目されており、本成果は診断と治療を融合させた、新しい医療分野の重要な基盤技術になることが期待できます。
用語説明
※1 機能性造影剤
造影剤は、診断用の画像を撮影する際に画像のコントラスト(白黒)を強調させるための薬剤である。機能性造影剤とは特定分子の分布等を反映させることにより、特定の生体組織や細胞の機能に応じて、MRIの信号に変化をつける特殊な造影剤。多くが臨床応用されていない研究中のものであるが、MRIを使用した分子イメージングを実現する手法として注目されている。
※2 高磁場MRI
MRIはMagnetic Resonance Imagingの略で、磁気共鳴画像法と訳される。高い磁場の中で体内の水に特定の周波数の電磁波(FM電波)を与えて、共鳴により得られた信号をコンピュータにより画像化する手法を呼ぶ。国内では5千台以上が稼働するなど、非侵襲的に生体の断層画像を取得する方法として、診断を中心に広く臨床現場で使用されている。
通常の医療では磁場の強さが3テスラ以下のMRIが使用される。MRIは、高い磁場ほど強い信号を発生できるので、小さな個体を対象とする本研究では、7テスラMRIが使用された。このMRIでは100μm程度の解像度で生体の断層画像を得ることができる。ヒトはマウスよりも体積が大きく、強い信号が得られるので、7テスラMRIで得られた研究成果は、3テスラ以下の臨床装置でも再現が可能である。なお、世界的には100台程度、国内でも数台の「ヒト用の7テスラMRI」も稼働が開始し、より高い解像度を生かした研究が進められている。
※3 分子イメージング
個体の生体内で起こるさまざまな生命現象を外部から分子レベルで捉えて画像化する技術及びそれを開発する研究分野であり、生命の統合的理解を深める新しいライフサイエンス研究分野。生体内のがん細胞の状態や特徴を調べることができるため、がんの早期発見の診断法やがんの治療法を確立したり、がんができる仕組みを解明したりするための手段として実用化されつつある。放医研では、2005年より分子イメージング研究センターを開設し、分子イメージング技術の開発と病気への応用を進めている。
http://www.nirs.go.jp/research/division/mic/
※4 細胞周期の停止
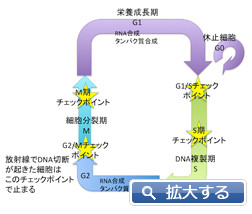 生きている細胞は細胞分裂とDNA複製を繰り返すが、細胞内に、異常や不具合がある場合にはその進行を停止させることがある。
生きている細胞は細胞分裂とDNA複製を繰り返すが、細胞内に、異常や不具合がある場合にはその進行を停止させることがある。
その場合、1回の細胞分裂から次の細胞分裂までの周期が停止している状態として観測される。細胞周期は、分裂が止まった状態G0(静止期)、DNA合成が行われるS期、それを挟むG1、G2を間期、細胞が分裂するM期に分類される。細胞は、いくつかのチェックポイントで正しく細胞周期を進行させているかどうかをチェックし、異常や不具合がある場合には細胞周期進行を停止させる。これを細胞周期チェックポイントと呼び、放射線照射などでDNAに損傷を起こし、細胞に障害が生じた場合、これらのチェックポイントで細胞周期を停止することが知られている(G1/Sチェックポイント、S期チェックポイント、G2/Mチェックポイント、M期チェックポイントなど)。
※5 マンガン造影剤
マンガンが常磁性を持つことから、その分布を直接MRIで画像化できるという特徴を活かした造影剤。基礎医学を中心に使用されている。マンガンイオンは、一定の条件下で、生体のカルシウムイオンの動きに似た挙動をすることから、投与後には、細胞のカルシウムイオン・チャネルなどの活動性に応じて取り込まれ、その信号は、細胞の生存性、膜電位の変動などの活動性、細胞密度などを反映する。そのため、従来の血流に基づくMRI画像ではなく、脳・神経活動に直接基づく画像を得ることができる。生物への応用は、米国国立衛生研究所(NIH)のAlan P Koretskyディレクターらによって提唱され、マンガン造影MRI(MEMRI)とも言われる。
※6 アポトーシス
細胞の死に方の一つで、制御されたまま自ら死ぬこと、プログラムされた細胞死ともいう。細胞膜や細胞小器官などが正常な形態を保ちながら、まず核内のクロマチン(DNAとタンパク質の複合した構造)が凝集し、細胞全体が萎縮しつつ断片化してアポトーシス小体を形成し細胞死に至る場合をいう。アポトーシスで死につつある細胞内では、DNAの断片化が起き、そのDNAを抽出して分離すると約200塩基対ごとの‘はしご状’のパターンが認められるのが特徴。本研究では、試験管内の実験では、Ca2+依存性のリン脂質結合タンパクであるアネキシンVと7-アミノアクチノマイシンD(7-AAD)との組み合せを指標に、動物実験では、細胞にアポトーシスを起こさせるカスパーゼカスケードと呼ばれる一連のシグナル伝達経路の中で「カスパーゼ-3」が活性化された細胞をアポトーシス陽性として評価している。
※7 免疫組織化学的染色法
抗体(抗原が体内に侵入したときに防衛機能として作られる物質)を用いて、組織標本中の抗原の存在場所を検出する組織化学的手法で、抗原と抗体が結合したときに染め出すことができる色素を利用し、抗原と抗体が結合する反応を可視化させて光学顕微鏡(酵素抗体法)や蛍光顕微鏡(蛍光抗体法)等で観察する。本研究では、組織から切片を作製して、アポトーシスが生じた組織の観察、血管内皮細胞の観察、増殖細胞の観察に利用している。
※8 ナノ粒子を活用した薬剤送達技術
薬剤送達技術(DDS)とは、必要な薬物を、必要な時間に、必要な部位で作用させるためのシステムである。その中でも、10~100nm(ナノメートル。1nmは0.001ミクロン)程度の微粒子に治療薬や診断薬を搭載して、治療や診断、あるいはその両方に活用する技術が急速に進んでおり、受動的あるいは能動的に、がんなどの患部に薬剤を送達することを目的としている。内閣府が主導する最先端研究開発支援プログラムでは、東京大学・片岡教授らが、抗がん剤を中心核に持つナノミセルを開発し、効果的ながん治療薬として臨床研究中である。
※9 セラノスティクス
診断技術(diagnostics)と治療技術(therapeutics)の造語で、個々の患者に対して、診断情報を治療に直結させようとする試みで、診断と治療の融合的な概念である。例えば、ある患者に対して、治療を行った結果が迅速に診断(観察)できれば、その結果を元に、すぐさま次の治療を選択できる。我々は、前述の最先端研究開発支援プログラムにおいて、抗がん剤ナノミセルとMRI造影剤を組み合わせて、抗がん剤の分布をイメージングで追跡しながら治療を行うセラノスティクスの応用を提案した(Cancer Res. 2010 Sep 15;70(18):7031-41.)。セラノスティクスの開発において、治療効果を迅速に確認するイメージングの要素技術が重要であり、本研究は、放射線治療に対する、その一例となる。
参照URL
- 独立行政法人放射線医学総合研究所
http://www.nirs.qst.go.jp/index.shtml - 複合分子イメージング研究チーム(本研究の担当チーム)
http://www.nirs.go.jp/research/division/mic/group/t_kinou-bunshi.html - 最先端研究開発支援プログラム「ナノバイオテクノロジーが先導する診断・治療イノベーション」
NanoBio First 最先端研究開発支援(FIRST)プログラム「ナノバイオテクノロジーが先導する診断・治療イノベーション」 - Cancer Research誌
Home|Cancer Research
プレスリリースのお問い合わせ
ご意見やご質問は下記の連絡先までお問い合わせください。
独立行政法人 放射線医学総合研究所 企画部 広報課
Tel:043-206-3026
Fax:043-206-4062
E-mail:info@nirs.go.jp
