脂肪酸合成を標的としたがん治療における新戦略
-PETを用い個別のがん治療効果を予測する方法を開発-
脂肪酸合成を妨げることががんの増殖・転移を抑える鍵となることも発見
2013年6月1日
独立行政法人放射線医学総合研究所(理事長:米倉義晴)
分子イメージング研究センター分子病態イメージング研究プログラム
吉井幸恵 研究員
本研究成果のポイント
- がんの成長に重要な脂肪酸を合成する「脂肪酸合成酵素※1」は、悪性度の高いがんで多量に産生されることが知られているが、本研究では、脂肪酸合成酵素標的治療※2における新戦略として、PET※3により個々のがんにおける脂肪酸合成酵素の働きを把握することにより、治療開始前に効果を予測する方法を開発。
- 脂肪酸合成を妨げることで、脂肪酸合成酵素を多量に産生するタイプのがんの増殖・転移に関わる様々な重要な機能を低下させうることも発見。
がんにおいては、脂肪酸合成が活発化しており、脂肪酸合成酵素(Fatty acid synthase,以下FASN)の産生量が多いがんにおいて、悪性度が高いことが知られています。また、FASNの働きを抑えることでがんの増殖を抑制できる※4ことが報告されています。そのため、FASNの働きを抑える治療(FASN標的治療)は、まだ前臨床段階ですが、これまで根治の難しかったFASNを多量に産生する悪性度が高いがんに対する追加的な治療法として期待されます。しかし、個々のがんにおいては、FASNの産生量が大きく異なる※5ことが知られており、FASN産生量の低いがんに本治療を施すと、効果が低くなってしまうだけでなく、患者に不必要な身体的・経済的負担※6を強いることになってしまいます。そこで、無駄な患者負担を無くし、個々の患者に最適な治療法を提供するためにも、FASN標的治療に対する事前治療効果予測法※7の開発が望まれます。独立行政法人放射線医学総合研究所分子イメージング研究センター※8分子病態イメージング研究プログラム(佐賀恒夫プログラムリーダー)の吉井幸恵研究員は、酢酸PET※9を用いて個々のがんのFASNの働きを把握することで、FASN標的治療の開始前に効果を予測する方法を開発しました。加えて、FASN標的治療の細胞影響については、これまであまり分かっていませんでしたが、本研究では、FASNを多量に産生するがんにおいて、FASNの機能を低下させると、増殖や転移に関わる様々な重要な機能※10を低下を低下させうることを発見しました。本成果から、PET画像診断により、がんに対するFASN標的治療の効果を予測することで、より効果的な治療戦略が提案できる※11と期待されます。本研究は、福井大、宮崎大、米国スローンケタリング記念がんセンター※12との共同研究であり、日本学術振興会「科研費若手研究(B)(課題番号23791403)」の一環として行われました。また、学術誌PLOS ONE電子版に2013年6月1日午前6時(日本時間)に掲載予定です。
Fatty Acid Synthase Is a Key Target in Multiple Essential Tumor Functions of Prostate Cancer: Uptake of Radiolabeled Acetate as a Predictor of the Targeted Therapy Outcome
研究の背景と目的
がんは、日本人の死亡原因の第1位を占める疾患で、その病態解明や、より効果的な治療法の開発が求められています。がんは脂肪酸合成酵素(以下FASN)の働きにより、自身の成長に必要な脂肪酸合成を活発化させていることが知られておりますが、逆に活発化を抑えることにより、がんの成長を抑制できることも報告されています。また、病理学的研究によれば、FASNの産生量が多いがんほど、その悪性度が高いことも知られています。こうしたことから、FASNの働きを抑える治療(FASN標的治療)は、まだ前臨床段階ではありますが、従来治療法では根治が難しかったFASNを多量に産生する悪性度が高いがんに対する追加的な治療法として期待されます。しかしながら、個々の患者のがん毎にFASNの産生量が大きく異なることも知られており、FASNの産生量が少ないがんに対し、本治療を施しても、治療効果が低くなってしまうばかりか、逆に患者に不必要な身体的・経済的負担を強いることになってしまいます。そのため、本治療の効果が芳しくない事象を回避し、患者の無駄な負担を無くすためには、個々のがんにおけるFASNの生産量を治療開始前に把握し、治療効果を予測することが必要であり、その方法の開発が望まれています。
今回、我々は、がんにおいて脂肪酸合成の材料として使われることが知られる酢酸に注目し、細胞への酢酸の取り込み量が分かるように、酢酸と同機能ながらも酢酸分子に炭素の放射性同位体である11Cを付加した酢酸(11C酢酸)を利用するPET(酢酸PET)を用いた画像診断を行うことで、がんのFASNの生産量を把握し、FASN標的治療の効果を治療開始前に予測できる新しい方法を開発しました。この方法を用いることで、患者さんにより有効的な治療を提供することが可能となります。
一方で、前述のとおり、がんのFASNの働きを抑制することにより成長を阻害することは分かっていましたが、抑制によるがん細胞への影響は、よく分かっていませんでした。これに対し、本研究ではその細胞影響について検討し、がんのFASNの働きを低下させることで細胞増殖・仮足形成・遊走・浸潤といったがんの病状の悪化につながる増殖・転移に関係する様々な機能を複合的に抑制できること、すなわちFASNはがん治療の鍵となる治療標的※13であることを初めて明らかにしました。
このように、本研究では、11C酢酸を用いたPET画像診断によりFASN標的治療に対し効果の高いがんを予測し、この治療方法を選択することが適切かどうかを判断することができる新しい診断手法を開発しました。また、PETによる事前治療効果予測により本治療が効果的と選択されたがんに対し、がんの増殖・転移に関わる重要な機能を同時に抑制できる新しい治療方法を提供できると考えられます。以下に、その研究手法と結果の詳細をお示しいたします。
研究手法と結果
FASN標的治療の治療効果予測法の開発
4種類のヒト前立腺がん細胞を用い、各細胞における14C酢酸(酢酸と同機能ながら放射性物質14Cを付加している酢酸)の取り込みとFASNの働きを妨げる薬(FASN阻害薬)に対する感受性との関係を調査しました。その結果、がん細胞における14C酢酸の取り込みが多いものほど、FASN産生量も多くなる傾向を明らかにしました。また、酢酸の取り込み量が多い細胞ほどFASN阻害薬に対する効果が高くなることも判明しました(図1)。
また、ヒト前立腺がん細胞をマウスに移植したがん移植モデルを用いた検討からも細胞実験と同様に、14C酢酸の取り込み量は、FASN産生量並びに治療効果をよく反映していることが示されました(図2)。
さらに、11C酢酸PETを用いることで、同じ前立腺がんでも治療効果の高いがん(LNCaP細胞)と治療効果の低いがん(DU145細胞)を見分けることができることも明らかにしました(図2-1B)。このことから、11C酢酸PETを用いることで、治療効果を治療開始前に予測できることを明らかにしました。
FASN標的治療における細胞影響
今回の研究では、ヒト前立腺がん細胞を用い、FASNを産生する遺伝子の働きを抑制することによる細胞への影響を検討しました。本検討では、元々FASNを多量に産生するがん細胞から遺伝子組み換えによりFASN遺伝子を特異的に抑制したFASN遺伝子抑制細胞※14を構築し(図3A)、その生物学的特性を詳細に調査しました(図3B)。その結果、FASNの働きを妨げることで、細胞増殖が抑制されること、細胞の仮足形成が抑制され、遊走能・浸潤能が低下することが明らかとなりました。さらに、遺伝子発現解析の結果から、FASNを阻害することにより、これらの機能に関わる遺伝子発現が抑制されることが示されました。
本研究成果と今後の展望
本研究では、酢酸PETを用いてがんの酢酸取り込み量を評価することで、FASN標的治療の効果を治療開始前に予測できる手法を開発しました。また、FASNは、がんの増殖・転移に関与する細胞増殖・仮足形成・遊走・浸潤といった多様な機能を抑制できる鍵となる治療標的であることを初めて明らかにしました。これらの成果から、PET画像診断により、がんに対するFASN標的治療の効果を予測することで、より効果的ながん治療を提供する適切な治療方針決定法が提案できると期待されます。また、これまで治療が難しかったFASNを多量に産生する悪性度が高いがんに対し、従来治療法(手術・放射線療法・化学療法・ホルモン療法等)とFASN標的治療を併せて行うことで、がんの悪化を防ぎ、再発・転移を予防すること出来ると期待されます。
図1 ヒト前立腺がん細胞における放射性酢酸の取り込みとFASN阻害に対する感受性
A:4種類のヒト前立腺がん細胞(LNCaP細胞,PC3細胞,22Rv1細胞,DU145細胞)における放射性酢酸取り込み量(左)とFASN産生量(右)。左図は14Cで標識した酢酸を添加した培地で各ヒト前立腺がん細胞を1時間培養した後、細胞の中にどれくらい14Cが取り込まれているか計測した。図中の*で示された各群間で有意差がある(P<0.05)。
Aから、取り込み量が多いほど、FASN産生量も多くなることがわかり、LNCaP細胞が取り込み量、産生量共に高く、DU145細胞は、どちらも低いことが見られる。
B:FASNの働きを抑える薬(Orlistat)の濃度を変えて加えた培地で48時間培養した後、細胞活性を調べた。0µM(阻害薬無添加)の時を100%となるように計算している。Aより、放射性酢酸の取り込みの多いLNCaP細胞はFASN阻害薬の濃度が高くなるに従い細胞活性は減っており、阻害薬への感受性が高いといえる。逆に取り込み量の少ないDU145細胞は、阻害薬への感受性は低いとわかる。*は0µMと比べて有意差がある(P<0.05)。
放射性酢酸の取り込み量が多いものほど、FASN産生量並びにFASN阻害薬に対する感受性は高かった。
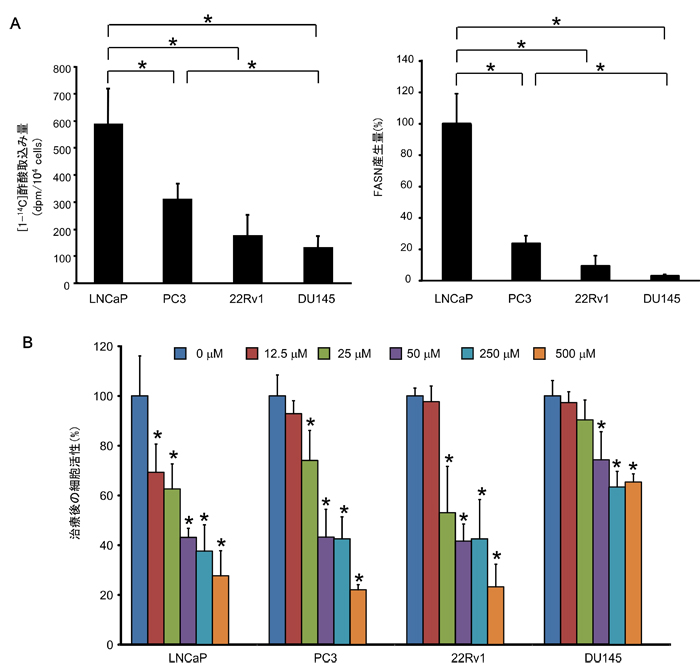
図2-1 腫瘍移植モデルマウスを用いた検討-放射性酢酸の集積性とFASN標的治療に対する感受性
A:3種類のヒト前立腺がん細胞(LNCaP腫瘍,PC3腫瘍,DU145腫瘍)をマウスに移植した腫瘍移植モデルマウスに放射性酢酸(14C酢酸)を尾静脈の注射により投与し、30分後における放射性酢酸の腫瘍における取り込み量を測定した。図中の*で示された各群間で有意差がある(P<0.05)。
B:腫瘍移植モデルマウスの11C酢酸PETイメージング。濃度が高くなるにつれて、青⇒緑⇒黄⇒赤となる。黄矢印が腫瘍を示す。LNCaP=FASN高産生腫瘍,PC3=FASN中産生腫瘍,DU145=FASN低産生腫瘍。酢酸PETにおいては、腫瘍への集積の他に、肝臓と脂肪組織への生理的集積が観察されるので、前もってCTやMRI等を用いてがんの位置・形状を把握しておく必要がある。
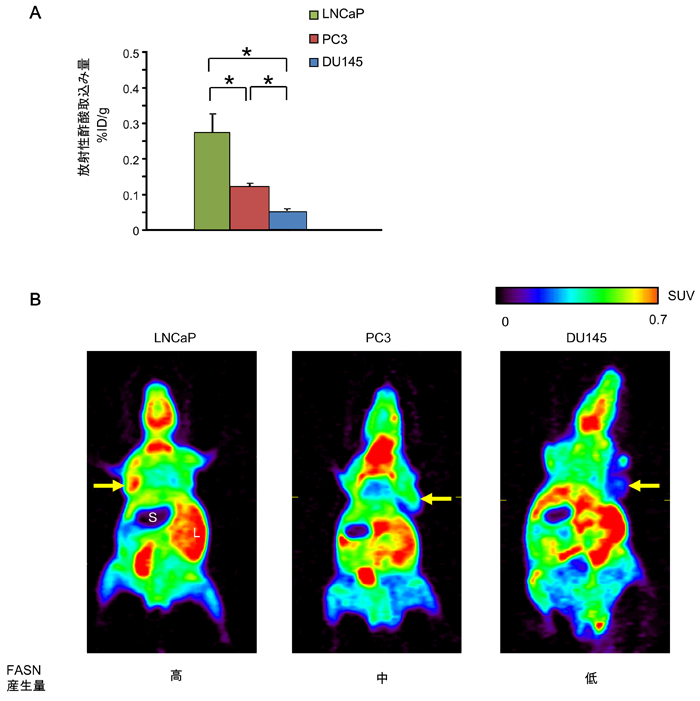
図2-2
C:腫瘍移植モデルマウス(LNCaP腫瘍,PC3腫瘍,DU145腫瘍)をFASNの働きを抑える薬(Orlistat、(240mg/kg/日))で治療した際の各腫瘍における腫瘍体積変化の比較。図は、各腫瘍における(FASN標的治療群の腫瘍体積/未治療群の腫瘍体積)を求め、治療前との比で示している。これにより、各腫瘍における腫瘍体積変化を比較することができる。図中の*で示された各群間で有意差がある(P<0.05)。
図2-1 Aの放射性酢酸の取込み量の傾向と同じく、LNCaP腫瘍では、FASN標的治療の効果が高く、PC3腫瘍、DU145腫瘍の順でその効果が低くなる。
このように、腫瘍移植モデルマウスを用いた検討から、放射性酢酸の取り込み量は、FASN標的治療に対する効果の高さを反映していることが示された。
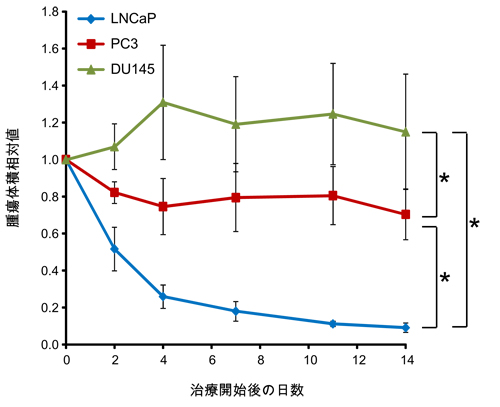
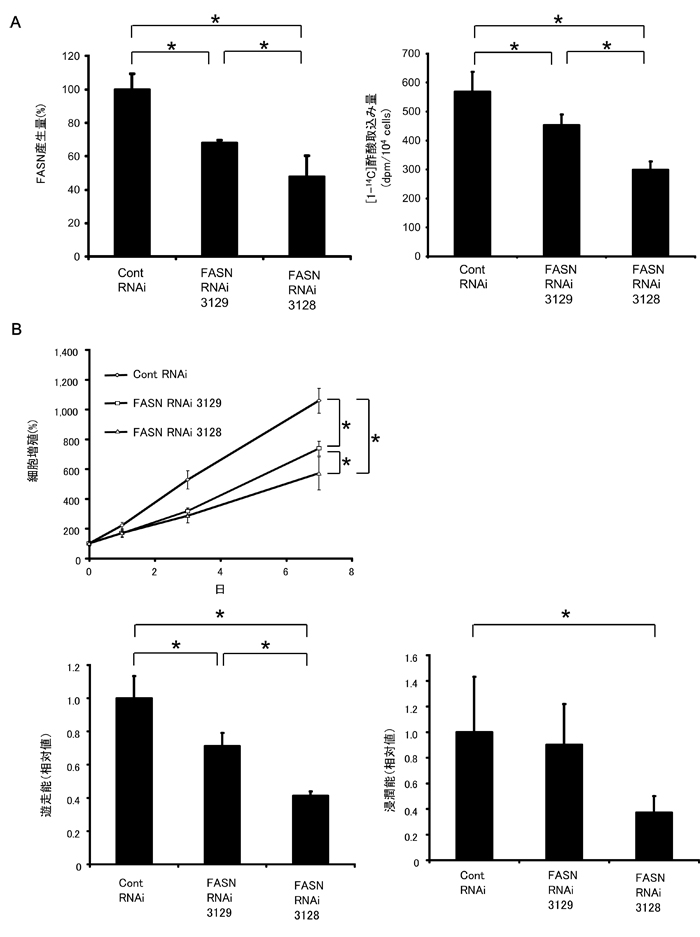
図3 ヒト前立腺がん細胞(LNCaP細胞)を用いたFASN遺伝子の働きを抑えることによる細胞影響
A:FASN遺伝子抑制LNCaP細胞(FASN RNAi 3129, FASN RNAi 3128)におけるFASN産生量(左)と放射性酢酸(14C酢酸)取り込み量(右)。Control RNAi=遺伝子抑制を起こさない配列に遺伝子組換えしたコントロール群。FASN RNAi 3129とFASN RNAi 3128では、FASN遺伝子の抑制の程度(FASN産生量:FASN RNAi 3129>FASN RNAi 3128)が異なる(左)。図中の*で示された各群間で有意差がある(P<0.05)。
B:FASN遺伝子抑制LNCaP細胞における細胞増殖(上段)、遊走能(下段左)、浸潤能(下段右)。図中の*で示された各群間で有意差がある(P<0.05)。
FASN遺伝子の働きを抑えることにより、細胞増殖・仮足形成・遊走能・浸潤能が抑制されることが明らかになった
用語説明
※1 脂肪酸合成酵素(Fatty acid synthase, FASN)
アセチルCoAを出発物質として脂肪酸を合成する酵素複合体。がんにおいては、多くのがん種において、FASNの高産生が認められ、予後不良と関係しているとされている。がんにおいては、取り込まれた放射性酢酸はアセチルCoAに変換されその大部分が脂肪酸合成に使われるため(Yoshimoto et al. Nucl Med Biol 2001, Yoshii et al. Nucl Med Biol 2009)、放射性酢酸の取り込みによりがんの脂肪酸合成活性を評価できるものと考えられる。なお、正常臓器においては、脂肪酸合成に関わる肝臓や脂肪組織で産生されていることが知られるが、その他の臓器では産生量は低いことが知られている。
※2 脂肪酸合成酵素標的治療
がん細胞で過剰に産生されている脂肪酸合成酵素(FASN)分子を狙い撃ちにして、その機能を抑えることによりがんを治療する方法で、新たながん治療法として期待されている。OrlistatなどのFASN阻害薬を用いた治療や遺伝子発現抑制治療法などがある。なお、Orlistatは、欧米で、抗肥満薬としてすでに薬局医薬品として販売されている薬で、前臨床試験からがんに対しての有効性も報告されており、がん治療薬として臨床応用が期待されている(Kridel et al. Cancer Res 2004)。また、Orlistatについては下痢やビタミン不足といった副作用が多少あることが知られており、こうした副作用を回避するためにも事前治療効果予測が必要となる。
※3 PET
Positron emission tomographyの略称で、陽電子断層撮像法のこと。PET検査では、ポジトロン(陽電子)を放出する放射性薬剤を用い、薬剤から放出された陽電子が消えたときに出る1対のガンマ線を検出し解析することで、薬剤が生体内を移動し、がんなどに集積する様子を画像化することができる。
※4 がんにおいては脂肪酸合成が活発化しており、脂肪酸合成酵素(FASN)の働きを抑えることでがんの成長を抑制できる
がん細胞では、他の正常臓器の細胞と比較して、脂肪酸合成が盛んであることが知られている。また、がん細胞において合成された脂肪酸は、主にがん細胞自身の構成要素となっており、その成長に重要であると考えられる。また、前臨床試験から、FASNの働きを抑えることで、がんの成長を抑制することができることが報告されている(Kridel et al. Cancer Res 2004)。その際、他の正常臓器には目立った影響を与えないことも明らかにされている。
※5 がんによっては脂肪酸合成酵素(FASN)の産生量が大きく異なる
Rossiらは、前立腺がんにおける病理学的診断から、調査した前立腺がんのうち、約40%が強~中程度の産生量を示す一方、残りの約60%は産生量が弱いかほとんどないという結果を報告している(Rossi et al. Mol Cancer Res 2003)。
※6 患者に不必要な身体的・経済的負担
効果のないがん治療を施すことで起きる患者の負担。逆に、効果のないがん治療を避けることで、患者に対し無駄な副作用を排除し、治療の際起こる様々な苦痛を回避できる。また、無駄な治療にかかる治療費も抑制できるため、患者の経済的負担の軽減にもつながる。
※7 事前治療効果予測法
治療開始前に治療効果を予測する方法。個々のがんにはそれぞれ個性があり、同じ部位のがんでも、個々の患者によって、治療の奏功性には差があることが知られている。そのため、効果のないがん治療を回避するために、治療開始前に治療効果を予測する方法の開発が求められている。こうした事前の治療効果予測を行うことで、患者のクオリティ・オブ・ライフ(QOL=生活の質)を高めることができるほか、医療費の抑制につながると期待される。
※8 分子イメージング研究センター
平成17年度に放射線医学総合研究所に創立された研究センター。「分子イメージング」は、生体内で起こる様々な生命現象や分子機能を画像化する手法であり、がん等の疾患診断法として注目されている。同センターでは、文部科学省が推進する「分子イメージング研究戦略推進プログラム」の「PET疾患診断研究拠点」として選定を受けており、最先端の分子イメージング研究を行っている。
※9 酢酸PET
ポジトロン放出核種である11Cで標識した11C酢酸を用いたPET画像診断法。
※10 増殖や転移に関わる重要な機能
がん細胞の細胞増殖・仮足形成・遊走・浸潤は、がんの増殖・転移に関与し、その病状を悪化させる重要な機能である。中でも、がん細胞の仮足形成・遊走・浸潤は、がんの転移に重要な役割を果たす。がん細胞は、腫瘍塊から離れて走性を示す(遊走する)ことで、血管に入り全身に広がる。その際、がん細胞は、膜状の構造体(仮足)を形成し、遊走する。また、がん細胞は、周囲の組織を壊しながら入り込み,拡大していく(浸潤する)ことで、転移巣を形成する。
※11 PET画像診断により、がんに対するFASN標的治療の効果を予測することで、より効果的な治療戦略が提案できる
本研究成果から、PETを用いFASN標的治療における適用がんを見つけられること、FASN標的治療はがんの増殖・転移の抑制に効果的であることが示された。こうしたことから、PET画像診断を用いてFASN標的治療の適用可能ながんを知り、そうしたがんに対し本治療を施すことで原発巣の増殖抑制のみならず、転移の予防効果も期待できると考えられる。
※12 米国スローンケタリング記念がんセンター
ニューヨークに位置する世界最大級のがんセンター。世界のがん研究をリードする数多くの研究が行われている。
Memorial Sloan Kettering Cancer Center
※13 治療標的
治療の的となる対象、特に分子等を指す。がんを治療する際、がんに高く発現する分子や重要な機能を果たしている分子を治療標的とすることで、より高い治療効果が得られると期待されている。
※14 遺伝子抑制細胞
特定の遺伝子の機能を抑制した細胞。本研究では、FASNを標的とするshRNA(short hairpin RNA)を細胞に導入し、RNA干渉(RNA interference, RNAi)を起こさせ、遺伝子抑制を行った。これにより、遺伝子がFASNを作るのを抑えることができる。
プレスリリースのお問い合わせ
ご意見やご質問は下記の連絡先までお問い合わせください。
独立行政法人 放射線医学総合研究所 企画部 広報課
Tel:043-206-3026
Fax:043-206-4062
E-mail:info@nirs.go.jp
