PETを用いて神経細胞のダメージを画像化することに成功
―脳梗塞などの脳神経疾患の治療薬開発に役立つ可能性―
2013年8月1日
独立行政法人放射線医学総合研究所(理事長:米倉義晴)
分子イメージング研究センター分子認識プログラム
由井 譲二 技術員
本研究成果のポイント
- PET※1薬剤[11C]ITMM※2を用いて、脳梗塞の前段階といえる一時的に血流の止まった状態のモデルラットの脳を体の外から観察し、神経細胞のダメージを画像化する画期的な方法を開発した。この方法を用いて、治療薬投与により神経細胞のダメージが緩和される様子をモニタリングし、治療薬の効果の確認に成功した。
- 脳梗塞をはじめとする各種の脳神経疾患の発症、進行の機序解明及び脳保護治療薬の開発と治療効果判定に関して有効な手段となると期待される。
放射線医学総合研究所分子イメージング研究センター※3の由井譲二技術員らは、当センターで開発したPET薬剤[11C]ITMMを用いて、脳梗塞の前段階といえる、一時的に血流が止まった状態を引き起こしたモデルラットにおいて、血流が一時的に止まった部位での神経細胞のダメージの画像化と治療薬の治療効果確認に成功しました。
このPET薬剤が特異的に結合する物質は代謝調節型1型受容体※4(以下、mGlu1)と呼ばれるタンパク質です。このタンパク質は神経細胞膜上にのみ存在し、通常状態では神経伝達物質の調節などの重要な役割を果たしますが、脳梗塞等の脳神経疾患で脳に障害が発生した場合、神経細胞死が起きる事象の発端を司ることが知られています。このタンパク質が、特定の部位で減少することはその部位の神経細胞が何らかのダメージを起こしているといえるため、このタンパク質の存在量を画像化することは、パーキンソン病、ハンチントン病なども含めた脳神経疾患の病態解明、及び神経細胞の保護を目的とした治療薬研究にとって重要な研究課題となっています。
今回の研究では、当該のPET薬剤を用いて、脳疾患モデルラットにおけるmGlu1の存在量を画像化しました。血流を一時的に止める処理をした後、1、2、4、7日後にPETで撮像した結果、処理した部位においてPET薬剤の集積が低下していく画像を得ました。これは、その部位で神経細胞のダメージが進行していることを示唆します。また、脳保護治療薬であるミノサイクリンを処理後から連日投与することにより、処理した部位におけるPET薬剤の集積の低下が穏やかになることを確認しました。これは、ミノサイクリン投与によりその部位で神経細胞のダメージが抑えられたことを示唆します。処理した部位でのmGlu1の存在量を別の手法により確認したところ、血流が止まった後に減少するものの、ミノサイクリン投薬後はその減少が穏やかになることを確認し、それらはPET薬剤の集積変化の画像と完全に一致することが分かりました。
本研究手法は、従来の手法と比べ神経細胞そのもののダメージを捉えており、脳梗塞をはじめとする各種の脳神経疾患の発症、進行の機序解明及び脳保護治療薬の開発と治療効果判定に関して有効な手段となると期待されます。本研究成果は2013年8月2日午前6時(日本時間)にStrokeのオンライン版に掲載されます。
研究の背景と目的
本研究で着目したタンパク質、代謝調節型グルタミン酸1型受容体(mGlu1)は、脳神経のシグナル伝達を担う膜上の分子の一つとして神経細胞の活動状態を調節しています。このタンパク質は、脳梗塞等の脳神経疾患で脳に障害が発生した場合、神経細胞死が起きる事象の発端を司ることが知られているため、脳梗塞、パーキンソン病、ハンチントン病、アルツハイマー病、統合失調症など各種の脳神経疾患において重要な働きをもつ受容体として注目されています。このタンパク質は神経細胞膜上にのみ存在し、その減少は神経細胞のダメージを反映しているといえるため、その存在量を画像化することは、各種の脳神経疾患の病態解明、及び神経細胞の保護を目的とした治療薬研究にとって重要な研究課題となっています。
そのため、これまでにmGlu1を画像化するためのPET薬剤が数多く開発されてきました。放医研も、このタンパク質の脳内分布を画像化するために、多くの新規PET薬剤の開発を進め、これまでの薬剤よりも目的のタンパク質に対する高い結合能と選択性を持ち、体内での適度な安定性を兼ね備え、ヒトへの使用に堪えうる[11C]ITMMの合成に成功しています。この薬剤は、ヒト脳に対する世界初の臨床研究が行われている有望株で、今回の研究では、このPET薬剤が、脳梗塞の前段階状態のモデルラット脳におけるmGlu1の画像化に有効かどうか、また、脳保護治療薬として知られるミノサイクリン投与による治療効果を画像化できるかどうかを検証しました。なお、この研究の薬剤開発については、文部科学省委託事業「分子イメージング研究戦略推進プログラム」における成果を一部活用しています
研究手法と結果
今回の研究では、図1に示すタイムスケジュールでPET撮像を行いました。まず、正常ラットにPET薬剤を投与し脳のPET撮像を行いました(図1のA)。次に別のラットに対し、脳の片側の血管に、30分間、血流が一時的に止まった状態を模擬する外科手術を行い、1、2、4、7日を経過した時点で、PET撮像を行いました(図1のB)。
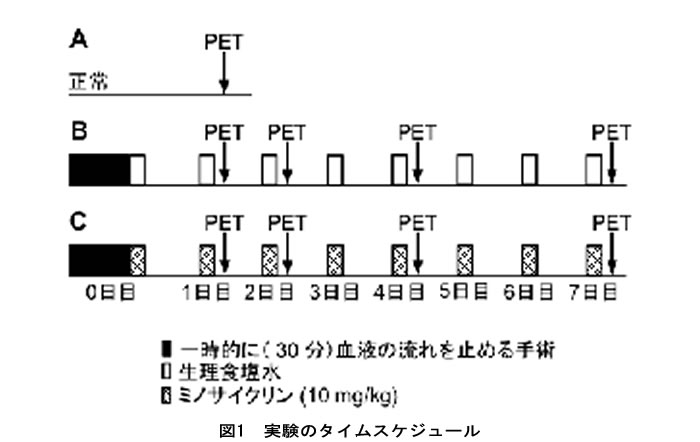
一方、治療薬(ミノサイクリン)の効果を確かめるために別のラットに対し同様に外科手術を行い、治療薬を連日投与しつつ、手術後1、2、4、7日を経過した時点で、PET撮像を行いました(図1のC)。なお対照とするラット(図1のB)には注射の影響を揃えるためにミノサイクリンを投与する際に用いたものと同じ生理食塩水を投与しています。
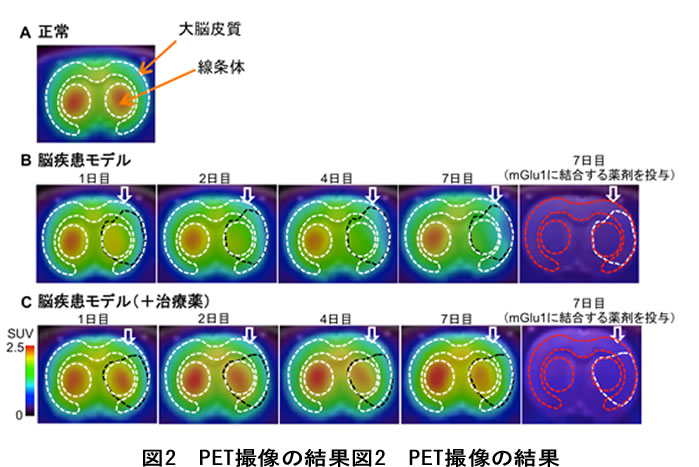
その結果、正常ラット脳においては、線条体※5と大脳皮質※6と呼ばれる部位において、PET薬剤の集積が認められました(図2のA)。また、脳疾患モデルラット脳のPET画像では、正常側に比べ、手術を行った側(矢印)にある線条体及び大脳皮質において、時間の経過と共に、PET薬剤の集積の低下が見られました(図2のB)。これは、疾患部位で神経細胞のダメージが進行していることを示唆します。
さらに、PET画像がmGlu1に起因するものかを確認するため、手術後7日経過した後、mGlu1とPET薬剤の結合を妨げる薬剤をPET薬剤と同時に投与することによって、脳内におけるPET薬剤の集積がほぼ消失したことから、PET画像で見られたシグナルは主にmGlu1の存在量を反映していることが証明されました。
一方、治療薬のミノサイクリンを連日投与すると、治療薬を投与しなかったラット(図2のB)に比べPET薬剤の集積の低下が緩やかになることが確認されました(図2のC)。これは、治療薬投与により疾患部位で神経細胞のダメージが抑えられたことを示唆します。
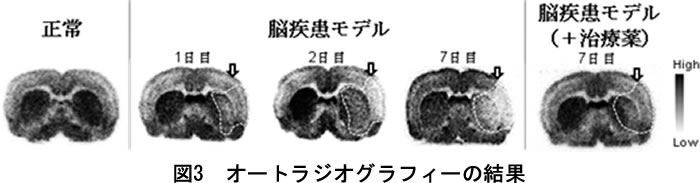
処置した部位でのmGlu1の局在を確認するために、PET撮像実験とは別に作成した脳疾患モデルラットに対し、脳のオートラジオグラフィー※7実験を行いました。手術後、1日、2日、7日後に脳切片を作成し、オートラジオグラフィーを行ったところ、時間と共に手術した側(矢印)におけるPET薬剤の集積の低下が見られ(図3中央)、その傾向はPET画像と一致しました。また、治療薬を連日投与して7日目にオートラジオグラフィーを行ったところ、PET薬剤集積低下が起こらず、顕著な抑制効果が見られました(図3右)。さらに、免疫染色などを用い疾患部位におけるmGlu1の存在量を確認したところ、手術後にmGlu1は減少するが、その減少はミノサイクリン投薬により穏やかになったことを確認し、それらはPET画像の集積変化と完全に一致しました。
本研究成果と今後の展望
今回のPET薬剤を用いた撮像により、タンパク質mGlu1を画像化することにより、神経損傷の度合いを早期段階においていち早く捉えることができ、また、治療薬の効果をモ二タリングできることを証明しました。
さらに、使用した治療薬、ミノサイクリンが持つ脳保護作用のメカニズムは疾患部位におけるmGlu1の減少を抑制することであることが証明されました。このことはmGlu1をPETで画像化することで神経細胞の活性度を評価することが可能であることを意味します。また、今回の撮像は、通常の(MRIなどによる)脳代謝の画像化に比べ、神経損傷に対し、より本質にせまる診断ツールになりえ、血流が一時的に止まった脳における早期及び微小な変化を捉えることができることが示されました。さらに、今回の手法は、脳梗塞の治療薬を開発する際の、抗神経炎症薬及び血栓溶解薬などによる治療効果の評価にも応用できると考えられます。
今回の研究成果は、脳梗塞をはじめとする各種の脳神経疾患の発症、進行の機序解明及び脳保護治療薬の開発と治療効果判定に関して有効な手段となると期待されます。
用語説明
※1 PET
PETとはPositron emission tomographyの略称で、陽電子断層撮像法のこと。PET装置は、画像診断装置の一種で陽電子を検出することにより様々な病態や生体内物質の挙動をコンピュータ処理によって画像化する。
※2 [11C]ITMM
N-[4-[6-(isopropylamino)pyrimidin-4-yl]-1,3-thiazol-2-yl]-4-[11C]methoxy-N-methylbenzamideの略。2012年に放医研がPET用に開発した、mGlu1の機能を妨げることなくmGlu1に特異的に結合する性質を持った試薬。半減期が20分程度の11Cを付けている。
※3 分子イメージング研究センター
平成17年度に放医研に創立された分子イメージング研究を行っている研究センター。腫瘍や精神疾患に関する基礎研究や臨床研究のほか、分子プローブの開発や放射薬剤製造技術開発、PETやMRIの計測技術開発や病態適用など、分子イメージングの基礎研究から疾患診断の臨床研究まで幅広い研究を行う世界屈指の分子イメージング研究拠点。藤林康久センター長は文部科学省が推進する「分子イメージング研究戦略推進プログラム」の「PET疾患診断研究拠点」の業務主任者であり、その下で先端的なPET疾患診断研究が行われている。
※4 代謝調節型1型受容体(mGlu1)
神経の興奮を司るグルタミン酸作動型神経線維において、神経への興奮伝達の程度を調節している。最近、遺伝的変異や環境ストレス等における神経の病変時に一時的なグルタミン酸過剰放出が生じてmGlu1の過剰な活性が起こり、結果として神経細胞死を誘発することが明らかになっている。しかし、それらの詳細なメカニズムやその他の神経受容体との関連性は、未だ明らかにされていない。
※5 線条体
線条体は大脳の皮質下構造であり、大脳基底核の主要な構成要素のひとつ。ドーパミンが豊富な部位で運動機能への関与が最もよく知られている。
※6 大脳皮質
大脳の表面に広がる神経細胞の薄い層。知覚、随意運動、思考、記憶など、脳の高次機能を司る。
※7 オートラジオグラフィー
組織切片などのサンプル上に結合した放射性物質から放出される放射線を画像化する技術。今回の研究では、生きているラットの様々な影響(血流や体温)を排除して、脳の切片にPET薬剤がどのように結合するかを画像化した。
プレスリリースのお問い合わせ
ご意見やご質問は下記の連絡先までお問い合わせください。
独立行政法人 放射線医学総合研究所 企画部 広報課
Tel:043-206-3026
Fax:043-206-4062
E-mail:info@nirs.go.jp
