平成28年1月29日
国立研究開発法人 放射線医学総合研究所
発表のポイント
- 病態進行に伴い代謝型グルタミン酸受容体1(mGluR1)※1の発現量が変化することを世界で初めて明らかに
- 様々な脳神経疾患の進行度を客観的に判定することができるバイオマーカーとして期待
放射線医学総合研究所(理事長:米倉義晴、以下、放医研)は、独自に開発したPET※2薬剤[11C]ITDM※3を用い、パーキンソン病(以下、PD)の病態進行に伴い脳内の代謝型グルタミン酸受容体1(以下、mGluR1)の発現量が経時的に変化することを世界で初めて明らかにしました。
PDは、アルツハイマー病に次いで頻度の高い脳神経疾患で、日本における有病率は10万人当たり100~150人の難病です。今までの研究から、PD患者の脳内にはα-シヌクレイン※4とよばれる異常タンパクの蓄積が認められること、更に運動や認知機能の低下には、脳内のドーパミン神経系※5やコリン神経系※6の障害が関与していることが分かっています。しかし、異常タンパクの蓄積からこれらの神経障害に至るまでの病態背景については分かっていませんでした。近年、PDを含む様々な脳神経疾患で異常タンパク蓄積のような脳内環境の変化がmGluR1等の神経受容体の発現量を変化させることが分かってきました。
我々は、mGluR1の発現量とPDの病態との関連性を検証することで、異常タンパクの蓄積が引き起こす神経障害の病態背景の一端を明らかにできるのではないかと考えました。本研究では、PDモデル動物に[11C]ITDMを投与してPETによる脳内mGluR1の発現量測定を長期間実施し(図)、発現量の経時的な変化と病態との関連性を検証しました。その結果、PDラットの線条体※7において、明らかな行動障害が現れる前後でmGluR1の発現量が大きく変化し、運動障害の進行に伴って減少していくことが分かりました。また、mGluR1の発現量変化は、運動障害の病態スコアと強い相関を示しました。
本研究により異常タンパクの蓄積は、mGluR1が関与するグルタミン酸神経系の異常を引き起こし、このことが運動障害と密接に関与していることが示唆されました。本研究で得られた結果は、α-シヌクレイン以外の異常タンパクの蓄積により引き起こされる様々な脳神経疾患の病態背景の解明においても重要な知見と考えられます。更にmGluR1は、異常タンパクの蓄積が引き起こす脳神経疾患において、その疾患の進行度の客観的な判定に有効なバイオマーカーとなることが期待されます。
![[11-C]ITDM PET画像](/uploaded/image/2758.jpg)
この研究成果は、日本学術振興会(JSPS)「科研費若手研究(B)(課題番号 25861135)」の一環として行われ、2016年1月13日に米国神経科学会発行のThe Journal of Neuroscienceに掲載されました。
背景と目的
パーキンソン病(PD)は、脳の線条体という部位でドーパミンとアセチルコリンという神経伝達物質の絶対量の不均衡が生じることで、「ふるえ」、「強剛」、「無動」、「姿勢障害」などの運動障害や認知機能障害を引き起こす脳の病気です。病因は諸説ありますが、α-シヌクレインと呼ばれる異常タンパクの蓄積がドーパミン産生細胞の障害を引き起こすことが要因の一つとして考えられています。
本研究で着目した、代謝型グルタミン酸受容体1(mGluR1)は、グルタミン酸由来の興奮性神経伝達を介在する神経細胞のスパイン(神経細胞間の連結部分)と呼ばれる部位で発現している脳の神経受容体の一つです。このmGluR1は、神経の興奮を調節する働きを持ち、PDをはじめとする様々な脳神経疾患において重要な関わりがある分子として注目されています。最近になって、α-シヌクレインのような異常タンパクの蓄積は、神経の過剰な興奮を引き起こし、結果としてmGluR1の発現量に変化をもたらすことが分かってきました(図1)。
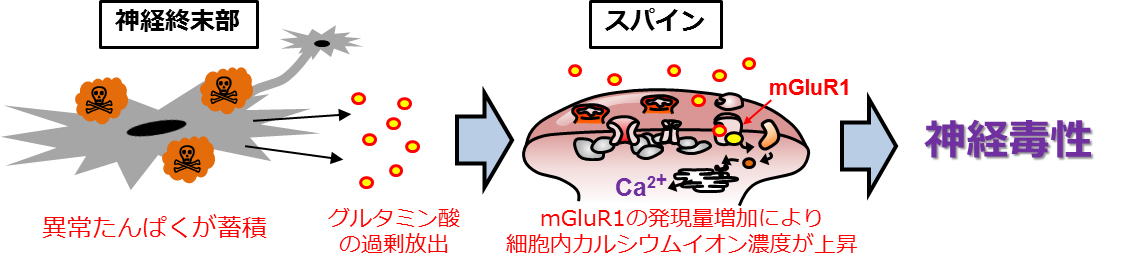
図1 異常タンパクの蓄積とグルタミン酸を介した神経毒性
こうした脳内の神経受容体の発現量変化は、生きたままの状態で検出することは難しく、これまでは被検体の死後脳を解剖して調べられていました。近年、放医研では、mGluR1に特異的に結合するPET薬剤[11C]ITDMの開発に成功し、PETを用いて生きた動物の脳内におけるmGluR1の発現量を正確に測定することを可能にしました(図2)。そこで、今回の研究では、[11C]ITDMを用いて、PDモデルラットのmGluR1発現量の変化をPETにより生きたままの状態で長期間観察することを試みました。
![[11-C]ITDM-PETによるmGluR1発現量の定量測定](/uploaded/image/2760.jpg)
図2 [11C]ITDM-PETによるmGluR1発現量の定量測定
研究手法と結果
今回の研究では、PDのモデル動物として、家族性パーキンソン病の病因遺伝子であるヒトA53T変異SNCA遺伝子※8が遺伝的に挿入されたラット(PDラット)を用いて実験を行いました。PDの病態進行度は、オープンフィールド試験※9により測定した行動量のスコアを用い、行動障害の指標としました。オープンフィールド試験と[11C]ITDMを用いたPET撮像は、図3に示したスケジュールで野生型とPDラットを用いて、それぞれ行いました。
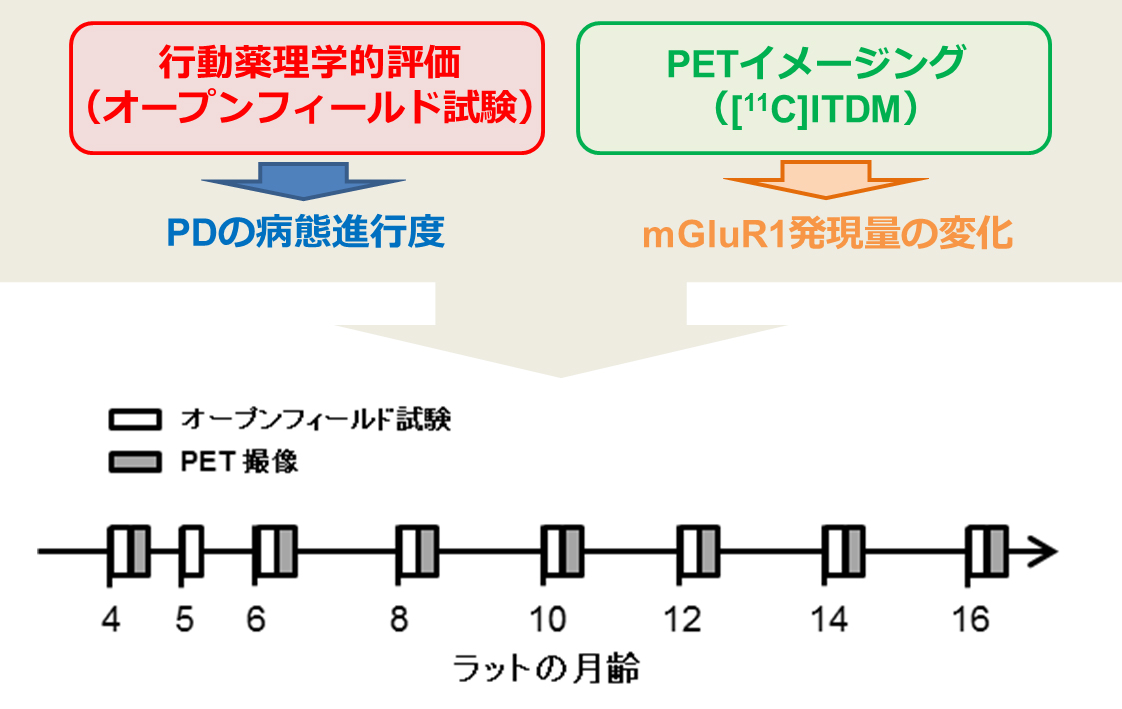
図3 本研究で行った実験のタイムスケジュール
オープンフィールド試験の結果、野生型ラットの行動量は月齢と共に緩やかな減少を示したのに対し、PDラットでは、若齢の4~5月齢にかけて一時的に増加傾向を示し、その後、劇的に減少し、明らかな行動障害を呈しました(図4A)。また、16月齢のラット脳切片を用いて、変異型α-シヌクレインに対する抗体を用いて染色したところ、PDラット線条体において変異型α-シヌクレインの集積が確認されました(図4C)。
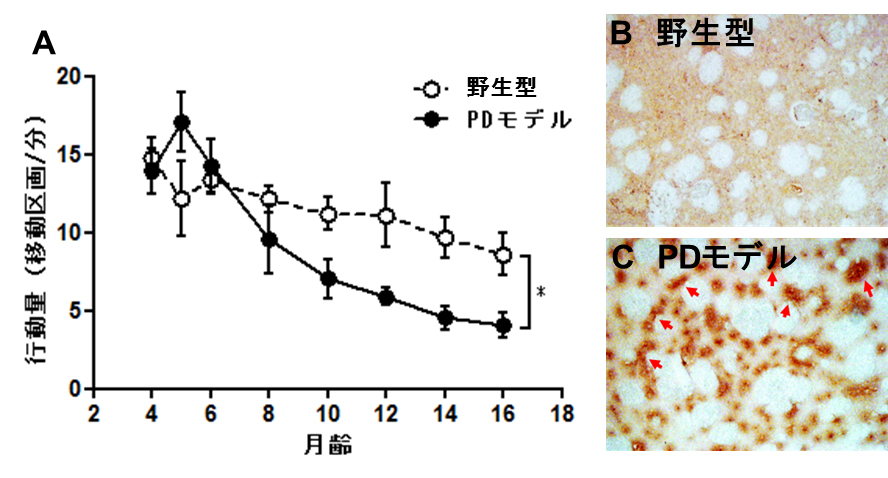
図4 野生型及びPDモデルの行動量の月齢推移(A)と変異型α-シヌクレインに対する抗体染色画像
(B:野生型、C:PDモデル)*P<0.05
PETイメージングの結果では、野生型ラットに比べて、PDラットにおけるmGluR1に対する[11C]ITDMの結合能※10(mGluR1の発現量を反映した値)は4月齢で高く、その後、月齢が進むにつれて有意に減少することが分かりました(図5)。
![[11-C]ITDMを用いた線条体のPET定量画像](/uploaded/image/2763.jpg)
図5 [11C]ITDMを用いた線条体のPET定量画像(冠状面)(A)と結合能の推移(B)
また、PDラットの各月齢における[11C]ITDMの結合能と行動量スコアを用いて相関の有無を確認したところ、mGluR1の発現量変化と行動障害の進行度との間には非常に強い相関が認められました(図6A)。さらに、ドーパミン神経の密度測定に用いられるPET薬剤[18F]FE-PE2I※11の結合能とmGluR1の発現量変化との相関を確かめたところ、中程度の相関が認められました(図6B)。
![[11-C]ITDMの結合能と行動量スコアの相関及びドーパミン神経密度に対するmGluR1発現量の相関](/uploaded/image/2764.jpg)
図6 [11C]ITDMの結合能と行動量スコアの相関(A)及びドーパミン神経密度に対するmGluR1発現量の相関(B)
相関の強さを示す相関係数(|r|)は、一般的に0.7以上で強い相関、
0.7~0.4で中間の強さ、0.4~0.2で弱い相関、0.2以下で相関無しとされる。
本研究成果と今後の展望
mGluR1に特異的に結合するPET薬剤を用いて、生きたままの状態で、PDラット脳のmGluR1の発現量変化を客観的に長期間観察することにより、明らかな行動障害が現れる前後でmGluR1の発現量が大きく変化し、更に病態の進行度に伴い減少していくことを世界で初めて明らかにしました。また、mGluR1の発現量変化が、PDにおける行動障害とドーパミン神経の密度変化に対して相関関係があることを示しました。
PDラットでは、野生型ラットに比べて運動障害が現れる前にmGluR1の発現量が高かったことから、ドーパミン神経の変性が起こる前に、グルタミン酸に由来する過剰な神経興奮が起こり、このことがドーパミン神経に障害を与えたのではないかと推測されます。この結果は、動物実験の段階ではありますが、異常タンパクの蓄積により引き起こされる様々な脳神経疾患の病態背景の解明においても重要な知見と考えられ、PDをはじめとする異常タンパクの蓄積が引き起こす神経障害のメカニズムの解明に役立つことが期待されます。また、PETイメージングによるmGluR1発現量の測定は、異常タンパクの蓄積が引き起こす脳神経疾患において、その疾患の進行度を客観的に判定することができる有用なバイオマーカーとなることが期待されます。
用語解説
※1 代謝型グルタミン酸受容体1
グルタミン酸由来の興奮性神経伝達を介在する神経受容体の一つ。主に、小脳、視床、線条体のシナプス後部に分布している。Gたんぱく質と共役してセカンドメッセンジャーを産生し、細胞内の貯蔵カルシウムイオンを放出させる。
※2 PET
陽電子断層撮像法(Positron Emission Tomography)の略称。18Fや11C等のガンマ線を放出する放射性同位元素で標識した薬剤を生体内に投与することで、特定の分子の動きを生きたままの状態で画像化する技術。コンピュータ処理により、分子の局在と密度を定量的に測定することができる。
※3 [11C]ITDM
N-[4-[6-(isopropylamino)pyrimidin-4-yl]-1,3-thiazol-2-yl]-N-methyl-4-[11C]methylbenzamideの略。2012年に放医研がPET用に開発した、mGluR1に特異的に結合する性質を持ったPET薬剤。半減期が20分程度の11Cで標識されている。
※4 α-シヌクレイン
脳の神経組織内にある機能不明なタンパク質。正常な状態では、可溶性のタンパク質であるが、遺伝的な変異が起こると難溶性の原線維を形成し凝集する。パーキンソン病患者の脳の病理標本で見られるレビー小体の構成タンパク質。
※5 ドーパミン神経系
ドーパミンと呼ばれる神経伝達物質が関与する神経系。神経伝達物質の一つであるドーパミンは、報酬系などに関与し、意欲、動機、学習などに重要な役割を担っている。パーキンソン病において、脳内のドーパミン不足が症状を引き起こすとされている。
※6 コリン神経系
アセチルコリンと呼ばれる神経伝達物質が関与する神経系。パーキンソン病では、脳内のドーパミンが不足して神経伝達物質のバランスが崩れることにより、相対的にアセチルコリンの活性が強くなり、運動機能障害が起こるとされている。
※7 線条体
線条体は大脳の皮質下構造であり、大脳基底核の主要な構成要素のひとつ。ドーパミン産生細胞が豊富な組織。
※8 A53T変異SNCA遺伝子
α-シヌクレインをコードしている遺伝子の53番目のアミノ酸が、アラニンからスレオニンに変異している。
※9 オープンフィールド試験
新奇環境下での自発的な活動性を測定する試験。60センチ四方の正方形の箱の中央にラットを置き、5分間の行動量を測定し、情動性を評価する。
※10 結合能
PET薬剤の標的分子に対する特異結合量を意味する定量的な値。標的分子の密度を反映している値として、核医学分野で汎用されている。
※11 [18F]FE-PE2I
2009年に、スウェーデンのカロリンスカ研究所が開発したドーパミン神経の可視化のためのPET薬剤。
プレスリリースのお問い合わせ
ご意見やご質問は下記の連絡先までお問い合わせください。
国立研究開発法人 放射線医学総合研究所 企画部 広報課
Tel:043-206-3026
Fax:043-206-4062
E-mail:info@nirs.go.jp
