生体内腫瘍で効果的ながん治療薬を効率よく選択できる新規薬剤スクリーニング法の開発に成功
-患者組織由来がん細胞を用いた各患者に最適な治療薬選択へ応用に期待-
平成27年2月19日
独立行政法人放射線医学総合研究所(理事長:米倉義晴)
分子イメージング研究センター分子病態イメージング研究プログラム
吉井幸恵主任研究員
発表のポイント
- ナノインプリンティング表面加工プレートを用いた3次元(3D)がん細胞培養※1による簡便な薬剤スクリーニング※2法(ナノインプリンティング3D培養薬剤スクリーニング法)を開発
- 従来の薬剤スクリーニング法に比べ、生体内腫瘍で効果の高い薬剤を高効率に選択
- 本法に患者組織から得たがん細胞を使用する方法も確立、各患者に最適ながん治療薬選択※3への応用に期待
がんは、日本人の死因第1位を占める疾患で、より効果的な治療薬の開発が求められています。従来のがん治療薬開発における薬剤スクリーニング法(以下、従来法)では、培養容器の平らな底面上で貼り付くようにがん細胞を培養した2次元(2D)培養が主に用いられていますが、立体構造を持つ生体内の腫瘍組織とは多くの点で性質が異なるため、効果の高いがん治療薬を効率よく選択することができませんでした。
独立行政法人放射線医学総合研究所(理事長:米倉義晴、以下「放医研」)は、ナノインプリンティング表面加工プレートによりがん細胞を生体内と同様に立体的に増殖させた3D培養を用いることで、従来法と比べて効率よく、生体内腫瘍で治療効果の高い薬剤を選択できる薬剤スクリーニング法(以下、本法)を開発しました。本法は、生体内腫瘍の性質を培養器内で再現する3Dがん細胞塊(スフェロイド)を利用して生体内の腫瘍に有効な薬剤を簡便にあぶり出すことができる画期的な方法です。本法を応用することにより、がん治療薬開発の開発時間やコストを削減するなどの高効率化が期待されます。また、本研究では、患者の生検検体や手術により摘出したがん組織から得たがん細胞を使って、本法により薬剤スクリーニングを簡便に行う方法も確立しました。この技術は、患者ごとの効果的ながん治療薬選択を可能にすると期待され、個々人に最適ながん医療を提供する「がん個別化医療」の推進に寄与すると考えられます。
本研究は、大阪府立成人病センター、Scivax(サイヴァクス)Life Sciences株式会社、福井大との共同研究であり、文部科学省「分子イメージング研究戦略推進プログラム」及び日本学術振興会「科研費基盤研究(C)(課題番号25461863)」の一環として行われたもので、現在、特許出願中です(特願2013-213730)。本成果は、生体材料の研究分野で世界的権威のある「Biomaterials」誌オンライン版に2015年2月19日頃に掲載予定です。
研究の背景と目的
がんは、日本人の死亡原因の第1位を占める疾患で、より効果的な治療薬の開発が求められています。これまで、がん医薬品開発における薬剤スクリーニングには、平面な培養器底面上で培養した2D培養がん細胞が一般に用いられてきました。しかしながら、2D培養がん細胞は立体構造を有する生体内腫瘍組織と多くの点で性質が異なるため、2D培養がん細胞を用いたスクリーニングの結果得られた候補薬剤が、生体内で必ずしも奏功しないケースが多く見られ、医薬品開発の上で問題となっています。
こうした問題を克服すべく、我々は、ナノインプリンティング表面加工プレートを用いた3Dがん細胞培養※1により簡便に得られる3D培養がん細胞塊(スフェロイド)を薬剤スクリーニングに用いることで、2D培養がん細胞を用いる従来法と比べて、効率よく実際に生体内腫瘍に治療効果の高い薬剤を選択できる「ナノインプリンティング3D培養薬剤スクリーニング法」を開発しました。
また近年、がん医療においては、患者ごとのがん細胞の種類や特徴に応じた最適ながん治療薬を選択し、患者個別の治療を施す「個別化医療」の実現が望まれています。そこで、本研究では、患者がん組織由来のがん細胞を使って、本法により薬剤スクリーニングを簡便に行う方法も確立しました。
研究手法と結果
がん細胞株を用いたナノインプリンティング3D培養薬剤スクリーニング法
今回の研究では、ナノインプリンティング表面加工培養プレート(図1)に、ヒト大腸がん細胞株(HT29細胞、HCT116細胞)を播種後1週間培養し、スフェロイドを形成したものを使用しました。がん治療薬スクリーニングには、約100種類の既存の抗がん剤や有用な分子標的薬を含む化合物ライブラリーである標準阻害剤キット(SCADS inhibitorkit I「文部科学省科学研究費補助金・がんの特性等を踏まえた総合支援活動・化学療法基盤支援活動」提供)を用いました。スフェロイドに対し、各薬剤を1μM添加後3日間培養し、細胞活性を評価することにより候補薬剤を選定しました。比較として、2D培養がん細胞を用いた薬剤スクリーニングも同様に行いました。その結果、2D培養薬剤スクリーニングでは、5種類の薬剤(doxorubicin, scriptaid, trichostatin A,cantharidin,MG132)が選択されたのに対して、ナノインプリンティング3D培養薬剤スクリーニングでは、唯一 MG132が選択され、その他の薬剤は治療効果があまり見られませんでした(図2a)。次に、上記の薬剤スクリーニングで選定された5種類の薬剤を用い、腫瘍移植モデルマウス(HT29腫瘍、HCT116腫瘍)に対する治療実験を行いました。その結果、どちらの移植腫瘍に対しても、スフェロイドで選択された薬剤(MG132)は高い治療効果を示しましたが、2D培養がん細胞でのみ選択された薬剤(doxorubicin,scriptaid,trichostatinA,cantharidin)は、顕著な治療効果を示しませんでした(図2b)。このことから、ナノインプリンティング3D培養薬剤スクリーニング法は、従来の2D培養薬剤スクリーニングよりも、高効率に、実際に生体内腫瘍に効果的な薬剤を選択できることが明らかと���りました。
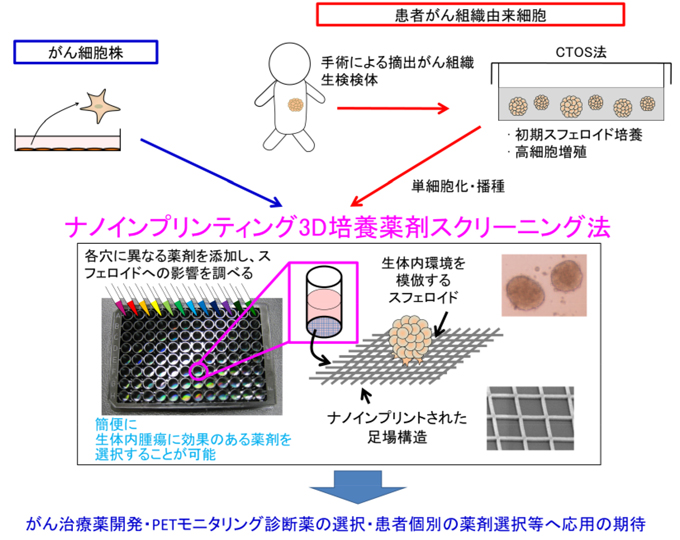
図1 本研究の概要
ナノインプリンティング3D培養薬剤スクリーニング法本法は、がん細胞株や患者がん組織由来のがん細胞を用いて、スフェロイドを形成し、簡便に薬剤スクリーニングを行うことができる方法である。本法により形成されたスフェロイドは、生体内腫瘍に類似した性質を有するため、生体内腫瘍で効果の高い薬剤を高効率に選択することが可能になると考えられる。本法は、がん治療薬開発・患者個別の薬剤選択等への応用が期待される。
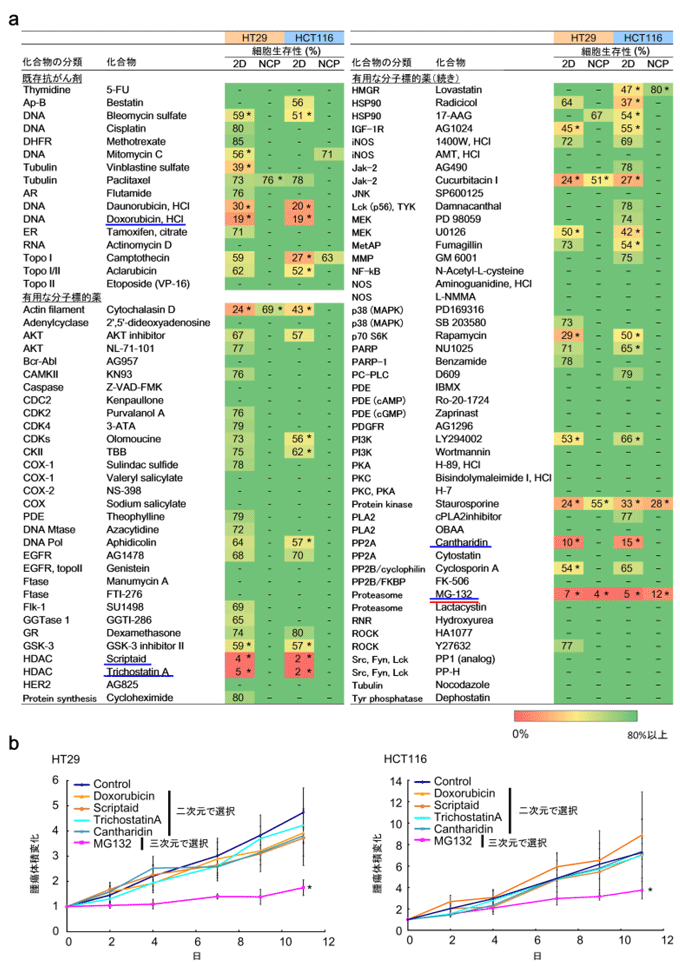
図2 細胞株(HT29、HCT116)を用いた薬剤スクリーニングと治療実験
a:2種のヒト大腸がん細胞株(HT29、HCT116)を用い、スフェロイド並びに2D培養がん細胞で薬剤スクリーニングを実施した。表中の2Dは2D培養がん細胞、NCPはスフェロイド。治療薬を添加していないものと比較して有意に細胞生存性を低下させた(P<0.05)薬剤(表中の*)のうち、細胞生存性が20%未満になった薬剤を選択した。2Dで選択された薬剤は青い下線、3Dで選択された薬剤は赤い下線で示す。
b:腫瘍移植モデルマウス(HT29腫瘍、HCT116腫瘍)を用いた治療実験。スフェロイドで選択された薬剤では高い治療効果が見られた一方、2D培養がん細胞で選択された薬剤は治療効果があまりなかった。グラフ中の*で示された薬剤は、治療薬を添加していない群と比較して有意に腫瘍増殖が抑制されていた(P<0.05)。
患者がん組織由来のがん細胞をナノインプリンティング3D培養薬剤スクリーニング法に適用
次に、本法に患者がん組織由来のがん細胞を適用する方法を検討しました。一般に、患者のがん組織から、がん細胞を採取して初期培養をすることは、患者由来の他の細胞が増殖してしまうため困難であるとされています。一方、最近、こうした問題を解決し純度の高い患者がん組織由来がん細胞塊を高効率に得る新たな培養法(Cancer Tissue-Originated Spheroid(CTOS)法)が本研究の共同研究機関である大阪府立成人病センターにより開発されました。今回、我々は、このCTOS法とナノインプリンティング3D培養法を組み合わせ、患者がん組織由来のスフェロイドを用いて、簡便・高効率に薬剤スクリーニングを実施する方法も考案しました(図1)。この方法では、CTOS法で得た患者がん組織由来細胞塊をいったん単細胞化し、それをナノインプリンティング表面加工プレート上で再凝集させて得られる構造的に均一な患者がん組織由来のスフェロイドを薬剤スクリーニングに用います。本研究では、異なる大腸がん患者のがん組織から得られた2種類のスフェロイド(C45、C132)に対し、標準阻害剤キット(SCADS inhibitor kit I)を用いた薬剤スクリーニングを行い、その有用性を検討しました。その結果、薬剤スクリーニングで効果が高いものとして選択された薬剤は、患者腫瘍移植モデルマウス※4(C45腫瘍、C132腫瘍)に対する治療実験においても、効果が高いことが示されました(図3)。こうしたことは、患者がん組織由来がん細胞を用いたナノインプリンティング3D培養薬剤スクリーニング法によって、それぞれの患者の腫瘍に対し治療効果の高い薬剤を選択できる可能性を示唆し��いると考えられ、今後の応用が期待されます。
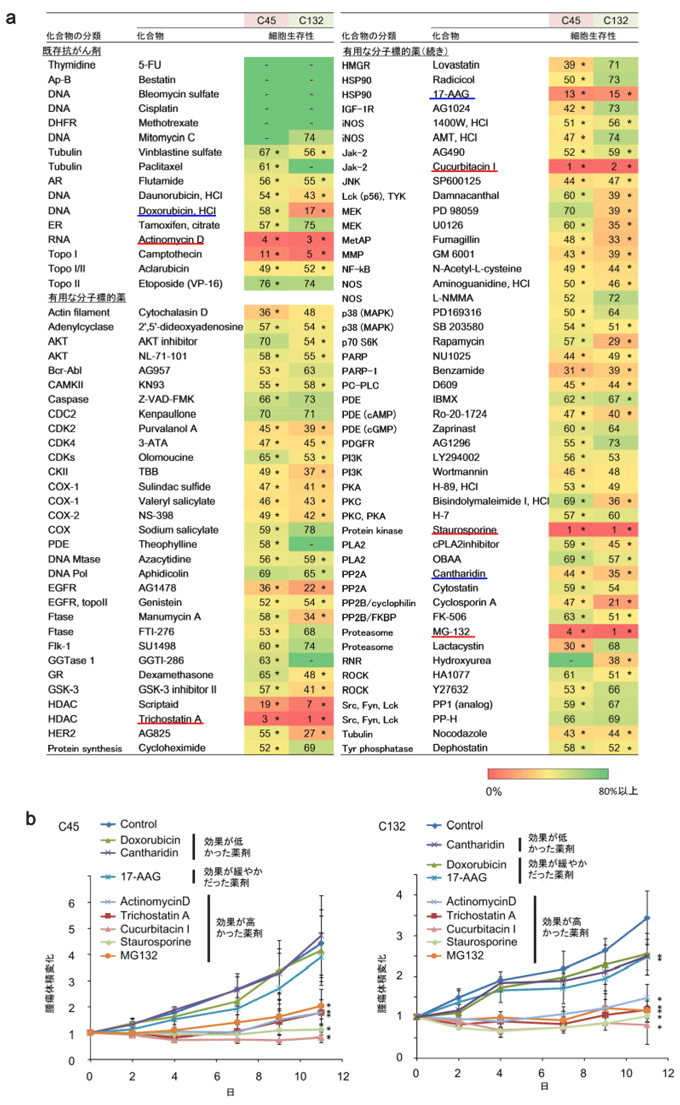
図3 患者由来がん細胞スフェロイド(C45、C132)を用いた薬剤スクリーニングと治療実験
a:異なる大腸がん患者のがん組織から得られたがん細胞を用いてナノインプリンティング3D培養法により作製した2種類のスフェロイド(C45、C132)を用い、薬剤スクリーニングを実施した。治療薬を添加していないものと比較して有意に細胞生存性を低下させた(P<0.05)薬剤(表中の*)のうち、細胞生存性が5%未満になった薬剤を選択した。スクリーニングで選択された薬剤を赤い下線で、患者腫瘍移植モデルを用いた治療実験で比較として用いた効果が低い・緩やかな薬剤を青い下線で示す。
b:患者腫瘍移植モデル(C45腫瘍、C132腫瘍)を用いた治療実験。患者がん組織由来がん細胞のスフェロイドを用いた薬剤スクリーニングで効果が高いものとして選択された薬剤では高い治療効果が見られた一方、薬剤スクリーニングで効果が低かった薬剤・緩やかだった薬剤は、移植腫瘍においても効果が低かった。グラフ中の*で示された薬剤は、治療薬を添加していないものと比較して有意に腫瘍増殖を抑制している(P<0.05)。
本法の応用例
また、本研究では、本法の応用の一例として、がん治療の効果を早期に判定するPET(Positron emission tomography)モニタリング診断薬の選択※5における本法の応用の可能性についても明らかにしています。一般に、がんの治療後、その効果をモニタリングし、早期に治療効果の有無を判定することは、がんの治療戦略を検討する上で重要になっています。近年、PET検査は、がん治療の早期治療効果判定に有効であるとして用いられるようになってきました。しかし、使用される治療薬や、対象となるがん種によって、適切なPET薬剤の種類が異なるため、最適なPETモニタリング診断薬の選定が必要となります。そこで、HT29細胞由来のスフェロイド並びに腫瘍移植マウスに対し、治療薬としてMG132を投与後、両者の各種PET薬剤の取り込みの類似性を検討しました。なお、本検討では、グルコース代謝を反映するFDG、アミノ酸代謝を反映するメチオニン(MET)、酢酸・脂肪酸代謝を反映する酢酸(ACE)、核酸代謝を反映するFLT並びに4DSTの5種類のPET薬剤※6を候補として使用しました。MG132の投与によるスフェロイド及び移植腫瘍のPET薬剤の取り込み量の変化は、MG132非投与群におけるそれぞれのPET薬剤の取り込み量と比較することにより算出しました。その結果、スフェロイド、移植腫瘍のどちらも、FLT・4DSTでは取り込みの著しい減少が、MET・ACEでは取り込みの緩やかな減少が、FDGは逆に取り込みの上昇が観察され、両者におけるPET薬剤の集積パターンが一致することが明らかとなりました(図4)。このように、培養器中のスフェロイドと生体内に移��した腫瘍の代謝特性の類似性が示されたことから、本法は、がん治療薬のスクリーニング目的だけではなく、各治療薬に応じた最適なPETモニタリング診断薬の選択にも応用できる可能性が示唆されました。
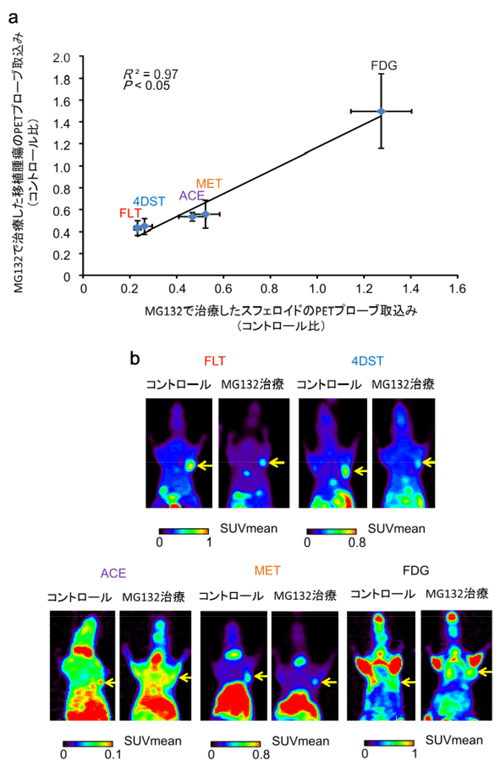
図4 MG132治療後のスフェロイドと移植腫瘍におけるPET診断薬の取り込み
a:HT29スフェロイドと移植腫瘍におけるMG132治療後の各種PETプローブの取り込みの比較。
b:HT29腫瘍移植モデルマウスのMG132治療後の各種PETプローブ取り込みを示すPET画像。
本研究成果と今後の展望
本研究では、従来法と比べて効率よく、実際に生体内腫瘍で治療効果の高い薬剤を選択できるナノインプリンティング3D培養薬剤スクリーニング法を開発しました。本法は、生体内の腫瘍特性を非常によく模倣するスフェロイドを利用することで、従来法に比べ効率よく生体内腫瘍に効果的な薬剤をあぶり出すことができると考えられ、今後がん治療薬開発の上で開発時間やコストを削減する画期的な技術になり得ると期待されます。
また、本研究では、本法に患者組織由来がん細胞を適用する方法も開発しました。患者組織由来がん細胞のスフェロイドを用いた薬剤スクリーニングは、患者個別の薬剤選択を可能にすることが示唆され、今後がん個別化医療の推進につながるものと期待されます。
また、本研究では、がんの治療後、その効果をモニタリングし、治療効果の有無を診断できるPETモニタリング診断薬の選定にも、本法が有用であることを示しました。本法を応用することで、適切なPETモニタリング診断薬を用いた早期かつ的確な治療効果判定が可能になると考えられます。今後放医研では、本手法を生かした放射性医薬品の研究開発を行う予定です。
用語説明
※1 ナノインプリンティング表面加工プレートを用いた3Dがん細胞培養
ナノインプリンティングは,ナノスケールの超微細構造を物質表面に加工する技術。ナノインプリンティングにおいては,まず金型を作製し,それを用いてプレス成形するなどの方法で行われ、工業分野の他、医療分野においても、次世代の技術として期待されている。本研究で用いたナノインプリンティング表面加工プレート(Nano culture plate)は、ナノインプリンティング技術により、96ウェル培養プレートの底面に均質な凹凸の格子構造が施されており、細胞はこれを足場として接着し、立体的な細胞塊(スフェロイド)を形成する。3Dがん細胞培養は、立体的にがん細胞を成育させる培養法。
参考:本培養法に関するプレスリリース(2011年5月24日)
※2 薬剤スクリーニング
薬剤スクリーニングは、疾患に対する標的薬剤の発見するプロセス。一般に、薬剤スクリーニングでは、膨大な数の化合物のライブラリーを用いて薬効試験を行い、その過程で薬効の乏しい薬剤をふるいにかけ、有効薬剤を選択する。
※3 各患者に最適ながん治療薬選択
近年、がん医療においては、個々の患者のがんの個性に応じた「個別化医療」の実現が望まれている。そうした中で、個々の患者のがんに最適ながん治療薬を簡便・迅速に選択することができれば、より効果的ながん医療を提供できることになると考えられる。
※4 患者腫瘍移植モデル
本研究では、CTOS法によって得た患者由来がん細胞塊を免疫不全マウスに移植することにより患者腫瘍移植モデルを構築した。本モデルの移植腫瘍は、元の患者のがん組織の特性をよく反映していることが報告されている(Kondo et al. PNASUSA 2011)
※5 がん治療の効果を早期に判定するPET(Positron emission tomography)モニタリング診断薬の選択
PETとは、陽電子断層撮像法のこと。従来、PET検査は、がんに特異的に集積するプローブを用い、がんを発見・描出するツールとして広く用いられている。近年、がんの治療後のがん細胞の代謝減少をPETプローブの取り込み量の減少でモニターするPETモニタリング診断の有用性が認められてきた。しかし、使用される治療薬や、対象となるがん種によって、適切なPETプローブが異なるため、最適なPETモニタリング診断薬の選定・開発が必要とされている。
※6 5種類のPET薬剤
本研究では、候補PET薬剤として、2-[18F]fluoro-2-deoxy-D-glucose(FDG、フルオロデオキシグルコース);L-[methyl-11C]methionine(MET、メチオニン)、[1-11C]acetate(ACE、酢酸)、3'-[18F]fluoro-3'-deoxythymidine(FLT、フルオロチミジン)、4'-[methyl-11C]thiothymidine(4DST、チオチミジン)について検討した。
プレスリリースのお問い合わせ
ご意見やご質問は下記の連絡先までお問い合わせください。
独立行政法人 放射線医学総合研究所 企画部 広報課
Tel:043-206-3026
Fax:043-206-4062
E-mail:info@nirs.go.jp
