
 細胞内の核、ミトコンドリア、小胞体、ゴルジ体などの細胞小器官は、それぞれの機能を効率よく果たすため、外界から内部を隔離するための脂質二重膜を持っています。一方、真核細胞内には、これらの膜で仕切られた細胞小器官以外に、膜を持たない構造体も多数存在しています。代表的なものは、細胞質で形成される「RNA顆粒」と呼ばれるもので、主にRNAの貯蔵、代謝、分解輸送などの役割を担うRNAとタンパク質の凝集構造体です。
細胞内の核、ミトコンドリア、小胞体、ゴルジ体などの細胞小器官は、それぞれの機能を効率よく果たすため、外界から内部を隔離するための脂質二重膜を持っています。一方、真核細胞内には、これらの膜で仕切られた細胞小器官以外に、膜を持たない構造体も多数存在しています。代表的なものは、細胞質で形成される「RNA顆粒」と呼ばれるもので、主にRNAの貯蔵、代謝、分解輸送などの役割を担うRNAとタンパク質の凝集構造体です。
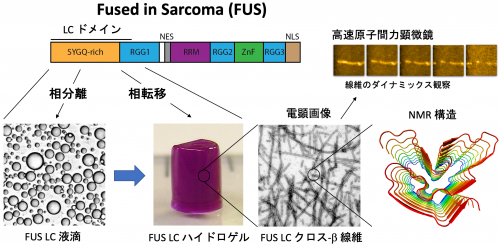
この膜を持たない細胞内構造体の形成機構は長年よく分かっていませんでしたが、最近、タンパク質とRNAによる相分離(たとえば水と油が分離する現象)がその形成機構であることが分かってきました。しかし、タンパク質やRNA分子が、相分離状態へ移行するとき、また相分離状態にあるときに、分子レベルでどのような状態になっているのか、まだよく分かっていません。
相分離状態のタンパク質はとてもダイナミックなので、従来の方法では解析は難しく、そのため我々は、量子技術を用いた量子センサーや中性子散乱法、リアルタイムに分子の動きを見ることができる高速原子間力顕微鏡を用いて、細胞内相分離機構の分子レベルでの解明を目指します。
また、神経変性疾患の原因となるタンパク質にはRNA顆粒に蓄積するものが多く、それらのタンパク質の異常が、顆粒形成のための相分離異常を引き起こして線維状凝集体を生じさせ、病気に至っているのではないかと考えられています。我々は、細胞内の相分離異常を引き起こすメカニズムを解明することで、神経変性疾患の治療法開発に貢献することも目標としています。

チームリーダー 加藤 昌人
メンバー
研究員 真板 宣夫
研究員 Kim Sunyong
実験補助 梶野 裕子
最近の成果
Fonda, D.B., Kato, M., Li, Y. and Murray, D.T. Cryo-EM and solid state NMR together provide a more comprehensive structural investigation of protein fibrils. Protein Sci. Oct;33(10):e5168, doi: 10.1002/pro.5168 (2024)
Fujii, K., Izumi, Y., Maita, N., Matsuo, K., Kato, M. Observation of the Liquid-Liquid Phase Separation of FUS-LC Using Vacuum-Ultraviolet Circular Dichroism Spectroscopy. Chirality, Aug;36(8):e23707, doi: 10.1002/chir.23707 (2024)
Kato, M. 「量子センサーと分光学を用いた相分離液滴の構造ダイナミクス研究」, 医学のあゆみ, Vol.290, No. 4, 25078-83 (2024)
Gu, J., Zhou, X., Sutherland, L., Kato, M., Jaczynska, K., Rizo, J. and McKnight, S.L. Oxidative regulation of TDP-43 self-association by a β-to-α conformational switch. Proc. Nat. Acad. Sci. 120 (41) e2311416120; https://doi.org/10.1073/pnas.2311416120 (2023)
Kato, M., “Molecular Mechanisms Defining the Structural Basis for Self-Association of the FUS Low-Complexity Domain”, Riki Kurokawa, ed., “Phase Separation in Living Cells”, Springer, Singapore, https://doi.org/10.1007 (2023)
Zhou, X., Kato, M., and McKnight, S.L. How do disordered head domains assist in the assembly of intermediate filaments? Curr. Opin. Cell Biol. 85, https://doi.org/10.1016/j.ceb.2023.102262 (2023)
加藤昌人 「神経変性疾患変異による線維凝集体形成の構造学的機構 ―low-complexityドメインの機能に与える影響」 小野賢二郎/編 「いま新薬で加速する神経変性疾患研究 異常タンパク質の構造、凝集のしくみから根本治療の真の標的に迫る」 実験医学増刊 Vol.41 No.12 ISBN 978-4-7581-0412-8 (2023)
Zhou, X., Sumrow, L., Tashiro, K., Sutherland, L., Liu, D., Qin, T., Kato, M., Liszczak, G., McKnight, S.L. Mutations linked to neurological disease enhance self-association of low-complexity protein sequences. Science, Vol 377, Issue 6601, DOI: 10.1126/science.abn5582 (2022)
加藤昌人,白木賢太郎,中川真一/編 「フロントランナー直伝 相分離解析プロトコール」 実験医学別冊 最強のステップUPシリーズ ISBN 978-4-7581-2259-7 (2022)
Kato, M., Zhou, X., and McKnight, S.L. How do protein domains of low sequence complexity work? RNA. 28: 3-15, doi: 10.1261/rna.078990.121 (2022)
Kato, M.*, and McKnight, S.L. The low-complexity domain of the FUS RNA binding protein self-assembles via the mutually exclusive use of two distinct cross-β cores. Proc. Nat. Acad. Sci. 118, e2114412118; https://doi.org/10.1073/pnas.2114412118 (2021) (* corresponding authors)
廣瀬哲郎,加藤昌人,中川真一/編 「相分離 メカニズムと疾患」 実験医学増刊 Vol.39 No.10 ISBN 978-4-7581-0395-4 (2021)
Kato, M., Tu, B.P. and McKnight, S.L. Redox-mediated regulation of low complexity domain self-association. Curr Opin Genet Dev. (2021) Jan 14;67:111-118. doi: 10.1016/j.gde.2020.12.006.
