タンパク質の立体構造解析に新たなモデルを提唱
―より正確な立体構造の観測や予測を実現!生命科学研究の進展に寄与―
(2022.5.27 発表)
キーワード:中性子結晶構造解析
 生命活動に欠かせないタンパク質は、多数のアミノ酸がペプチド結合により鎖状につながった分子です。そのはたらきを理解するには、タンパク質の複雑な立体構造を精密かつ正確に決定することがカギになります。タンパク質分子を構成する原子の約半分は水素原子です。そこで、研究チームは水素原子を直接観察できる中性子結晶構造解析という手法に着目しました。
生命活動に欠かせないタンパク質は、多数のアミノ酸がペプチド結合により鎖状につながった分子です。そのはたらきを理解するには、タンパク質の複雑な立体構造を精密かつ正確に決定することがカギになります。タンパク質分子を構成する原子の約半分は水素原子です。そこで、研究チームは水素原子を直接観察できる中性子結晶構造解析という手法に着目しました。
具体的には、中性子ビームを結晶状態にしたタンパク質試料に照射して、回折(散乱)された中性子を検出器で記録し、その回折強度から計算によって分子の立体構造を導きます。
成果のポイント
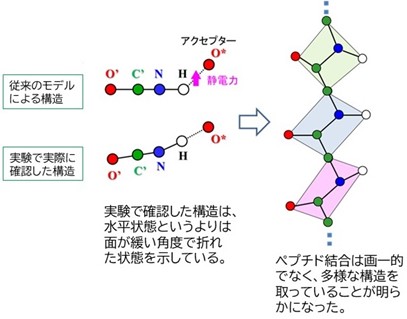
その1:ペプチド結合は多様な構造をしていた!
タンパク質の高精度な立体構造解析をすることは難しく、「ペプチド結合はすべて同じ平面構造を取る」という仮定(モデル)を用いるしかありませんでした。研究チームは中性子結晶構造解析により、高電位鉄イオウタンパク質(HiPIP)の全原子構造を1.2オングストローム分解能という極めて高い解像度で決定することに成功しました。その結果、タンパク質内の電子状態によってペプチド結合の平面性が影響を受け、多様な構造を取ることを世界で初めて明らかにしました。
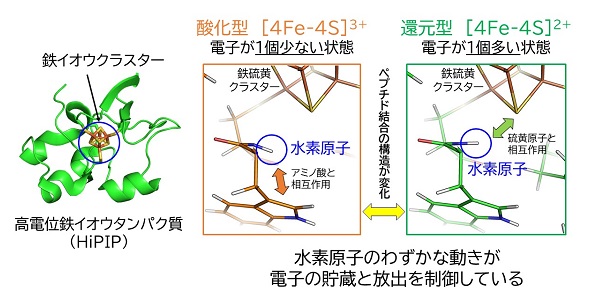
その2:HiPIPの電子伝達は、水素原子のわずかな位置の違いで制御されている!
HiPIPは光合成反応に関わるタンパク質の1つです。光合成をおこなう細菌中で電子の受け渡しをする、言わば「電子の運び屋」です。HiPIPは鉄イオウクラスターに電子が1個多い状態(還元型)から、反応中心に電子を1個渡すことで、電子の1個少ない状態(酸化型)に変化し電子伝達反応が進行します。約2千原子からなるHiPIP中のたった1つの水素原子のわずかな位置の違いが、電子の貯蔵と放出を制御していることを突き止めました。
今後の展開
鉄イオウクラスターは光合成のほか、呼吸、酵素反応、遺伝子代謝など様々な生体反応に関わっています。本成果で得たペプチド結合の平面構造の新たなモデルを用いてタンパク質の精密な構造決定を行うことで、これら生体反応の理解をより深めることができます。ここから得られる知見は、医学、薬学、工学分野において幅広い応用が期待されます。
研究に携わった人

関連リンク
プレスリリース https://www.qst.go.jp/site/press/20220527.html
掲載論文情報 10.1126/sciadv.abn2276
