
 タンパク質などの生体分子は、大きいものでは数百万を超える原子が特定の形を形成かつ変化させることで、その分子固有の機能を発揮します。私達の研究チームでは、複数の量子技術(放射光X線/中性子回折・散乱など)を量子化学計算やシミュレーションにより組み合わせた研究開発に、千葉と東海(茨城)の2か所において取り組んでいます。この取り組みを通じて、生体分子を構成するすべての原子情報を含む「高精度」で、その機能を反応のすべてにおいて「連続的」に、理解することが可能になると考えています。私達の究極の目標は従来の「原子」構造生物学を超えた「量子」構造生物学の創成です。
タンパク質などの生体分子は、大きいものでは数百万を超える原子が特定の形を形成かつ変化させることで、その分子固有の機能を発揮します。私達の研究チームでは、複数の量子技術(放射光X線/中性子回折・散乱など)を量子化学計算やシミュレーションにより組み合わせた研究開発に、千葉と東海(茨城)の2か所において取り組んでいます。この取り組みを通じて、生体分子を構成するすべての原子情報を含む「高精度」で、その機能を反応のすべてにおいて「連続的」に、理解することが可能になると考えています。私達の究極の目標は従来の「原子」構造生物学を超えた「量子」構造生物学の創成です。

チームリーダー 玉田 太郎
メンバー
 玉田 太郎 チームリーダー
玉田 太郎 チームリーダー
栗原 和男 上席研究員
横谷 立子 上席研究員
平野 優 上席研究員
廣本 武史 主幹研究員
安田 武嗣 主幹研究員
清水 瑠美 主幹技術員
河野 史明 主幹技術員
江澤 理徳 博士研究員
成沢 栄子 業務補助員
吉田 千香 業務補助員
谷中 智子 業務補助員
坂井 みずき 連携大学院生
鈴木 夢咲 連携大学院生
寺島 響紀 連携大学院生
武藤 大将 QSTスチューデントリサーチャー
研究TOPICS
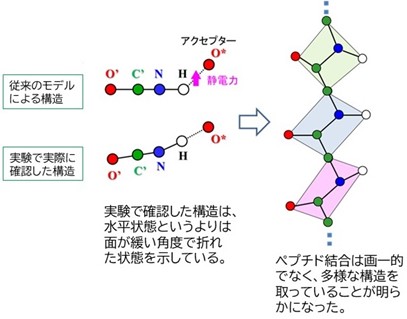 タンパク質の立体構造解析に新たなモデルを提唱
タンパク質の立体構造解析に新たなモデルを提唱
通常のタンパク質の立体構造解析では実験データ数に限りがあるため、「ペプチド結合はすべて同じ平面構造を取る」という仮定(モデル)を用いるしかありませんでした。研究チームは、タンパク質を構成する原子の約半分を占める水素原子の観察に長けた中性子結晶構造解析により、高電位鉄イオウタンパク質(HiPIP)の全原子構造を1.2オングストローム分解能という極めて高い解像度で決定することに成功しました。その結果、タンパク質内の電子状態によってペプチド結合の平面性が影響を受け、多様な構造を取ることを世界で初めて明らかにしました。
本成果で得たペプチド結合の平面構造の新たなモデルを用いてタンパク質の精密な構造決定を行うことで、光合成のほか、呼吸、酵素反応、遺伝子代謝などの生体反応の理解をより深めることができます。ここから得られる知見は、医学、薬学、工学分野において幅広い応用が期待されます。
もっと詳しく
プレスリリース https://www.qst.go.jp/site/press/20220527.html
3分で読める研究成果 https://www.qst.go.jp/site/iqls/3mini220728.html
論文情報 https://www.science.org/doi/10.1126/sciadv.abn2276
2021年度以前の研究TOPICS
2024年度の成果
原著論文
- Hattori, Y., Nagata, K., *Watanabe, R., Yokoya, A., *Imaoka, T. “Super-competition as a Novel Mechanism of the Dose-rate Effect in Radiation Carcinogenesis: A Mathematical Model Study” Radiat. Res. 203, 61-72. (2025)
- *Yasuda, T., Nakajima, N., Ogi, T., Yanaka, T., Tanaka, I., Gotoh, T., Kagawa, W., Sugasawa, K., Tajima, K “Heavy water toxicity via isotope effects: Stronger than high-dose radiation, neutralized by light water” Plos Water 4, e0000292. (2025)
- *Nakano, T., Akamatsu, K., Kohzaki, M., Tsuda, M., Hirayama, R., Sassa, A., Yasui, M., Shoulkamy, M., Hiromoto, T., Tamada, T., Ide, H., *Shikazono, N. “Deciphering repair pathways of clustered DNA damage in human TK6 cells: Insights from atomic force microscopy direct visualization” Nucleic Acid Res. 53, gkae1077. (2025)
- *Yukawa, H., *Kono, H., Ishiwata, H., Igarashi, R., Takakusagi, Y., Arai, S., Hirano, Y., Suhara, T., *Baba, Y. “Biological Nano Quantum Sensors, Quantum Technology-Based Hyperpolarized MRI/NMR, Quantum Biology, and Quantum Biotechnology” Chem. Soc. Rev. D4CS00650J. (2025)
- *Yasuda, T., Nakajima, N., Ogi, T., Yanaka, T., Tanaka, I., Gotoh, T., Kagawa, W., Sugasawa, K., Tajima, K “Heavy water inhibits DNA double-strand break repairs and disturbs cellular transcription, presumably via quantum-level mechanisms of kinetic isotope effects on hydrolytic enzyme reactions” Plos One 19, e0309689. (2024)
- Nagata, K., Nishimura, M., Daino, K., Nishimura, Y., Hattori, Y., Watanabe, R., Iizuka, D., Yokoya, A., Suzuki, K., Kakinuma, S., *Imaoka, T. “Luminal progenitor and mature cells are more susceptible than basal cells to radiation-induced DNA double-strand breaks in rat mammary tissue” J. Radiat. Res. 65, 640-650. (2024)
- #Mouhand, A., #Nakatani, K., Kono, F., Hippo, Y., Matsuo, T., Barthe, P., Peters, J., *Suenaga, Y., *Tamada, T., *Roumestand, C. “1H, 13C and 15N backbone and side-chain resonance assignments of the human oncogenic protein NCYM” Biomol. NMR Assign. 18, 65-70 (2024)
和文誌
- 玉田 太郎、廣本 武史「中性子結晶構造解析による酵素触媒反応の反応理解」触媒、66, 216-221(2024)
- 平野 優、玉田 太郎、「量子構造生物学の医学応用への期待」医学のあゆみ、290, 309-314 (2024)
2023年度の成果
原著論文
- Fukuda, Y., *Lintuluoto, M., Kurihara, K., Hasegawa, K., *Inoue, T., *Tamada, T. “Overlooked hydrogen bond in a blue copper protein uncovered by neutron and sub-ångström resolution X-ray crystallography” Biochemistry 63, 339-347. (2024)
- Yamamoto, S., Kono, F., Nakatani, K., Hirose, M., Hirai, K., Hippo, Y., Tamada, T., *Suenaga, Y., *Matsuo, T. “Structural characterization of human de novo protein NCYM and its complex with a newly identified DNA aptamer using atomic force microscopy and small-angle X-ray scattering” Front. Oncol. 13, 1213678. (2023)
- *Hanazono, Y., Hirano, Y., Tamada, T., Miki, K. “Description of peptide bond planarly from high-resolution neutron crystallography” Biophysics and Physicobiology 20, e200035. (2023)
- Ura, T., Sakakibara, N., Hirano, Y., Tamada, T., Takakusagi Y., Shiraki, K., *Mikawa, T. “Activation of oxidoreductases by the formation of enzyme assembly” Sci. Rep. 13, 14381. (2023)
- Hiromoto, T., Nishikawa, K., Inoue, S., Ogata, H., Hori, Y., Kusaka, K., Hirano, Y., Kurihara, K., Shigeta, Y., *Tamada, T., *Higuchi, Y. “New insights into the oxidation process from neutron and X-ray crystal structures of an O2-sensitive [NiFe]-hydrogenase” Chem. Sci.. 14, 9306-9315. (2023)
- *Murakawa, T., Kurihara, K., Shoji, M., Yano, N., Kusaka, K., Kawano, Y., Suzuki, M., Shigeta, Y., Yano, T., Adachi, M., Tanizawa, K., *Okajima, T. “Neutron crystallography of a semiquinone radical intermediate of copper amine oxidase reveals a substrate-assisted conformational change of the peptidyl quinone cofactor” ACS Catal. 13, 12403-23413 (2023)
- #Kuroki, C., #Hirano, Y., Nakazawa, M., Sakamoto, T., *Tamada, T., *Ueda, M. “A single mutation Asp43Arg was increased 2.5-fold the catalytic activity and maintained the stability of cold-adapted endo-1,4-beta glucanase (Ef-EG2) from Eisenia fetida” Curr. Res. Biotechnol. 5, 100126. (2023)
和文誌
- 玉田 太郎、平野 優「光を電気化学的エネルギーに変換するメカニズム」量子生命ハンドブック、第2編・第1章・第2節(2023)
2022年度以前の成果
Contact
量子生命科学研究所 量子生命構造グループ 構造生物学チーム
所在地:QST千葉地区 〒263-8555 千葉市稲毛区穴川4-9-1
