たんぱく質中の水素原子計測
たんぱく質は、微生物からヒトまで、すべての種の生命活動を担っている分子で、生命反応を精妙に制御する、極めて小さくかつ精密な「分子機械」と言える。そのメカニズムを理解するためには、たんぱく質の分子の立体構造を原子・電子レベルで正確に決定することが必要で、この研究分野を構造生物学と呼ぶ。
たんぱく質の立体構造は複雑で、20種類のアミノ酸(水素、炭素、酸素、窒素、硫黄原子からなる)がペプチド結合で鎖状に繋がり、折り畳まることで形作られる。こうした立体構造の決定には、結晶化したたんぱく質にX線を照射する方法が主に利用されている。しかし、X線の場合、原子中の電子と相互作用するため、たんぱく質の半分を占める水素原子(軌道電子数1個)の計測は難しい。そこで中性子の出番だ。中性子は原子核と直接作用するため、たんぱく質を構成する他の原子と同様に水素原子を計測できる。量子科学技術研究開発機構(QST)では、文部科学省の光・量子飛躍フラッグシッププログラム(Q-LEAP)「量子生命技術の創製と医学・生命科学の革新」等に参画し、中性子を用いた超精密構造生物学を推進している。
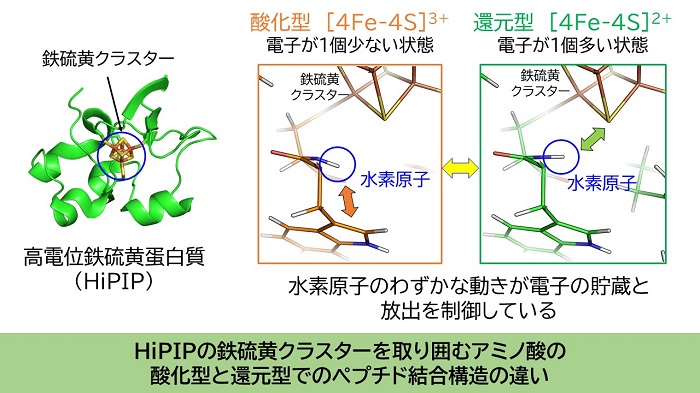 光合成反応にも多くのたんぱく質が関わっている。その内の1つが高電位鉄硫黄たんぱく質(HiPIP)である。HiPIPは光合成を行う細菌中で、たんぱく質間の電子の受け渡しを担っている「電子の運び屋」だ。QSTでは中性子を用いて水素を含むHiPIPの立体構造を1.2オングストローム(100億分の1メートル)という極めて高い精度で決定した。その結果、これまで実験的な限界から画一的に扱わざるを得なかったペプチド結合が、実はたんぱく質中で多様な構造を取っていることを世界で初めて明らかにした。また、HiPIPが電子を受け渡す際には、電子の貯蔵と放出を伴うが、このメカニズムは約2千原子からなるHiPIP中のたった1個の水素原子のわずかな位置の違いにより制御されていることを突き止めた。
光合成反応にも多くのたんぱく質が関わっている。その内の1つが高電位鉄硫黄たんぱく質(HiPIP)である。HiPIPは光合成を行う細菌中で、たんぱく質間の電子の受け渡しを担っている「電子の運び屋」だ。QSTでは中性子を用いて水素を含むHiPIPの立体構造を1.2オングストローム(100億分の1メートル)という極めて高い精度で決定した。その結果、これまで実験的な限界から画一的に扱わざるを得なかったペプチド結合が、実はたんぱく質中で多様な構造を取っていることを世界で初めて明らかにした。また、HiPIPが電子を受け渡す際には、電子の貯蔵と放出を伴うが、このメカニズムは約2千原子からなるHiPIP中のたった1個の水素原子のわずかな位置の違いにより制御されていることを突き止めた。
QSTは日本原子力研究開発機構が所有する研究用原子炉JRR-3にたんぱく質の中性子結晶構造解析が可能な装置を保有している。現在、より多くのたんぱく質の中性子解析を可能とする装置開発を進めている。

※本記事は2022年8月4日 日刊工業新聞22面(科学技術・大学)に掲載されました。
関連リンク
2022年5月27日発表プレスリリース:タンパク質の立体構造解析に新たなモデルを提唱―より正確な立体構造の観測や予測を実現!生命科学研究の進展に寄与-
3分で読める研究成果:タンパク質の立体構造解析に新たなモデルを提唱
