私たちが放射線や原子力を安心して利用できるためには、放射線の安全性がよくわかっていなければなりません。放医研は、創立時から、放射線安全に関する研究を続けていま す。動物実験によって放射線の健康リスクを解明する研究は、世界的に見ても、放医研が得意と してきた分野の一つです。
医療において子どもの検査や治療で放射線が利用されるようになったことから、データの不足している子どもに対する放射線のリスクについて動物を用いて研究してきました。ま た、JCO事故(1999年)後は中性子線被ばくのリスクについて、福島原発事故(2011年)後は低線量率被ばくのリスクについて、大きな関心 が寄せられ、これらに対して答える研究も行ってきました。
実験研究の成果はどのように人間に適用できるか
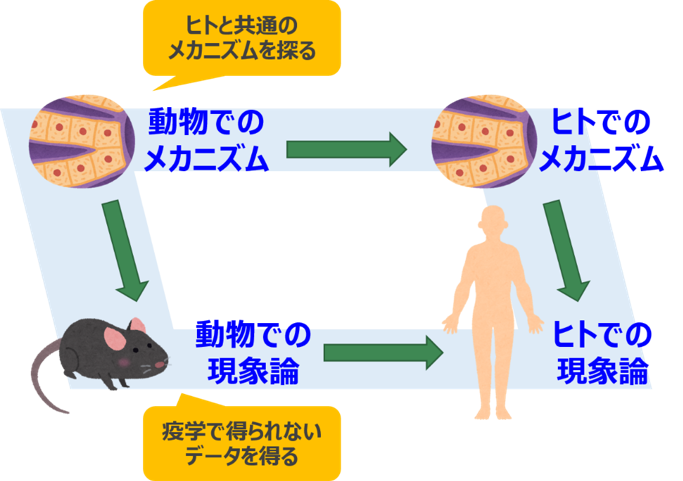
放射線影響の研究は、最終的には人間(ヒトという動物)での放射線影響の理解につながらなければなりません。動物を使って得られる実験研究の知見は、どのように役立つので しょうか。
人間を観察した研究(疫学)は、人間を直接観察する点が大変貴重ですが、放射線の線量は正しく測定されているか、被ばくした人々と被ばくしていない人々の生活習慣等の条件 は同じだといえるかなど、コントロールが難しいことがたくさんあります。また、これまでに人類が経験したことのないことは、疫学からはわかりませ ん。このような場合には、条件を厳密にコントロールでき、疫学のデータがないようなことも可能な、実験研究が役に立ちます。
また、実験で見られた現象のメカニズムの本質を追究し、その結果、それがヒトと共通だと考えられるものであれば、ヒトでも同様のことが起こるだろうと推論できます。特に、 実験で見られた現象のメカニズムを、数理的なモデルを用いて理解することができれば、ヒトにおいてはどのような現象が起こるかを定量的に予測する ことも可能です。
子どもの放射線被ばくリスク
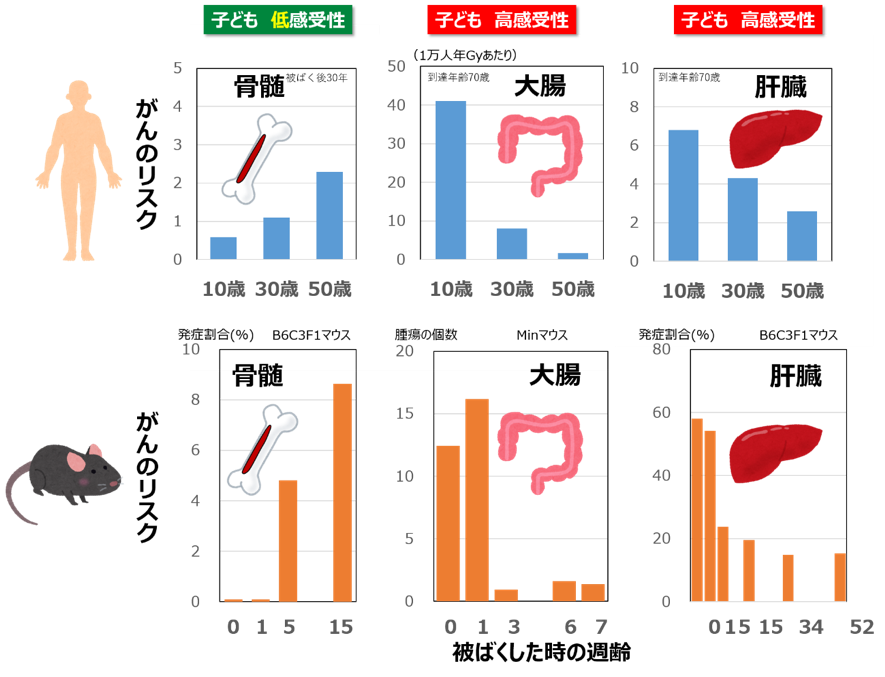
ここ10年、放医研では、感受性が高いと思われている「子ども」への放射線の影響、特に、将来のがんリスクについて、マウスなどを使った生物学的な研究を行ってきました。
まず確かめられたのは、同じ子どもの体、大人の体であっても、部位(組織)によって、感受性の傾向が違うということです。たとえば、骨髄性白血病(血液細胞のがんの一種) です。疫学でも動物実験でも、子どもの時の被ばくでは、大人と比べて、骨髄性白血病のリスクが上がりにくいことがわかっています。わたしたちが漠 然と持っている「子どもは感受性が高い」というイメージとは逆なのです。肺がんのリスクも、同じような傾向を示しました。一方、大腸がん、肝臓が んなどのリスクは、 子どもの時の被ばくの方が高い傾向を示しました。こちらは、一般的なイメージ通りです。
このように、子どもと大人では、放射線による将来のがんリスクの大小が組織ごとに違っています。なぜ、 こんな遣いがあるのでしょうか。
がんは、細胞の中にある遺伝子が異常になることが原因で起こります。放射線は、細胞の中の遺伝子を傷つけますが、細胞がなくなってしまえば、がんにはなりません。異常な遺 伝子を持った細胞が生き残って増えていくと、がんのリスクが高まります。
そこで、放射線を受けた後のそれぞれの組織で、細胞がどれだけ生き残って増えていくのか、子どもと大人の動物で比べる研究を行いました。
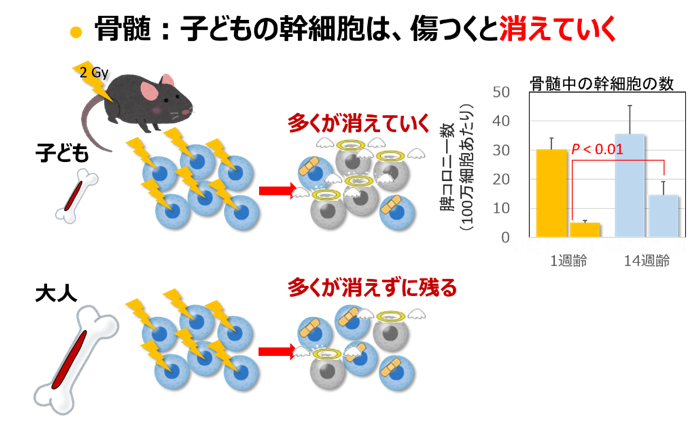
骨髄の中には、血液細胞を作って増やすための、幹細胞や前駆細胞と呼ばれる細胞があります。子どもの動物が放射線を受けるとこれらの細胞の数がかなり減りましたが、大人の 動物では数倍多くの細胞が生き残りました。残った細胞ががんの原因になりうることから、骨髄性白血病のリスクが大人の被ばくの方で高いことを説明 できます。
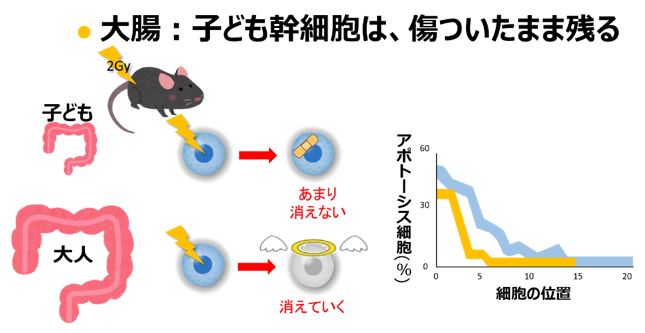
これとは逆に大腸の幹細胞は、子どもの動物が被ばくした後は多く残りますが、大人の動物では少なくなりました。肝臓では、子どもの時は細胞が分裂をして増えていますが、放 射線を受けたあとは分裂がさらに活発になりました(大人の動物の肝臓では、分裂はもとから止まっています)。大腸がんや肝臓がんのリスクが子ども の被ばくの方で高いことは、これで説明できます。
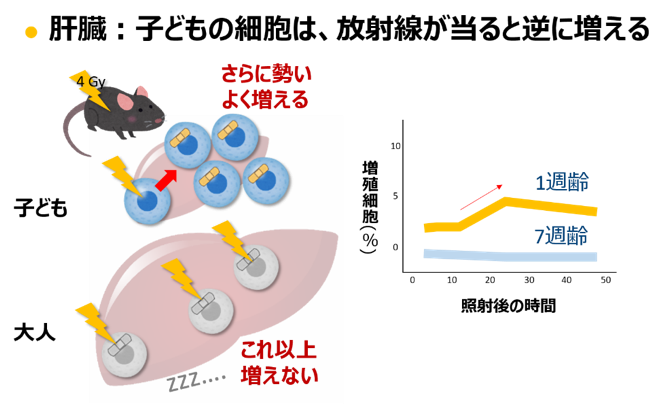
これまで、大腸の幹細胞は放射線を受けると生き残りにくい、放射線を受けた細胞はしばらく分裂をやめる、というのが常識でした。子どもの体では、これらの常識が当てはまら ないのです。
この研究成果は、疫学と動物で共通に見られる「年齢依存性」のメカニズムを提起し、「組織によって年齢依存性が異なる」という不思議な現象が、何かの間違いではなく、組織 ごとの生物学的な性質によるものであると教えてくれます。
関連論文
- Sasaki. Influence of the age of mice at exposure to radiation on life-shortening and carcinogenesis. J Radiat Res 32 Suppl 2:73-85 (1991)
- Miyoshi-Imamura et al. Unique characteristics of radiation-induced apoptosis in the postnatally developing small intestine and colon of mice. Radiat Res 173(3):310-318 (2010)
- Ariyoshi et al. Age dependence of hematopoietic progenitor survival and chemokine family gene induction after gamma irradiation in bone marrow tissue in C3H/He mice. Radiat Res 181(3):302-313 (2014)
- Shang et al. Radiation Exposure Enhances Hepatocyte Proliferation in Neonatal Mice but not in Adult Mice. Radiat Res 188(2):235-241 (2017)
リンパ腫に残された「放射線の爪痕」

放射線ががんのリスクを高める一つの理由は、放射線が細胞内のDNAを傷つける(酸化、切断などの化学変化を起こす)ことだと考えられています。特に、DNAの二重らせん を二本とも切断してしまう「DNA二重鎖切断」が起こると、細胞はこれを不正確にしか修復できないことが多いため、細胞が生き延びたとしても、 DNAに書かれた情報が変化する(突然変異が生じる)ことがあり得ます。これが、細胞の増殖や分化を制御する大事な遺伝子に生じた場合、その細胞 は、将来がんになりやすい細胞となって、体の中に残る可能性があります。
このような考え方が正しいのならば、放射線が起こしたがんの細胞では、大事な遺伝子が二重鎖切断でいったん切断され、不正確につなぎ直された痕跡のような突然変異が残って いると推測されます。いわば「放射線の爪痕」です。

このような爪痕を探す研究として、古くから、たとえばラドン(放射線を出す気体)の多い鉱山で肺がんになった鉱山労働者の肺がんのDNAで、突然変異するとがんの原因とな る「p53」という遺伝子を調べる研究などが行われましたが、この研究では放射線の爪痕と思われるものは見つかってきませんでした。

私たちは、放射線によってマウスに高頻度に発生する「胸腺リンパ腫」(ヒトの白血病と似た疾患で、がんの一種)の実験モデルに注目しました。放射線がDNAを切ってから細 胞がそれを不正確につなぎ直すと、DNA内の広い領域に渡って変化が起こることが予想されます。そこで、二種類のマウス(B6マウスとC3Hマウ ス)を交配して作ったマウスに放射線で胸腺リンパ腫を作り、そのリンパ腫のDNAの全体にわたって、B6マウスの特徴とC3Hマウスの特徴のうち どちらかが失われている場所がないかを調べました。この方法は、がんで突然変異が起こっている場所を探すのに、当時よく用いられた方法です。正常 な細胞のDNAでは、全体にわたってB6マウスとC3Hマウスの特徴が存在しますが、異常なDNAではどちらかが欠けている場所(ヘテロ接合性の 消失)があるのです。
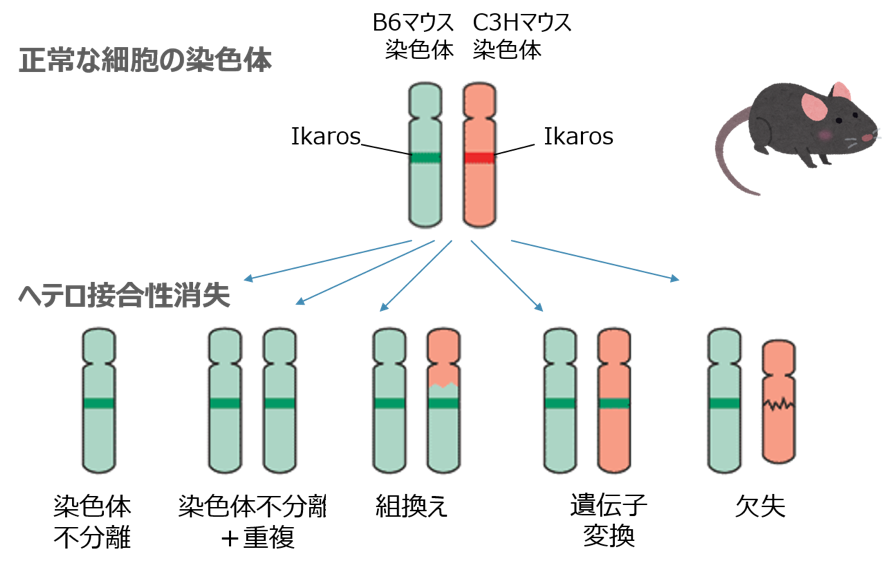
実験の結果、放射線が作った胸腺リンパ腫では、Ikaros(イカロス)と呼ばれる遺伝子の近くで、高頻度に、ヘテロ接合性の消失が見られることがわかりました。DNAを 切断しない化学物質で作った胸腺リンパ腫には、このような現象は見られませんでした。Ikarosは、胸腺でT細胞が成熟するために必要な働きを しており、これが失われるとT細胞は成熟せずに、未分化で増殖が活発な状態が維持されます。すなわち、放射線が未分化なT細胞のうちの一つで Ikaros遺伝子の近くのDNAを切断し、これをこの細胞が不正確に修復したために、B6マウスとC3Hマウスから受け継いだ2個の Ikaros遺伝子のうちの一方が消失して、リンパ腫になりやすい細胞が残されたと考えられるのです。放射線の爪痕の発見です。

この研究成果は、放射線がDNAを切断した場所を細胞が不正確に修復することで、大切な遺伝子に突然変異が起こり、がんリスクの増加につながるという考え方が、少なくとも マウスの胸腺リンパ腫では成り立つことを実証しました。
関連論文
- Shimada et al. Radiation-associated loss of heterozygosity at the Znfn1a1 (Ikaros) locus on chromosome 11 in murine thymic lymphomas. Radiat Res 154(3):293-300 (2000)
- Kakinuma et al. Spectrum of Znfn1a1 (Ikaros) inactivation and its association with loss of heterozygosity in radiogenic T-cell lymphomas in susceptible B6C3F1 mice. Radiat Res 157(3):331-340 (2002)
- Yoshida et al. Distinct structural abnormalities of chromosomes 11 and 12 associated with loss of heterozygosity in X-ray-induced mouse thymic lymphomas. Cancer Genet Cytogenet 179(1):1-10 (2007)
- Sunaoshi et al. The effect of age at exposure on the inactivating mechanisms and relative contributions of key tumor suppressor genes in radiation-induced mouse T-cell lymphomas. Mutat Res 779:58-67 (2015)
プレス発表・ニュース
私たちの研究成果については、以下の発表もご覧ください。
- https://www.qst.go.jp/site/nirs/news240501.html 被ばくによるがん死亡早期化のリスクはヒトとマウスで約100倍異なる~加齢、がん発生、被ばくの関連性を、数理的に解析することで解明~(2024年5月1日)
- https://www.qst.go.jp/site/press/20230623.html 遺伝子変異を「読み過ごす」薬で、がん予防に成功~遺伝性腫瘍に対する予防効果をモデルマウスの実験で明らかに~(2023年6月23日)
- https://www.qst.go.jp/site/press/20220822.html 遺伝性乳がんの新しい動物モデルの作製に成功 ―遺伝性乳がんが出やすくなる仕組みの解明や、予防法の研究開発への応用に期待―(2022年8月22日)
- https://www.qst.go.jp/site/press/20210624-1.html 中性子線の発がん影響の強さを正確に評価する方法を確立 - 世界の放射線防護基準の基礎となるデータの獲得が可能に -(2021年6月24日)
- https://www.qst.go.jp/site/press/20210305.html 食習慣の改善が大腸がんの発生を抑制する可能性を示唆 ~カロリー制限したマウスで被ばくによる消化管腫瘍を予防する効果を明らかに~(2021年3月5日)
- https://www.qst.go.jp/site/press/20914.html 放射線による発がんには遺伝子突然変異の誘発とは別のメカニズムがあることが判明―遺伝性のリンパ腫に生じる遺伝子変異の全体像を動物実験で 明らかに―(2019年3月25日)
- https://www.qst.go.jp/site/press/20432.html 「じわじわ」被ばくのがんリスク、子どもと大人の違いを初めて明らかに ―ラットの乳がん 線量率下げると大人の方ががんリスク大きく減少―(2019年2月4日)
- https://www.qst.go.jp/site/press/20785.html 被ばく後の乳がん 妊娠・出産経験によってリスク低下―ラットの実験でメカニズムも解明 乳がんリスクを低減する薬など開発の手がかりに― (2018年11月15日)
- https://www.qst.go.jp/site/press/1271.html 被ばくにより乳がんが発生する新たな仕組みを明らかに―リスク評価や予防法の開発に期待―(2018年5月25日)
- https://www.qst.go.jp/site/press/1184.html 「じわじわ」被ばくの発がん影響を動物実験で明らかに―モデルマウスを用いて低線量率被ばくに起因する発がんリスクを直接的に評価 ―(2016年12月13日)
- https://www.nirs.qst.go.jp/information/news/2012/1022.html 重粒子線治療の安全性について、実験で新知見―子どもの将来の乳がんリスク比較的小さい可能性―(2012年10月23日)

放射線安全や規制への貢献

私たちの生活のいろいろな面が、放射線をうまく利用することで成り立っています。一方、放射線を正しく使わないと、人体によくない影響をもたらす可能性もあります。そのた め、常に最新の科学的知見によって安全が担保されていなければなりません。私たちの行っている基礎研究は、そのような最新の科学的知見を生み出 し、放射線を安全に使うために役だっています。
国内のさまざまな放射線規制や医療におけるガイドライン等は、放射線の安全に関する国際的組織――国際放射線防護委員会(ICRP)、国際原子力機関(IAEA)など―― が出す勧告や基準に沿っています。その勧告や基準は、原子放射線の影響に関する国連科学委員会(UNSCEAR)等でまとめられた科学的知見に基 づいています。私たちの研究成果は、これらの国際的組織によって使われる科学的情報として貢献しています。
重要文献への最近の引用例
- UNSCEAR白書「低線量における放射線作用の生物学的メカニズム」(2012)に引用
- Imaoka et al. J Radiat Res 49(4): 349-360 (2008)
- Vares, Wang, Shang et al. Int J Radiat Biol 85(1): 70-86 (2009)
- 米国放射線防護測定審議会(NCRP)報告書171 (2012)に引用
- Yamauchi, Kakinuma, Shimada et al. Mutat Res 640(1-2), 27-37 (2008)
- 国際がん研究機関(IARC)モノグラフ100D「ヒト発がん原の総括:放射線」(2012)に引用
- Imaoka, Nishimura, et al. Int J Radiat Oncol Biol Phys 69:194-203 (2007)
- Imaoka, Okamoto, et al. Radiat Res 165:165-173 (2006)
- ICRP出版物127「イオンビーム放射線治療の放射線防護」(2014)に引用
- Imaoka, Nishimura, et al. Int J Radiat Oncol Biol Phys 69(1):194-203 (2007)
- ICRP出版物131「放射線防護のための発がんの幹細胞生物学」(2015)に引用
- Shimada et al. Radiat Res 137(1):118-123 (1994)
- Imaoka, Nishimura, et al. Int J Radiat Oncol Biol Phys 69:194-203 (2007)
- Imaoka, Nishimura, et al. Mol Carcinog 50(7):539-552 (2011)
- NCRP解説書 24「低線量放射線の健康影響:放射線生物学と疫学の統合の展望」(2015)に引用
- Nakano et al. Radiat Res 181(2):172-176 (2014)
- UNSCEAR 2020/2021報告書 附属書C「低線量・低線量率放射線の発がんリスク推定に関連する生物学的機構」に引用 (2021)
- Ishida et al. Carcinogenesis 31(9):1694-1701 (2010)
- Ishii-Ohba, et al. Mutat Res 619(1-2):124-133 (2007)
- Nakajima et al. J Radiat Res 49(6):661-666 (2008)
- Nakajima et al. J Radiat Res 58(4):421-429 (2017)
- Takabatake et al. Radiat Res 166(1Pt1):61-72 (2006)
- Tsuruoka et al. Radiat Res 186(4):407-414 (2016)
- Vares et al. J Radiat Res 52(2):249-256 (2011)
- Yamada et al. Radiat Res 187(2):210-220 (2017)
- Wang et al. J Radiat Res 55(1):84-96 (2014)






