分析機器の適格性評価
分析機器の適格性評価 (Qualification)とは、医薬品の試験検査の信頼性の根幹であり、分析機器やそのオプション品が適切に据え付けられ、正しく機能し、そして実際に期待される結果が得られることを確認し、記録することです。適格性評価は分析機器バリデーション (Validation)に必須の前提条件であり、試験検査の信頼性保証に必須の機器の評価と言えます。
分析機器の適格性評価は、DQ (Design Qualification : 設計時適格性評価)から始まり、IQ (Installation Qualification : 据付時適格性評価)、OQ (Operational Qualification : 運転時適格性評価)を経てPQ (Performance Qualification : 稼働性能適格性評価)の4つのステップで完了となります。
- DQ:購入前に試験に用いる装置の機能性能仕様や機器メーカーに対する要求事項を決定
↓ - IQ:DQ要求を満たす装置が据え付けられたことを確認
↓ - OQ:DQ要求を満たす一般性能が発揮されていることを確認
↓ - PQ:実試料による分析時にその分析に必要な性能が維持されていることを確認
各適格性評価結果が良好であることが確認されることで、初めて分析結果の品質保証が担保されます。
PET薬剤の試験検査においては、適格性評価が必要な代表的な機器としてGCやHPLCがあります。機器の購入時点でIQ/OQに対応していますが、購入後もその性能を維持していることを点検するため、1年に1回のOQ実施が必須となります。通常OQは点検項目が多く作業時間や費用がかかるため、PET施設が自ら行うことは困難です。
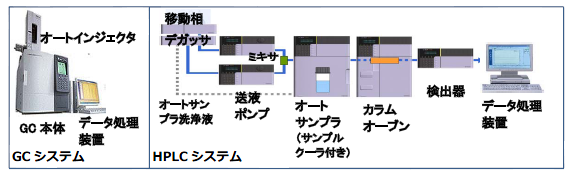
(株)島津製作所/(株)島津アクセスでは、iOQ (integrated OQ)と呼ばれるバリデーションシステムを含むサポートを提供しており、分析データに影響を与える性能点検のみを効率よく抽出してOQを実施することで、品質を落とすことなく従来より安価でのOQ実施が可能となりました。既に導入されている装置で、IQ/OQ未対応の機器についても対応可能です。詳細については、 (株)島津製作所/ (株)島津アクセスへお問い合わせください。
今後新規に分析機器の購入を検討される施設では、機器の適格性評価が適切に実施できるかという点も踏まえ、十分検討されることをお勧めいたします。
2015年掲載

