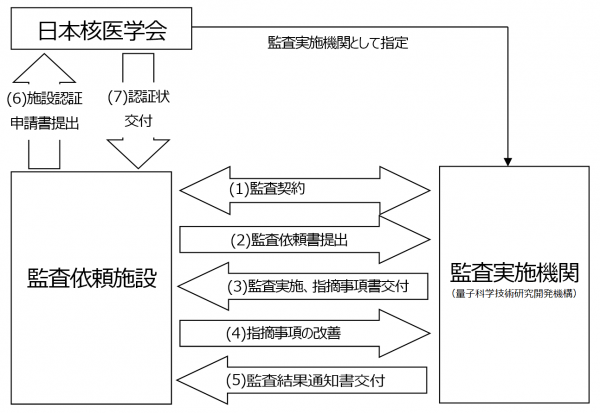
(1) 監査契約
監査依頼施設と監査実施機関(量子科学技術研究開発機構)の間で、監査契約を締結します。監査契約の手続きはこちらからご確認ください。
(2) 監査依頼書提出
監査契約の完了後、監査依頼様式から様式集をダウンロードし、「監査依頼書(監査依頼様式-1)」を量子科学技術研究開発機構 信頼性保証・監査室へ提出してください。記入例もありますので、参考にしてください。
(3) 監査実施、指摘事項書交付
監査依頼施設と量子科学技術研究開発機構の間で日程を調整し、監査を実施します。監査実施前に量子科学技術研究開発機構へ提出していただく書類等がありますので、詳細はPET薬剤製造施設認証の概要(量子科学技術研究開発機構外のホームページが開きます。)を参照してください。 監査最終日に指摘事項書をその場で交付します。
(4) 指摘事項の改善
指摘事項書で指摘された内容に対し、交付日(監査最終日)から30日以内に、指摘事項改善計画書(監査依頼様式-2)、指摘事項改善結果報告書(監査依頼様式-3)を提出します。30日以内に提出できない場合は、その旨を量子科学技術研究開発機構に連絡してください。
| 指摘事項の分類 | 対応内容 | 提出様式 |
|---|---|---|
| 重要度の高い項目の指摘事項 |
改善済みのもの※1 |
指摘事項改善結果報告書 (監査依頼様式-3) |
| その他の指摘事項 | 改善済みのもの | 指摘事項改善結果報告書 (監査依頼様式-3) |
| 次回監査までに改善予定のもの※2 | 指摘事項改善計画書 (監査依頼様式-2) |
|
| 指導事項 | 改善済みのもの | 指摘事項改善結果報告書 (監査依頼様式-3) |
| 次回監査までに改善予定のもの※2 | 指摘事項改善計画書 (監査依頼様式-2) |
※1:重要度の高い項目を全て改善しなければ、最終的な監査結果は不適合判定となります。
※2:その他の指摘事項や指導事項については、30日以内に全て改善する必要はありません(最終的な監査結果の評価は下がります。)。指摘事項改善計画書(監査依頼様式-2)に記載された項目については、次回監査時に改善状況を確認します
(5)監査結果通知書交付
指摘事項の改善結果を確認の後、量研機構より監査結果通知書が交付されます。監査結果通知書の交付は、指摘事項改善計画書(監査依頼様式-2)もしくは指摘事項改善結果報告書(監査依頼様式-3)の受領日から30日以内に行われます。
量研機構が監査依頼施設と直接やりとりをするのはここまでとなります。
(6)施設認証申請書提出
監査依頼施設ご自身で、PET薬剤製造施設認証の概要(量子科学技術研究開発機構外のホームページが開きます。)に掲載されている施設認証申請書を日本核医学会事務局へ提出します。施設認証申請書には、監査結果通知書の写しを添付します。診療用PET薬剤の場合には、同じく診療用PET薬剤製造施設認証の概要に掲載されている誓約書も合わせて提出します。
(7)認証状交付
日本核医学会より認証されると、PET薬剤製造施設認証状が発行されます。認証状と一緒に請求書が送られますので、認証料(認証状1枚につき5万円)を学会へ支払います。
認証の有効期間は3年間です。
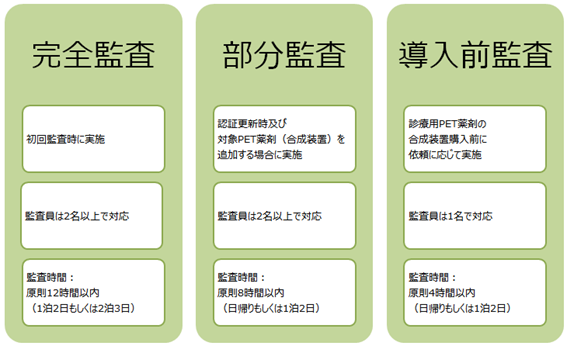
2.監査の分類
監査には、完全監査、部分監査、導入前監査、の3つの分類があります。導入前監査については、後に5.導入前監査で詳細を述べますが、監査は通常必要に応じて、全てのシステム(完全監査)または必要なシステム(部分監査)に対して行います。監査依頼施設が初めての監査を受ける際は完全監査を行いますが、認証更新及び対象PET薬剤(合成装置)追加の際は部分監査となる場合があります。
3.監査の方法
監査は、実地調査(Walk Through監査)と書面調査を同時に行います。それぞれ学会が公表しているWalkThrough監査チェックシート と学会製造基準監査チェックシート 、診療用学会製造基準監査チェックシート に従って確認をしていきます。
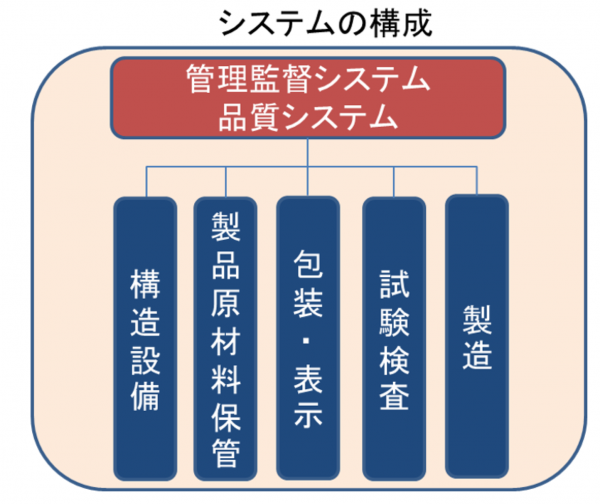
書面調査は、製造に係る重要な事項を6つのシステムに分けて行います。品質を確保するための重要なシステムである管理監督システムでは、製造管理の体制を評価し、その体制のもと、製造管理の実質的なシステムについて、調査します。
<監査のシステム分類>
1.管理監督システム(品質システム)
PET薬剤の製造や品質試験を適切な品質水準で行うための担保となる行為について、手順書が作成され、手順書を基に実施されていることを評価します。たとえば、変更管理、出荷判定、自己点検、バリデーションプロトコルや報告書などを含みます。
2.構造設備システム
PET薬剤製造に係る施設及び設備が適切に設計され、定期的に性能の適格性を確認していること、及び、その環境を維持するためのメンテナンスや清掃やモニタリングを行っていること等を確認します。
3.製品原料材料等保管システム
PET薬剤に組み込まれる原料や容器/栓等の材料を管理する方法と実施状況を確認します。保管管理や区分管理、保管設備機器の管理や校正、衛生管理などが手順書に記載され、かつ適切に実施されているかどうかを検査します。
4.包装・表示システム
PET薬剤の表示(ラベル)に関する実施状況を確認します。
5.試験検査システム
製造されたPET薬剤やその原材料及び資材の試験検査に係る事項を調査します。検体採取、試験検査の施設設備の管理状況や適格性評価、標準品の管理状況、安定性試験、バリデーションや校正の実施状況を検査します。
6.製造システム
PET薬剤の製造管理について調査します。
4.監査の評価基準と結果判定
監査内容は、「学会製造基準監査チェックシート」を用いて評価します。上記 3.で示した6つのシステムを大項目として分類し、更に各システムは中項目と小項目に分類されます。各項目の評価方法は下記の表のように行われます。
| 小項目毎の評価の分類 | 評価基準 |
|---|---|
| ○ | 問題なく対応できている。 |
| △ | 一部不備がある。 |
| × | 対応できていない。 |
| - | 該当しない。 |
| 中項目毎の評価の分類 | 評価基準 |
|---|---|
| ○ | 小項目が ◯ のみである。 |
| △ | 小項目に △ や × があるが、 重要度の高い項目(注)には × がない。 |
| × | 小項目の重要度の高い項目(注)に × がある。 |
| ― | 該当しない。 |
| システム毎の評価の分類 | 評価基準 |
|---|---|
| a (適合) | 中項目が ○ のみである。 |
| b (概ね適合) | 中項目に ○ が 2 分の 1 以上あり、 △ があるが、× がない。 |
| c (要改善) | 中項目の ○ が2分の1未満で、 △ があるが、× がない。 |
| d (不適合) | × がある。 |
| 総合判定の分類 | 判定基準 |
|---|---|
| A (適合) | システム毎の評価が a のみである。 |
| B (概ね適合) | システム毎の評価は a または b のみ。 |
| C (要改善) | システム毎の評価に c はあるが、 d はない。 |
| D (不適合) | システム毎の評価の中に d がある。 |
注) ここでいう重要度の高い項目とは、一定の品質のPET薬剤を安定して供給していることを示す記録(記録様式含む)、品質保証体制(間違いが起こらない仕組み)に関する記録(記録様式含む)、及び無菌操作及び試験検査を適切に実施するための手順書及び記録とします。
5.導入前監査について
PET薬剤の合成装置購入や施設整備を行う前に、必要に応じて現状の施設設備の適格性状況の確認を行う「導入前監査」を受けることが出来ます。診療用PET薬剤に関して導入前監査を受ける必要があるかどうかについては、診療用PET薬剤合成装置の販売メーカーにご相談ください。導入前監査の監査内容については、導入前監査チェックシートに記載しています。
- 「分子イメージング臨床研究に用いるPET薬剤についての基準 I.製造基準」準拠に関する施設認証(研究用PET薬剤製造施設認証)の概要
- 「分子イメージング臨床研究に用いるPET薬剤についての基準 I.製造基準」に準拠した、承認医療機器を用いた診療用PET薬剤の院内製造管理体制についての施設認証の概要(診療用PET薬剤製造施設認証の概要)
より抜粋、一部改変
詳細は、日本核医学会ホームページ(量子科学技術研究開発機構外のホームページが開きます。)より確認、上記文書は、同じく日本核医学会ホームページ(量子科学技術研究開発機構外のホームページが開きます。)ダウンロード可能です。